病理生理学重点总结
绪论
病理生理学:研究疾病发生的原因和条件,研究疾病全过程中患病体的机能、代谢的动态变化及其机制,从而揭示疾病发生、发展和转归的规律,阐明疾病的本质,为疾病的防治提供理论依据。
特点:研究对象,患病体;研究角度:机能、代谢;研究目的,阐明本质;研究任务,为防治提供理论依据。
基本病理过程(basic pathological process):指多种疾病中可能出现的、共同的、成套的功能、代谢和结构的变化。
一、 疾病概论
1、 疾病:是指机体在一定条件下由病因与机体相互作用而产生的一个损伤与抗损伤斗争的有规律过程,体内发生一系列功能、代谢和形态结构的变化,机体与环境间的协调发生障碍,从而临床表现出不同的症状和体征,使机体对环境的适应能力的劳动能力降低或丧失。
(3)局部与整体的关系
2、 现代死亡的概念:指机体作为一个整体的功能不可逆性停止,即机体完整性的解体。
死亡的标志——脑死亡(brain death):全脑功能不逆性的永久性停止,即机体完整性的解体。
判断死亡的依据(标准)
①不右逆性昏迷和大脑无反应性;②自主呼吸停止,至少进行15分钟人工呼吸仍无自主呼吸;
③瞳孔散大或固定;④颅神经反射消失(如瞳孔反射、角膜反射、咳嗽反射、吞咽反射等);
⑤脑电波消失;⑥脑血循环完全消失(脑血管造影)。
3、 疾病的经过:潜伏期→前驱期→症状明显期→转归期(死亡、康复)
4、 死亡分期:濒死期、临床死亡期、生物学死亡期。
水、电解质代谢障碍
水、钠代谢
一、体液的容量和分布60%
包括血浆5%、组织液15%和细胞内液40%,因年龄、性别、胖瘦而不同,
二、体液渗透压
l晶体渗透压2胶体渗透压(colloid osmotic pressure) :
正常血浆渗透压:280~310 mmol/L
三、电解质的生理功能和平衡
正常血清钠浓度:130 ~ 150mmol/L 排泄特点:多吃多排,少吃少排,不吃不排
正常血清钾浓度:3.5 ~ 5.5mmol/L 排泄特点:多吃多排,少吃少排,不吃也排
四、.水、钠正常代谢的调节
渴中枢抗利尿激素(ADH)醛固酮 心房利钠肽(ANF)
水、钠代谢紊乱
一、脱水 (Dehydration)
概念:多种原因引起的体液容量明显减少(>2%体重),并出现一系列机能、代谢变化的病理过程。
(一) 低渗性脱水(hypotonic dehydration)/低容量性低钠血症(hypovolemic hyponatremia)
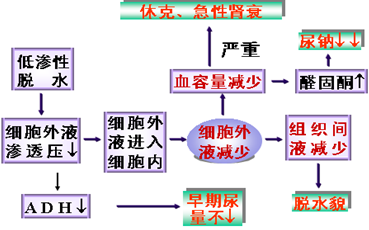 特征:失盐大于失水,血钠小于130mmol/L,血浆渗透压小于280 mmol/L。
特征:失盐大于失水,血钠小于130mmol/L,血浆渗透压小于280 mmol/L。
原因和机制: 体液丢失,只补水而未及时补钠
1、经消化道和皮肤等失液,只补水未补盐;
2、经肾丢失
(1)长期使用利尿剂,如速尿、利尿酸等,抑制髓袢升支对Na+的重吸收
(2)肾实质性疾病
(3)肾上腺皮质功能减退
对机体影响: 脱水,只补水而未补盐,使细胞外液渗透压降低,细胞外液进入细胞内,细胞外液减少为主
 (二)高渗性脱水/低容量性高钠血症 (hypertonic dehydration)
(二)高渗性脱水/低容量性高钠血症 (hypertonic dehydration)
特点:失水大于失钠,,血浆渗透压大于310 mmol/L,血钠高于150mmol/L的脱水。
原因:失水过多加上饮水不足。
对机体的影响: 失水多于失盐,使细胞外渗透压升高,细胞内液进入细胞外,细胞内液减少为主。
(三)等渗性脱水(isotonic dehydration)
特点 :水盐成比例丧失 血清[Na+]=130~150 mmol/L
血浆渗透压=280~310 mmol /L
对机体的影响:脱水,水盐成比例丧失,细胞外液、细胞内液均减少
防治原则:1.治疗原发病2.补液先盐后糖,一盐一糖
二、水肿 (Edema)
(一)概念 1、水肿:过多液体(等渗液)在组织间隙或体腔中积聚的病理过程称为水肿。
(二)水肿的发病机制
1 血管内外液体交换失平衡(组织液生成↑)
(1)毛细血管流体静压↑2)血浆胶体渗透压↓(3)微血管壁通透性↑ ® 组织液胶体渗透压(4)淋巴回流受阻
2 体内外液体交换失平衡(水、钠潴留)
(1)肾小球滤过率(GFR)↓ (2)近曲小管重吸收钠、水↑ (3)远曲小管和集合管重吸收钠、水↑
(四)水肿对机体的影响
三、水中毒(water intoxication)/高容量性低钠血症
概念 水摄入过多或排出减少,使水在细胞内外大量潴留,导致稀释性低钠血症,并产生中枢神经系统症状
特点体液明显增多,水潴留血浆渗透压<280mmol/L,血Na+浓度<130mmoI/L
原因: 过多的低渗性体液在体内潴留。 1 水摄入过多 2 水排出减少
钾代谢障碍
一、正常钾代谢
血浆钾:3.5~5.5mmol/L
钾生理作用:维持细胞新陈代谢;维持神经肌肉兴奋性及心脏正常功能;维持细胞渗透压及酸碱平衡
钾平衡
1.来源:食物2. 去路:肾脏排泄(90%)-主要部位:远曲小管、集合管 特点:多吃多排,少吃少排,不吃也排。
3. 钾的跨细胞转移
影响因素:激素细胞外液钾浓度酸碱平衡渗透压
二、钾代谢紊乱
Ø 低钾血症(hypokalemia)
(一)概念:血清[K+] < 3.5mmol/L,并伴有低血钾的症状和体征,称为低钾血症。
(二)原因和机制
1、钾摄入不足 2、钾丢失过多 3.细胞外钾向细胞内转移
(三)对机体的影响:
1.神经肌肉的兴奋性降低:精神萎靡、肌无力、呼吸肌麻痹、胃肠运动功能减退;
2.心律失常:主要表现:心肌兴奋性增高、传导性下降、自律性增高、收缩性升高→心律失常 (三高一低)(机制很重要,ppt上的图自己找一下)房室早博、心动过速甚至室颤;心电图:T波低平,出现U波;
3.代谢性碱中毒;反常性酸性尿;
4.肾功能障碍:尿浓缩功能障碍-多尿、低比重尿。
三.高钾血症(hyperkalemia)
(一)概念:血清[K+] > 5.5mmol/L,并伴有高血钾的症状和体征,称为高钾血症。
(二)原因和机制: 1.摄入过多 2.肾排钾减少(1)GFR下降 (2)醛固酮分泌↓3.细胞内钾转移到细胞外
(三)对机体的影响:
1.神经肌肉的兴奋性先高后低
2. 心律失常,停搏
心肌兴奋性(轻↑重↓)、传导性下降、自律性下降、收缩性下降→心脏停搏
3、对酸碱平衡的影响——酸中毒
机制: 细胞内H+释出,肾小管排泌H+减少(反常碱性尿)
酸碱平衡紊乱(acid-base imbalance)
尽管机体对酸碱负荷有很大的缓冲能力和有效的调节功能,但许多因素可以引起酸碱负荷过度或调节机制障碍导致体液酸碱度稳定性破坏,这种稳定性破坏称为酸碱平衡紊乱
单纯性酸碱平衡紊乱
 1. pH :溶液中H+浓度的负对数。
1. pH :溶液中H+浓度的负对数。
2. PaCO2:动脉血二氧化碳分压, 正常值: 40mmHg
3. 标准碳酸氢盐(standard bicarbonate,SB) : 标准条件下测得的血浆HCO3- 浓度。
实际碳酸氢盐(actual bicarbonate, AB ) : 实际条件下测得的血浆HCO3-浓度。
正常值: 24 mmol/L
4. 缓冲碱buffer bases (BB) :血液中一切具有缓冲作用的阴离子总量。正常值: 48 mmol/L
5. 碱剩余base excess (BE) 标准条件下,将1升全血或血浆滴定到 pH 7.4所需的酸或碱的量。正常值: 0±3 mmol/L
6. 阴离子间隙anion gap (AG) :血浆中未测定阴离子(UA)与未测定阳离子(UC)的 差值。正常值: 10~14mmol/L
代谢性酸中毒 (metabolic acidosis)
(一)概念: 由细胞外液血浆H+增加和[HCO3-]丢失引起的[HCO3-]的原发性减少所而导致的pH下降。
(二)原因 主要原因: 固定酸过多, HCO3-丢失↑
1.HCO3-丢失过多 (1)直接丢失过多:(2)血液稀释,使HCO3-浓度下降
2. 固定酸过多,HCO3-缓冲丢失:1固定酸产生过多:乳酸酸中毒 酮症酸中毒2)外源性固定酸摄入过多:3)固定酸排泄障碍
3.高血钾: K+与细胞内H+交换 远曲小管上皮泌H+减少 (反常性碱性尿)
(三)分类
1.AG增高性代酸 特点:AG升高,血氯正常 机制:血浆固定酸↑
2.AG正常性代酸 特点:AG正常,血氯升高 机制:HCO3-丢失↑
(四)机体的代偿调节
 高血钾性酸中毒时:
高血钾性酸中毒时:
肾小管K+-Na+交换增加
H+-Na+交换减少,泌H+减少
酸中毒病人排出碱性尿
指标的变化趋势
SB AB BB均降低, BE 负值加大
继发PaCO2下降 AB<SB
(六)对机体的影响
1心血管系统 (1)心律失常 (血钾增高所致) 酸中毒→ 高钾血症
Ø 细胞外H+进入细胞内,细胞内K+进入细胞外,血钾升高;
Ø 肾小管上皮细胞内H+增多,故H+/Na+交换↑,K+/Na+交换↓,排K+↓导致血钾升高。
(2)心肌收缩力降低 (与钙竞争结合肌钙蛋白;抑制钙内流;抑制肌浆网释放钙)
(3)血管系统对儿茶酚胺的反应性降低
CNS:中枢抑制 GABA生成增多;ATP生成降低 电解质代谢:高钾血症 细胞内外氢钾交换增加;肾脏排氢增多,排钾减少。
(七)防治原则 1 防治原发病 2 改善微循环,维持电解质平衡 3 应用硷性药
呼吸性酸中毒 (respiratory acidosis) 由CO2排出障碍或吸入过多引起的PaCO2(或H2CO3)原发性升高所导致的pH下降。 代谢性碱中毒 (metabolic alkalosis) 由细胞外液碱增多或H+丢失过多引起的血浆[HCO3-]的原发性升高导致的pH升高。
呼吸性碱中毒 (respiratory alkalosis) 由于肺通气过度引起的PaCO2(或H2CO3)原发性减少导致的pH升高。
★酸碱平衡紊乱判定步骤
根据pH判定是酸中毒还是碱中毒
根据病史、HCO3-和PaCO2原发改变判断是代谢性还是呼吸性
根据代偿公式判断是单一性还是
缺氧
第一节 概述
概念:运送氧可利用氧发生障碍蛙,机体发生功能、代谢、形态结构改变的病理过程
血氧指标①血氧分压(PO2)②血氧容量③血氧含量④血氧饱和度(SO2)
定义:指Hb结合氧的百分数(血氧含量-溶解的氧量)/血氧容量*100%
影响因素:PO2 体温、2,3—DPG
第二节 缺所的类型、原因和发生机制
缺氧的类型:
1、低张性缺氧(Hypotonic hypoxia)
(一)以动脉血氧分压降低为基本特征的缺氧(PaO2↓)。动脉血供应组织的O2不足
(二)原因: 1.吸入气中PO2过低 2.外呼吸功能障碍 3.静脉血分流入动脉
(三)血氧变化特点:PO2↓,血氧容量正常或↓,血氧含量↓,SaO2↓,A-V血氧差↓
发绀(cyanosis):毛细血管血液中脱氧血红蛋白的平均浓度超过5g/dl时,暗红色的脱氧血红蛋白使皮肤皮肤和黏膜呈青紫色。(发绀是缺氧的表现,但缺氧的患者不一定都发绀,发绀的患者也不一定缺氧)
2、血液性缺氧(Hemic Hypoxia)
(一)定义:Hb数量↓或性质改变以致血液携带氧的能力降低导致的供氧不足。PaO2不变,又称等张性低氧血症。
(二)原因 :1. Hb数量减少:贫血最常见 2. Hb性质改变:碳氧血红蛋白血症(HbCO亲和力高;抑制红细胞内糖酵解;血液呈樱桃红色);高铁血红蛋白血症 3.血红蛋白与氧亲和力异常增高(2,3-DPG、pH等)
(三)血氧变化特点:PO2正常,血氧容量↓,血氧含量↓,SaO2正常,A-V血氧差↓
3、循环性缺氧(Circulatory Hypoxia)(低动力性缺氧)
(一)定义:血液循环发生障碍,组织供血量↓ 引起的缺氧
(二)原因:组织缺血;组织淤血
(三)血氧变化特点:PO2正常,血氧容量正常,血氧含量正常,SaO2正常,A-V血氧差↓
4、组织性缺氧(Histogenous Hypoxia)(氧利用障碍性的缺氧)
(一)定义:组织细胞利用氧障碍所引起的缺氧。
(二)原因:1.抑制细胞氧化磷酸化(组织中毒) 2.线粒体损伤 3.呼吸酶合成障碍
(三)血氧变化特点::PO2正常,血氧容量正常,血氧含水量量正常,SaO2正常,A-V血氧差↓
第三节 缺氧对机体的影响
1、对细胞代谢的影响:
代偿:细胞利用氧能力↑,糖酵解↑,肌红蛋白↑
失代偿:有氧氧化↓,ATP↓;乳酸酸中毒;钠泵功能障碍,细胞水肿;细胞膜、线粒体、溶酶体损伤
2、对呼吸系统的影响
代偿:PaO2↓(<60mmHg) →颈动脉体、主动脉体化学感受器→呼吸中枢兴奋→呼吸运动↑肺泡通气量↑(意义:PaO2提高,增加回心血量)
失代偿:急性低张性缺氧→高原性肺水肿(机制:肺动脉收缩;肺泡-cap膜通透性↑;容量血管收缩,回心血量);PaO2<30mmHg →抑制呼吸中枢→中枢性呼吸衰竭
3、对心血管系统的影响
代偿:1.心输出量增加:心率加快;心肌收缩性增强;静脉回流量增加 2.血流重新分布 3.肺血管收缩
失代偿:1.心肌舒缩功能障碍 2.血压下降 3. 肺动脉高压 4.心律失常 5、回心血量减少
4、对血液系统的影响
代偿:1.RBC↑,Hb↑;2.氧离曲线右移→Hb释放O2↑(2、3-DPG是RBC内的糖酵解过程的中间产物,主要功能是调节血红蛋白质的运氧功能,缺氧时2、3-DPG↑,使氧解离曲线右移,血红蛋白和氧的亲和力降低,有利于将结合的氧释放。机制:生成增加。缺氧时脱氧血红蛋白增多,可结合2、3-DPG,导致游离2、3DPG↓,可促直糖酵解,使用权2、3DPG↑;缺氧时呼吸性碱中毒,pH↑,可促进糖酵解,使2、3DPG↑②分解减少。Ph↑可抑制2、3DPG磷酸酶的活性,使2、3DPG分解减少)
失代偿:Rbc过多,组织血流量↓;,PO2 <60mmHg,Hb与O2结合受阻,使用血液在肺部结合的氧↓,SO2↓?
5、中枢神经系统的变化
轻度缺氧或缺氧早期:血流重新分布保证脑的血流供应
重度缺氧或缺氧中、晚期:功能障碍:脑水肿、脑细胞损伤
第四节 治疗缺氧的病理生理基础
治疗原发病历、氧疗:(Oxygen treatment):Hypotonic hypoxia疗效最好(对高原肺水肿有特殊疗效),同时可以通过增加溶解氧量改善组织的得供养。
应激
1.应 激(stress):机体在各种因素刺激时所出现的以神经内分泌反应为主的非特异性防御反应。
2.应激原(Stressor) 应激原是指引起应激反应的各种刺激因素。
3.热休克蛋白(heat shock proteins, HSP)是指细胞在高温(热休克)或其他应激原作用下所诱导生成或合成增加的一组蛋白质(非分泌性蛋白 )。
4.全身适应综合症(GAS) 劣性应激5原持续作用于机体,则应激可表现为一个动态的连续过程,并最终导致内环境紊乱和疾病。
5.急性期反应蛋白(acute phase protein, APP) 应激时由于感染、炎症或组织损伤等原因使血浆中某些蛋白质浓度迅速发生变化,这一反应称为急性期反应,血浆中浓度迅速发生变化的蛋白质称为APP。APP属分泌型蛋白。
6.应激的神经-内分泌反应及其意义
当机体受到强烈刺激时,应激反应的主要神经内分泌改变为蓝斑(LC)-交感-肾上腺髓质轴和下丘脑-垂体-肾上腺皮质轴(HPA)的强烈兴奋,多数应激反应为生理生化变化与外部表现皆与这两个系统的强烈兴奋有关。
1.蓝斑-交感-肾上腺髓质系统
该系统的主要中枢效应与应激时的兴奋、警觉有关,并有紧张、焦虑的情绪反应,该系统的外周效应主要表现为血浆肾上腺素、去甲肾上腺素浓度升高。交感-肾上腺髓质系统的强烈兴奋主要参与调控机体对应激的急性反应,介导一系列的代谢和心血管代偿机制以克服应激原对机体的威胁或对内环境的扰乱作用等。这些作用促使机体紧急动员,处于唤起(arousal)状态,有利于应付各种变化的环境。但强烈的交感-肾上腺髓质系统的兴奋引起耗能和组织分解、血管痉挛、组织缺血、致死性心律失常等。
2.下丘脑-垂体-肾上腺皮质激素系统(HPA)
应激时HPA轴兴奋的中枢效应:HPA轴兴奋释放的中枢介质为激素(CRH)和ACTH,CRH刺激ACTH的分泌进而增加糖皮质激素(GC)的分泌,它是HPA轴激活的关键环节。CRH另一重要功能是调控应激时情绪行为反应。应激时HPA轴兴奋的外周效应:应激时糖皮质激素分泌迅速增加,对机体抵抗有害刺激起着极为重要的作用。GC升高是应激时血糖增加的重要机制,它促进蛋白质的糖异生,并对儿茶酚胺、胰高血糖素等的脂肪动员起容许作用;GC对许多炎症介质、细胞因子的生成、释放和激活具有抑制作用,并稳定溶酶体膜,减少这些因子和溶酶体酶对细胞的损伤;GC还是维持循环系统对儿茶酚胺正常反应性的必需因素,GC不足时,心血管系统对儿茶酚胺的反应性明显降低,严重时可致循环衰竭。
慢性应激时GC的持续增加会对机体产生一系列不利影响。GC持续增高对免疫炎症反应有显著的抑制效应,生长发育的延缓,性腺轴的抑制以及一系列代谢改变,如血脂升高、血糖升高,并出现胰岛素抵抗等。
7.应激性溃疡的概念及发生机制
(1)概念 应激性溃疡是指病人在遭受到各类重伤(包括大手术)、重病和其他应激情况下,出现胃、十二指肠粘膜的急性病变,主要表现为胃、十二指肠粘膜的糜烂、溃疡、渗血等,少数溃疡可较深或穿孔。当溃疡发展侵蚀大血管时,可引起大出血。
(2)发生机制A胃粘膜缺血:这是应激性溃疡形成的最基本条件。由于应激时的儿茶酚胺增多,内脏血流量减少,胃肠粘膜缺血,其粘膜的缺血程度常与病变程度正相关。粘膜缺血使上皮细胞能量不足,不能产生足量的碳酸氢盐和粘液,使由粘膜上皮细胞间的紧密连接和覆盖于粘膜表面的碳酸氢盐-粘液层医学教育`网搜集整理所组成的胃粘膜屏障遭到破坏,胃腔内的H+顺浓度差进入粘膜,而粘膜血流量的减少又不能将侵入粘膜的H+及时运走,使H+在粘膜内积聚而造成损伤。
B胃腔内H+向粘膜内的反向弥散:这是应激性溃疡形成的必要条件。胃腔内H+浓度越高,粘膜病变通常越重,若将胃腔内pH维持在3.5以上,可不形成应激性溃疡。目前认为,粘膜内pH的下降程度主要取决于胃腔内H+向粘膜反向弥散的量与粘膜血流量之比。在胃粘膜血流灌注良好的情况下,反向弥散至粘膜内的过量H+可被血流中的HCO3-所中和/或被携走,从而防止H+对细胞的损害,反之,在创伤、休克等应激状态下,胃粘膜血流量减少,即使反向弥散至粘膜内H+量不多,也将使粘膜内pH明显下降,从而造成细胞损害。
C其它:尚有一些次要因素也可能参与应激性溃疡的发病,酸中毒时血流对粘膜内H+的缓冲能力低,可促进应激性溃疡的发生。胆汁逆流的胃粘膜缺血的情况下可损害粘膜的屏障功能,使粘膜通透性升高,H+反向逆流入粘膜增多等。应激溃疡若无出血或穿孔等并发症,在原发病得到控制后,通常于数天内完全愈合,不留疤痕。
发热
1.发热(fever):是指在致热原的作用下,体温调节中枢的温度调定点上移,而引起的高水平上的体温调节性体温升高的全身性病理过程。
2.过热(hyperthermia):是一种被动性的体温升高,发生在体温调节机构不能将体温控制在与调定点相适应的水平上时。
3.内生致热原(Endogenous Pyrogen EP):是指在发热激活物作用下,机体内产致热原细胞所产生并释放的一种致热物质。
4.发热激活物(外致热原):凡能激活产内生致热原细胞并使其产生和释放内生致热原的物质统称为发热激活物
发热 过热
病因 无致热源 有致热源
发病机制 调定点无变化 调定点上移
效应 体温可很高,甚至致命 体温可较高,但有上限
防治原则 物理降温 针对致热源
5.简述发热的基本发病环节
答:发热激活物与产EP细胞结合后,即被激活,始动EP的全成。释放入血后通过血脑屏障直接入脑;通过下丘脑终板血管器(OVLT)入脑;通过迷走神经将发热信息传入中枢,三个途径将致热信号传入中枢。中枢整合:体温调节中枢包括正调节中枢(视前区-下丘脑前部(POAH)和负调节中枢(杏仁核、腹中核、弓状核)。当外周致热信号启动体温正负调节介质,一方面双月刊这正调节介质(前列腺素E(PGE)、Na+/Ca2+、cAMP)使体温上升,中另一方面通过负调节介质(精氨酸加压素(AVP)、黑素细胞刺激素(a-MSH)、脂皮质蛋白(lipocortin-1)限制升。两者相互作用的结果决定调节点上移的水平及发热的幅度和过程。外周效应:皮肤血管收缩导致散热减少,骨骼肌紧张导致产热增多,最终使体温升高
6.比较发热三期的临床表现和热代谢特点
答:、I体温上升期——热代谢特点:体温调定点,体温上升,产热↑散热↓,产热>散热。临床表现:畏寒和皮肤苍白(皮肤血管收缩,血流减少),寒颤(骨骼肌周期收缩),竖毛肌收缩(鸡皮)(交感兴奋)
II、高峰期(高热持续期)——热代谢特点:当体温上升到与新的调定点水平相适应的高度后,就波动于该高度附近,产热↑散热↑,产热=散热。临床表现:酷热(血温升高→使皮肤温度升高→刺激温觉感受器),皮肤发红、干燥
III、退热期——热代谢特点:调定点恢复正常,体温调定点,体温下降,产热↓散热↑,散热>产热。临床表现:血温仍偏高,出汗(皮肤血管扩张,汗腺分泌增加)
八、缺血-再灌注损伤
ischemia-reperfusion injury:组织器官缺血一段时间,重新恢复血流后,组织损伤程度进一步加重的现象,甚至出现不可逆性的损伤,称为缺血-再灌注损伤
Reperfusion injury refers to damage to tissue caused when blood supply returns to the tissue after a period of ischemia.
原因:缺血+血流重新恢复1.全身循环障碍后恢复血液供应2.组织器官缺血后血流恢复3.某一血管再通后发生机制
条件;1、缺血时间的长短(过短功能恢复,过长坏死) 2、组织器官缺血前的功能状态(侧支循环,需氧程度)3.灌注液 高压、高温、高pH、高钠、高钙液灌注 可诱发或加重再灌注损伤
钙反常、氧反常、pH反常(pH paradox)
发生机制
(一)自由基的作用
1、自由基(free radical):外层轨道上有未配对电子的原子、原子团或分子的总称。自由基性质活泼;易与其他物质反应形成新的自由基
活性氧(reactive oxygen species, ROS):化学性质较基态氧活泼的含氧物质,包括氧自由基和非氧自由基的含氧产物。
氧化应激:活性氧生成过多或机体氧化能力不足。
自由基的生成:(1)线粒体是O·-2生成的主要场所 (2)某些物质自然氧化:(3)酶催化: XO、NADPH氧化酶、醛氧化酶(4)毒物作用于细胞
自由基的清除:(1)低分子清除剂(细胞内外水相:半胱氨酸、Vit C、谷胱甘肽;细胞脂质:Vit E、 Vit A ;胞浆:还原性辅酶Ⅱ)(2)酶性清除剂 超氧化物歧化酶(MnSODCuZnSOD) 过氧化氢酶(CAT)其辅基含4个血红素 过氧化物酶(H2O2)(3)蛋白性抗氧化剂 铜篮蛋白
2、缺血-再灌注时自由基生成增多的机制
(1)黄嘌呤氧化酶途径
缺血:ATP↓,Ca离子泵功能↓,Ca离子进入细胞激活Ca离子依赖蛋白酶,促使大量的黄嘌呤脱氢酶转变为黄嘌呤转化酶;再灌注:ATP分解代谢增强,组织中次黄嘌呤大量堆积。大量氧分子进入缺血组织。黄嘌呤氧化酶催化次黄嘌呤转变为黄嘌呤进而催化黄嘌呤转变为尿酸,释放出大量电子,以氧分子(脱氢酶途径以NAD+)作为电子受体产生大量超氧阴离子和H2O2
(2)中性粒细胞激活
缺血:补体系统激活或经细胞膜分解产生多种趋化因子,吸引、激活中性粒细胞。
再灌注:氧供应迅速、大量↑,产生大量自由基——呼吸爆发或氧爆发。
(3)、线粒体
缺血:ATP↓,Ca离子进入线粒体↑,线粒体功能受损,氧分子经单电子还原形成超氧阴离子↑;Ca离子进入线粒体↑,SOD、过氧化氢酶减少和活性↓。
再灌注:氧供应迅速、大量↑,超氧阴离子↑
(4)儿茶酚氨的自身氧化
(5)体内清除自由基的能力下降(适应低氧环境,突然高氧)
3、自由基在缺血-再灌注损伤中的作用:(自由基可与脂质、蛋白质、核酸发生氧化反应,导致细胞结构损伤和功能代谢障碍)
(1)膜脂质的过氧化,损伤生物膜双键氧化、脂质交联(①破坏膜的正常结构:脂质过氧化使膜性结构中的不饱和脂肪酸减少,膜的液态性、流动性降低,通透性增加。②间接抑制膜蛋白功能,脂质过氧化使膜脂质之间形成交联和聚合,可间接抑制膜蛋白功能,造成离子泵功能异常和受体信号传导障碍。③促进自由基和其他生物活性物质生成。膜脂质过氧化可激活磷脂酶C和磷脂酶D,降解膜磷脂,形成多种血管活性物质:PG、TXA2、白三烯等,促进再灌注损伤。④线粒体膜损伤,减少ATP生成。进一步损伤线粒体功能,加重缺血组织的能量危机。
(2)蛋白质功能障碍巯基氧化、双键氧化
(3)破坏核酸及染色体双键氧化、DNA断裂 自由基可使碱基羟化或DNA断裂,导致染色体畸变或细胞死亡。
(4)糖类双键氧化 受体构型改变、糖蛋白变性
(二)钙超载: 各种原因引起的细胞内钙含量异常增多,并导致细胞结构损伤和功能代谢障碍的现象。
1.Na-Ca交换异常, (1)细胞内高Na+对Na+/Ca2+交换蛋白的直接激活(缺氧,ATP↓,Na+泵↓)(2)细胞内高H+对Na+/Ca2+交换蛋白的间接激活(缺血时:细胞内外均酸中毒,细胞内启动Na+-H+交换而造成[Na+]i↑)(3)蛋白激酶活化对Na+/Ca2+交换蛋白的间接激活(儿茶酚胺)
2.生物膜损伤
(1)细胞膜损伤①缺血→细胞膜外板和糖被膜表面分离→Ca2+通透性↑②[Ca2+]i↑→激活磷脂酶→↑膜磷脂降解→膜通透性↑③自由基产生↑→损伤生物膜
(2)肌浆网膜损伤 线粒体膜损伤,ATP产生↓
结果:再灌注时外Ca2+内流增加+钙泵摄取减少,致钙超载
钙超载引起再灌注损伤的机制:促进氧自由基生成加重酸中毒破坏细胞(器)膜线粒体功能障碍
激活多种酶
(三)白细胞的作用
IRI时白细胞增多的机制: 粘附分子生成增多 趋化因子生成增多
无复流现象(no-reflow):缺血组织再灌注时某些缺血区域不能得到充分的灌注。中性粒细胞激活及其致炎因子的释放是病理生理学基础。
缺血时,已有白细胞聚集,且缺血时间越长,聚集越多,再灌注时:白细胞聚集和激活进一步↑:①再灌注损伤→膜磷脂降解→趋化因子产生、释放↑②再灌注期,中性粒细胞等释放炎症介质③再灌注期,中性粒细胞和血管内皮细胞表达粘附分子↑
激活的中性粒细胞和血管内皮细胞释放致炎物质(自由基、蛋白酶、细胞因子)→局部炎症反应,微血管损伤:
第二节 重要脏器的缺血-再灌注损伤
一.心脏的缺血-再灌注损伤
(一)心功能变化(标志是出现收缩带)
1.心律失常,室性心率失常为主,常见室性心动过速和心室纤颤
机制(1)缺血区/缺血边缘区/正常三种心肌之间动作电位时程的不均一性→兴奋折返(2)钙超载:再灌注时高[Na+]i→激活Na+/Ca2+交换蛋白→动作电位平台期Ca2+内流增加→平台期延长(3)其他:缺血及再灌注后胞内外电介质改变、儿茶酚胺等
2.心肌舒缩功能降低 与心肌坏死、持续性心肌缺血不同 心肌抑顿(mycardial stunning):心肌短时间缺血后不发生坏死,但引起的结构、代谢和功能改变再灌注后不立刻恢复,常需数小时、数天或数周才能恢复正常的现象,其特征为可逆性收缩功能障碍。(机制:自由基、钙超载、能量供应不足)临床常见于溶栓治疗、心绞痛缓解以及PTCA、冠脉搭桥、心脏移置后)
(二)心肌超微结构的变化与单纯心肌缺血基本相同,出现质膜、肌原纤维、线粒体的结构破坏。收缩带:再灌注引起心肌超微结构严重损害的一个标志 机制:再灌注→细胞获得能量+钙超载→肌原纤维过度收缩→细胞骨架破坏
再灌注→移出缺血期堆积的H+→减轻或消除了H+对心肌收缩的抑制作用
2、脑的缺血-再灌注损伤(脂质过氧化)
第三节 缺血预适应
Preconditioning概念:
预先反复短暂缺血再灌注可以提高心肌组织对随后持续缺血的耐受性,其保护作用包括缩小缺血再灌注后心肌梗死范围、减少恶性心律失常发生和促进心脏功能恢复等。
特点:1、有限记忆性(预处理经过较长时间后保护作用丧失) 2、呈双峰分布 3、普遍性 4、非特异性: 预处理方法不同,产生的保护作用却十分相似。
防治的病理生理基础
缩短缺血时间
控制再灌注条件
清除自由基:VitE、A、C GSH-PX CAT SOD
减轻钙超载
中性粒细胞抑制剂的应用
休克一
一.休克的定义
机体在强烈致病因素作用下,有效循环血量急剧下降,组织灌流量严重不足,使细胞代谢、功能紊乱,器官功能出现障碍的病理过程。
a dangerous systemic pathologic process under the effect of various drastic etiological factors, characterized by acute circulatory failure including decreased effective circulatory blood volume, inadequate tissue perfusion, cellular metabolism impediment and dysfunction of multiple organ.
二.临床表现:血压下降、面色苍白,皮肤冰冷、出冷汗、脉搏频弱、尿量减少、神态淡漠。
三.休克的原因与分类
原因:失血或失液、创伤、烧伤、感染、急性心衰、过敏、强烈神经刺激。
分类:一) 按病因分类
1.失血性/失液性休克2. 烧伤性休克3. 创伤性休克4. 感染性休克 (内毒素性休克、败血症性休克)5. 过敏性休克 6. 心源性休克7. 神经源性休克
(二) 按发生休克的起始环节(有效循环血量的下降:血容量降低 血管床容积增大 心泵功能下降)
实现有效灌流的基础 ① 需要足够血量 ② 需要正常血管舒缩功能 ③ 需要正常心泵功能
1. 低血容量性休克:失血性休克、失液性休克、烧伤性休克(三低: CVP, CO, BP↓;一高: TPR ↑)
2. 心源性性休克:(心衰→心输出量↓)
3.血管源性休克:过敏性休克、神经源性休克、感染性休克(部分)(血管床扩张→血管容量↑→回心血量↓)
(三)按学流动力学特点:
(1)低排高阻型休克(低动力性休克、“冷休克”)
大部分休克均属此类:低血容量性休克、心源性休克、创伤性休克、(多数)感染性休克
特点:心脏排血量低、外周阻力高
(“三低一高”:心输出量低、动脉血压低、中心静脉压低,外周阻力高)
(2)高排低阻型休克(高动力性休克、“暖休克”)
过敏性休克、神经性休克、(部分)感染性休克
特点:心脏排血量高、外周阻力低
(3)低排低阻型休克
特点:心脏排血量低、外周阻力低
四.微循环灌流的调节

第二节 休克的发展过程机及其机制
1、休克I期(休克初期、微循环缺血期、缺血性缺氧期、休克代偿期)——少灌少流,灌少于流
微循环状态改变:微A、后微A、毛细血管前括约肌(收缩)→前阻力增加;微V(收缩)→后阻力增加;A-V吻合支(舒张);真毛细血管网血流↓→组织缺血缺氧(交感-肾上腺髓质系统兴奋血中儿茶酚胺↑)
微循环改变的代偿意义:
(1)维持动脉血压:①外周阻力↑②心输出量↑③回心血量↑
A-V短路开放;“自我输血”:小静脉收缩(容量性血管);“自我输液”:毛细血管内压↓→回流入血管组织液↑;循环血量↑:肾素-血管紧张素-醛固酮、ADH
(2)血流重分布,保证心、脑血液供应(移缓就急)
血管收缩反应不一致:皮肤、内脏 α受体占优势 血管收缩;脑血管 α受体密度低 血管不变;心脏冠状血管 β受体占优势 血管扩张
主要临床表现:

治疗原则:消除病因,补充血容量,改善微循环障碍
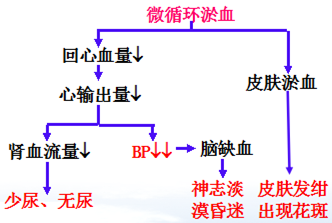
2、休克II期(休克期、微循环淤血期、休克失代偿期)
I、微循环状态改变——“灌而少流,灌大于流” 微循环淤血、缺氧
前阻力血管:舒张——对酸中毒(H+)耐受性↓扩血管物质↑
后阻力血管:仍收缩 血管阻力↑——血液淤滞
微循环改变的机制:
1.酸中毒 缺氧使CO2和乳酸堆积,引起的酸中毒使血管平滑肌对CAs反应性降低
2.局部舒血管代谢产物增多(组胺、腺苷、缓激肽、Ca2+内流↓)微血管扩张
3、血液流变学改变(血小板聚集 红细胞聚集 白细胞附壁 毛细血管白细胞嵌塞)
4、LPS的作用(NO 血管平滑肌舒张)
微循环改变的后果:
1、自身输液”停止(毛细血管血流淤滞流体静压升高;毛细血管通透性增高)
2、自身输血”停止(静脉系统容量血管扩张,血管床容积增大回心血量减少,“自身输血”作用停止)
3、恶性循环的形成(回心血量↓↓ 血浆外渗,血液粘滞度↑ 心脑血液灌流↓)
主要临床表现:
治疗原则:纠酸,扩容,改善微循环。
3、休克III期(休克晚期、微循环衰竭期、DIC期、难治期、不可逆期)
微循环状态改变——“不灌不流,血液高凝”微循环衰竭
微循环改变的机制
1、微血管麻痹性扩张 (H+、NO↑,KATP开放 → 钙内流↓)
2、DIC的发生(血液流变学改变,血液高凝;凝血系统激活;TXA2-PGI2失衡)
临床表现:
1、循环衰竭(血压进行性下降,脉搏细速,CVP↓,静脉塌陷)
2、并发DIC(出血、广泛微血栓)
3、重要器官功能障碍或衰竭(低灌注、体液因子损伤、肠道屏障↓)

思考题:
1、休克是否是疾病?为什么?
答:休克是疾病。疾病是指机体在一定条件下由病因与机体相互作用而产生的一个损伤与抗损伤斗争的有规律过程,体内发生一系列功能、代谢和形态结构的变化,机体与环境间的协调发生障碍,从而临床表现出不同的症状和体征,使机体对环境的适应能力的劳动能力降低或丧失。而休克使细胞代谢、功能紊乱,器官功能出现障碍,表现为面色苍白、四肢湿冷、脉搏细、速尿量减少、神志淡漠、脉压差小、血压下降,所以休克属于疾病。
2、根据休克微循环改变机制,治疗上是应该采取缩血管还是扩血管药物?为什么?
血管活性药物分为缩血管药物和扩血管药物,根据微循环学说,合理使用血管活性药物,应从下列四方面论述:
(1)用药目的:由于微循环障碍,休克时组织的有效血液灌流量急剧减少,选用血管活性药物的目的必须提高组织微循环血液灌流量,反对单纯追求升高血压长期大量使用血管收缩药而导致灌流量明显下降,主张合理使用。
(2)用药前提:扩血管药物应在充分补充血容量的基础上应用,否则,血管扩张使血压急剧下降,心脑血管将丧失自身调节能力而使血液供应减少;缩血管药物应在纠正酸中毒的基础上应用,否则,由于酸中毒使血管壁对血管活性药物的反应性降低,且参与微血管扩张,如果不纠正酸中毒,缩血管药难以奏效。
(3)扩血管药物的应用:适用于低排高阻型休克或使用缩血管药物引起血管高度痉挛的患者。在休克早期可解除毛细血管前阻力,提高微循环灌注量;在休克中、晚期,可解除过高的毛细血管后阻力,解决流的问题,改善微循环血液淤滞,提高组织灌流量。
(4)缩血管药物的应用:使过敏性休克和神经源性休克扩大了的血管床容量缩小,恢复血管床与血容量的平衡,纠正全身组织的血液灌注不足,是这两型休克的最佳选择药物。高排低阻型感染性休克和低阻力型心源性休克,在综合治疗的基础上,也可应用缩血管药,防止血管床的进一步扩大和血压的进一步降低。如血压过低,降低到心脑血管丧失自身调节的临界值(7.0kPa)以下,又五条件迅速补液时,可使用缩血管药物,暂时提升血压,保证心脑的血液灌流。
3、休克初期患者的血压是否改变?是否能将血压当作判断休克的唯一标准?为什么?
休克早期由于交感-肾上腺体质系统兴奋,儿茶酚胺分泌增多,引起一系列的代偿反应可维持血压无明显降低。主要机理是:(1)通过自身输血与自身输液,增加回心血量和心排出量。(2)心脏收缩力增强,心率加快。(3)血管外周总阻力升高。
休克时常有动脉血压的降低,但是不能以血压是否降低来判断休克的有无。这是因为:
(1)休克的概念不是低血压:从休克的现代概念看,休克是以组织有效血液灌流量急剧减少为特征的急性全身性病理过程,其发病机制的核心是组织低灌流,本质问题不是血压,把休克的概念简单建立在血压高低的基础上是不妥的。
(2)休克早期血压维持正常:休克早期由于各种代偿机制的共同作用,血压维持在正常范围,但组织器官已有明显的缺血、缺氧;某些休克的原始病因可直接引起细胞损伤,如内毒素性休克,在血压下降之前,已有骨骼肌细胞膜电位的降低和细胞氧化过程受抑制,因此,不能以血压下降判断是否发生休克。
(3)休克治疗后,血压回升可与病情不平行:部分休克患者经输血补液治疗后,血压虽已回升,组织恢复灌注,但引起了缺血—再灌注损伤,器官出现严重病变,休克继续进行。
(4)低血压也不全是休克:血压是判断血流动力学的一个综合指标,不仅反映心泵功能、外周阻力,还受心率、循环血量等的影响,当发现病人血压低时,应进行全面检查,综合分析,做出客观判断。
(5)血压是决定微循环灌注压的重要因素:当血压低于一定数值时,心脑血管将丧失自身调节能力,重要器官因得不到充足的血液供应而出现功能障碍或衰竭。因此,低血压是休克的一个严重问题,由于检测方法简便,临床常作为监护休克的重要指标之一。在分析休克的血压变化时,应与组织器官有效血液灌流不足结合起来,治疗中也应采取综合措施保证组织灌流和保护细胞,而不是以单纯追求血压正常为目的。
休克二
Multiple Organ Dysfunction Syndrome(MODS):严重创伤、感染和休克时,原无器官功能障碍的患者同时或在短时间内相继出现两个以上器官系统的功能障碍,以致机体内环境的稳定必须靠临床干预才能维持的综合征。
MODS is a syndrome with altered functions of two or more organ systems in acutely ill patient such that homeostasis can not be maintained without interventions.
全身炎症反应综合症(SIRS):机体失控的自我持续放大和自我破坏的全身性炎症反应。
代偿性抗炎反应综合症(CARS):指感染或创伤时机体产生可引起免疫功能降低和对感染易感性增加的过于强烈的内源性抗炎反应。
混合性拮抗反应综合症(MARS):当SIRS和CARS同时并存又相互加强,则产生对机体更严重的损伤,导致炎症反应和免疫功能更严重障碍,称为MARS。
休克时肾功能的改变:
肾脏是休克时最早、最易受损伤的器官,各类休克常伴发急性肾功能不全,严重时成为休克肾。其肾功能改变为:1、有效循环血容量减少引起交感神经兴奋,儿茶酚胺增多,使肾小动脉收缩,导致肾缺血。2、肾缺血激活肾素-血管紧张素-醛固酮系统,使肾小动脉收缩,血流量更加减少,尿量减少。3、醛固酮和抗利尿激素使钠水冲吸收增多,尿量进一步减少。
休克早期,为功能性肾功能衰竭;休克持续,器质性肾功能衰竭。
(根据题目需要适当联系第十八章,肾功能不全)
凝血与抗凝血平衡紊乱
弥散性血管内凝血(DIC):致病因子作用下,凝血因子、血小板被激活,大量促凝物质入血,使凝血酶增加,微血管中形成广泛的微血栓,引起大量凝血因子和血小板消耗,以及继发性纤溶亢进,导致出血、溶血性贫血、休克、器官功能障碍等临床表现的病理过程。
DIC的发病机制:
一、组织因子释放,启动外源性凝血系统
二、血管内皮细胞损伤,凝血、抗凝调控失调 抗凝→促凝
三、血细胞的大量破坏,血小板被激活
四、促凝物质释放入血
DIC的分期:
分期 凝血状态 表现
高凝期 凝血酶增多,微血栓形成 血液高凝
消耗型低凝期 凝血因子,血小板因消耗而减少;
纤溶系统激活 血液低凝;出血
继发性纤溶亢进期 纤溶系统活跃
纤溶酶大量产生,FDP形成 出血明显
DIC时机体的功能代谢变化及机制:
一、出血
机制:
1.血管壁损伤
2 .凝血物质被消耗而减少
3.纤溶系统激活,FDP形成( “3P”试验——鱼精蛋白副凝血试验 鱼精蛋白与FDP结合,使原本与FDP结合的纤维蛋白单体分离并彼此聚合而凝固。DIC患者“3P”试验阳性。 D-二聚体检查 反映继发性纤溶亢进的重要指标 )
二、器官功能障碍
DIC时,大量微血栓引起微循环障碍,可导致缺血性器官功能障碍。
三、休克
1.微血管内大量微血栓形成→回心血量↓
2.广泛出血使血容量↓
3.心肌受累,心输出量↓
4.激活纤溶系统,产生血管活性物质,舒张血管,管壁通透性增加,血管床容量↑
四、贫血
微血管病性溶血性贫血——DIC病人可发生一种特殊类型的溶血性贫血,其特征是: 外周血涂片中可见一些特殊的形态各异的变形红细胞--裂体细胞。
裂体细胞产生机制:凝血反应的早期,纤维蛋白丝在微血管腔内形成细网,血流中的红细胞通过网孔时,滞留在上面,在血流冲击下发生破裂。
十一、心衰(heart failure)
心功能不全 cardiac insufficiency:心脏的收缩和/或舒张功能障碍→心输出量不足→心功能不全。包括代偿阶段和失代偿阶段
心力衰竭是心功能不全的失代偿阶段,是各种心脏病最终的共同的病理过程。
病因:原发性心肌舒缩障碍;心脏负荷过度;心脏舒张活动受限
心力衰竭heart failure:因心脏负荷过重、心肌细胞受损(原因),心肌收缩或舒张功能障碍(发病机制),导致心输出量减少、静脉回流受阻(基础),使心输出血量不能满足组织细胞代谢需要(标志)而导致的以循环功能障碍为主要特征的病理过程或临床综合征。
血液动力学的特点是:心输出量减少→组织缺血;血液回流障碍→体/肺V系统淤血
心衰的诱因:主要通过使心肌耗氧增加或供氧供血减少而诱导心衰
1、感染(尤其是呼吸道)2、心率失常3、水点失衡和酸碱紊乱(酸中毒引发心衰-高血钾)4、妊娠和分娩
第一节 心衰发生的机制
心肌正常舒缩必备条件:1. 心肌结构正常;2. 充足的能量供应;3. 协调的兴奋-收缩偶联,即钙离子运转正常。
基本机制是心肌舒缩功能障碍
心肌舒缩性减弱(depressed myocardial contractility)
1. 心肌细胞丧失和心肌结构改变-心肌细胞坏死,心肌细胞凋亡,肥大心肌收缩成分相对减少,心肌排列改变
2. 心肌能量代谢障碍-生成和利用障碍
3. 兴奋-收缩偶联障碍(1)肌浆网摄取、贮存和释放Ca2+障碍(2) Ca2+内流障碍(3)肌钙蛋白与Ca2+结合障碍
心脏舒张功能障碍-1、心脏主动舒张功能障碍 2、心室顺应性降低
第二节 心衰时机体的代偿反应
1、心脏的代偿
1)心率加快意义:一定限度内提高心输出量(心肌耗氧量↑、冠状血流↓、心室充盈↓)
2)心脏扩张意义:心肌收缩力↑,利于维持心输出量(心腔过度扩大,肌节初长度过长,粗细肌丝重叠减少,收缩力↓,耗氧量↑)
心肌肥大慢性过程
向心性肥大:心室长期压力负荷过度,收缩期室壁张力增加,肌节并联性增生,使心肌细胞增粗、室壁增厚,心腔无明显扩大
离心性肥大:心室长期容量负荷过度,舒张期室壁张力增加,肌节串联性增生,心腔明显扩大
意义:①心脏总的收缩力↑②降低室壁张力(心肌肥大的不平衡生长)
2、心外代偿
(1)血容量增加(慢性过程)意义:一定程度的回心血量和前负荷↑,利于维持心输出量和血压(过度则加重心肌负荷和耗氧量)
(2)血流重分布意义:急性心衰时保证心、脑血供和维持血压(外周血管阻力↑,加重心肌负荷)
(3)红细胞增多意义:增加血容量、改善缺氧(血容量过度增加及血液粘滞性增加可加重心肌负荷)
(4)组织细胞利用氧能力增强意义:改善供氧不足带来的不利影响
3、心肌重构(myocardial remodelling):心衰时,为适应心脏负荷的增加,心肌及心肌间质在细胞结构、功能、数量以遗传表型方面所出现的适应性、增生性变化。
第三节 心衰时机体的主要机能代谢变化
(一) 心血管系统的变化
1.心脏泵血功能降低: 心输出量(CO)减少、射血分数(EF)降低及心室舒张末期压力(或容积)升高。
2.V系统淤血、V压增高: 左心衰-肺淤血,水肿右心衰-体循环淤血,颈静脉怒张,淤血性肝硬化,心性水肿。
3. 血液重新分布
(二) 呼吸功能变化1.呼吸困难(dyspnea)-左心衰竭最早、最常见的临床症状。
左心衰竭→左室舒张末期压力↑→肺静脉压↑→肺淤血、水肿,肺顺应性降低→各种形式的呼吸困难和肺水肿:
表现为:劳力性呼吸困难;端坐呼吸;夜间阵发性呼吸困难,心性哮喘。
2. 急性肺水肿-肺毛细血管血压升高、通透性增加所致。
三) 其他器官功能变化
四) 水、电解质和酸碱平衡紊乱心性水肿 代谢性酸中毒 低钠、低钾、低镁血症。
十二、呼衰
1、呼吸衰竭:在海平面地区静息时吸入空气的条件下,由于外呼吸功能严重障碍,以致出现动脉血氧分压低于60mmHg,伴或不伴二氧化碳分压高于50mmHg。(呼吸衰竭是呼吸功能不全的严重阶段)
respiratory faliure Is a syndrome in which the respiratory system fails to adequately oxygenate the venous blood with / without retention of carbon dioxide. It is generally defined as a PaO2 value of less than 60 mmHg while breathing air or a PaCO2 of more than 50 mmHg.
2、分型:根据PaCO2是否升高分为低氧血症型(Ⅰ型)和高碳酸血症型(Ⅱ型)
第一节 呼衰的原因和发病机制根据主要发病机制的不同分为通气性和换气性呼衰,而肺换气功能障碍又包括弥散障碍、肺泡通气与血流比例失调以及解剖分流增加。
(一) 肺通气功能障碍
1、 限制性通气不足(肺泡扩张受限):呼吸肌活动障碍;胸廓的顺应性降低;胸腔积液和气胸;肺的顺应性降低
2、 阻塞性通气不足(气道狭窄或阻塞):
3、 气道阻塞可分为两种类型:1中央性气道阻塞:阻塞在气管分支以上。阻塞若位于胸外,表现为吸气性呼吸困难;若位于胸内,表现为呼气性呼吸困难 2外周气道阻塞:阻塞在气管分支以下。表现特点:呼气性呼吸困难
3、PaCO2是反映总肺泡通气量变化的最佳指标
4、通气功能障碍的血气变化特点:PaO2降低和PaCO2升高——引起高碳酸血症型(Ⅱ型)
(二) 肺换气功能障碍
1、 弥散障碍 主要原因:肺泡膜面积减少:肺泡膜厚度增加
弥散障碍的血气变化特点:PaO2降低,而PaCO2不变或降低——引起低氧血症型(Ⅰ型),机制:CO2的弥散速率比O2快
2、 肺泡通气与血流比例失调
①部分肺泡通气不足功能性分流(functional shunt):部分肺泡通气减少,而血流未相应减少,甚至增加,使VA/Q显著降低,流经这部分肺泡的静脉血未经充分动脉化便掺入动脉血内,类似动-静脉短路,又称为静脉血掺杂。
②部分肺泡血流不足:死腔样通气(dead space like ventilation):病变使部分肺泡血流减少,通气正常或增加,使VA/Q显著增高,患者血流少而通气多,肺泡通气不能充分被利用。
血气变化特点:PaO2 和PaCO2均降低,而PaCO2与CaCO2正常或降低—低氧血症型(Ⅰ型)
3、 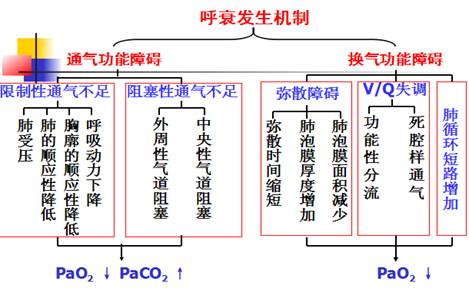 解剖分流增加
解剖分流增加
解剖分流的血液完全未经气体交换过程称为真性分流
急性呼吸窘迫综合症(ARDS):由于肺内或肺外严重疾病引起的肺毛细血管膜炎症性损伤,通透性增加,继发急性高通透性肺水肿和进行性缺氧性呼吸衰竭(Ⅰ型)。
肺性脑病(pulmonary encephalopathy):由呼吸衰竭引起的脑功能障碍称为肺性脑病,常见于II 型呼吸衰竭患者。
十三、肝功能不全
1、 肝功能不全(hepatic insufficiency):各种致肝损伤因素使肝细胞发生严重损害,使其代谢、分泌、合成、解毒与免疫功能发生严重障碍,机体往往出现黄疸、出血、继发性感染,肾功能障碍、脑病等一系列临床综合症。
2、 肝性脑病(hepatic encephalopathy):在排除其他已知脑疾病前提下,继发于肝功能紊乱的一系列严重的神经精神综合征。 is the occurrence of confusion, altered level of consciousness, and coma as a result of liver failure.
3、 肝性脑病分类:
①按病程:急性与慢性
②按发病原因、毒性物质进入机体的途径:
内源性:病因:病毒性爆发性肝炎、伴有广泛的肝细胞坏死的中毒或药物性肝炎。常为急性经过,无诱因,血氨可不增高
外源性:病因:门脉性肝硬化、血吸虫性肝硬化。有诱因,血氨增高
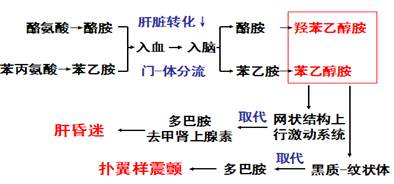
4、 肝性脑病发病机制:
(1) 氨中毒学说

(2) 假性神经递质(FNT)学说
假性神经递质(false neurotransmitter):苯乙醇胺和羟苯乙醇胺在化学结构上与正常神经递质--多巴胺、去甲肾上腺素相似,但不能完成真性神经递质的功能,故称之为假性神经递质。
急性肾功能衰竭
掌握:肾功能衰竭、急性肾功能衰竭的概念;急性少尿型肾功能衰竭的发病机制;急性肾衰时的主要机能代谢变化
肾功能不全renal insufficiency: 当各种病因引起肾功能严重障碍时,人体内环境发生紊乱,其主要表现为代谢产物在体内蓄积,水、电解质和酸碱平衡紊乱,并伴有尿量和尿质的改变以及肾脏内分泌功能障碍,从而引起一系列病理生理变化。 肾功能衰竭是肾功能不全的晚期阶段。
急性肾功能衰竭(acute renal failure):各种原因引起肾脏泌尿功能在短期内急剧降低,引起水、电解质、酸碱平衡紊乱及代谢废物蓄积的综合征。
一、分类与病因
(一) 肾前性急性肾功能衰竭
1、有效循环血量降低 2、肾血管收缩
(二) 肾性急性肾功能衰竭
1.急性肾小管坏死 (最常见最重要)----肾缺血,肾中毒
2. 急性肾小球肾炎 约占 7%
3. 急性间质性肾炎 约占 9%
4. 急性肾血管疾病 约占 4%
(三) 肾后性急性肾功能衰竭
见于从肾盂到尿道的尿路急性梗阻,多为可逆性。(结石,肿瘤,前列腺肥大)
二、发病机制(Pathogenesis)
肾小球滤过率降低是急性肾衰的中心环节
v 肾血流动力学异常 --肾灌注压降低,肾血管收缩,内皮细胞肿胀和血栓形成
v 肾小球滤过系数降低--滤过膜增厚,滤过面积减少
v 肾小管损伤--肾小管阻塞,原尿回漏
三、功能代谢变化(重点)----少尿型,非少尿型
(一)少尿型急性肾功能衰竭
少尿期—四多(水中毒,代酸,高钾血症,氮质血症)一少(少尿)
多尿期---尿量开始增多,肾小管浓缩功能尚未完全恢复,所以临床表现基本同少尿期相似
恢复期---尿量减少并恢复正常,内环境紊乱得到纠正,肾小管功能需较长时间才能恢复
(二)非少尿型急性肾功能衰竭
v 无明显少尿
v 尿比重低
v 尿钠含量低
v 氮质血症
v 多无高钾血症
慢性肾功能衰竭(chronic renal failure,CRI)
概念:任何疾病使肾单位发生进行性破坏,残存的肾单位不能充分排出代谢废物和维持内环境稳定,引起代谢废物在体内潴留,水、电解质和酸碱平衡紊乱及内分泌功能障碍,并伴有一系列临床症状的病理过程,称为慢性肾功能衰竭。特点:起病隐匿,经过缓慢
渐进性发展,常以尿毒症为结局而导致死亡
1、 发展过程:
(1) 肾储备功能降低期(代偿期)(2) 肾功能不全期 (3) 肾功能衰竭期 (4) 尿毒症期
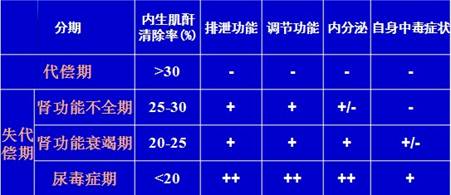
2、 发病机制:健存肾单位学说;矫枉失衡学说;肾小球过度滤过;肾小管-肾间质损害
功能代谢变化(重点)
(一) 尿的变化
⒈ 尿量的变化
早期:夜尿、多尿 晚期:少尿
⒉ 尿渗透压的变化 正常尿比重:1.015~1.025
早期——低渗尿(尿比重<1.008)晚期——等渗尿(尿比重固定于1.008~1.012)
⒊尿液成分的改变
蛋白尿 + ~ +++
血尿、脓尿、管型
(二)氮质血症
(三)水、电解质和酸碱平衡紊乱
1.钠、水代谢障碍 肾调节钠水的能力下降 CRF的肾为“失盐性肾” 盐摄入过多 钠水潴留
2.钾代谢障碍
早期一般不发生高钾血症
晚期排钾量固定,和摄入量无关 摄入量多引起高钾血症 摄入少或腹泻引起低钾血症
3.钙磷代谢障碍
高磷
肾小球滤过下降(﹤30ml/min),排磷减少
继发性PTH↑,加强溶骨,骨磷释放↑,导致血磷升高
低钙
Ca2+与磷是常数
VitD3减少
肾毒物损伤肠道,影响肠道钙的吸收
肠道磷酸根分泌增多,妨碍钙吸收
4.代谢性酸中毒
早期 ---- 高血氯性代谢性酸中毒 晚期 ---- AG增高型代谢性酸中毒
(四) 肾性高血压(renal hypertension)肾实质病变引起的高血压。
(五)肾性骨营养不良
慢性肾功能衰竭时, 由于钙磷代谢障碍及继发性甲状旁腺机能亢进、维生素D3活化障碍、酸中毒和铝积聚等引起的骨病称为肾性骨营养不良或肾性骨病。
(六)出血倾向
皮下淤斑和粘膜出血
血小板功能抑制所致,血小板数量正常
血小板第3因子释放受到抑制
血小板黏着和聚集功能减弱
(七)肾性贫血
由各种因素造成肾脏EPO产生不足或尿毒症血中毒性物质干扰红细胞的生成与代谢而导致的贫血称肾性贫血。
第四节 尿毒症(uremia)
概念:各种原因引起的急性和慢性肾功能衰竭的晚期,由于体内水、电解质、酸碱平衡紊乱和肾脏内分泌功能失调,以及代谢产物和毒性物质大量蓄积而引起一系列全身性自体中毒症状,称为尿毒症。
-
重庆医科大学 病理生理学 重点总结
名词解释?病理过程:是指多种疾病中可能出现的、共同的、成套的功能、代谢和结构变化。?疾病:机体在各种病因的作用下,因自身调节紊乱而…
-
病理生理学总结重点
病理生理学水电解质代谢紊乱电解质的生理功能和钠平衡维持神经肌肉心肌细胞的静息电位并参与其动作电位的形成维持体液的渗透平衡和酸碱平衡…
-
病理生理学总结
一名词解释1疾病在一定条件下受病因损害作用后机体内稳态调节紊乱而导致的异常生命活动包括躯体精神和社会适应状态被破坏2健康不仅是没有…
-
护理病理与病理生理学重点总结
病理与病理生理学1病理学研究内容疾病概论和基本病理过程2人体形态学研究方法尸体剖检活体组织检查活检细胞学检查1概念是机体在内外环境…
-
病理生理学重点总结
绪论病理生理学研究疾病发生的原因和条件研究疾病全过程中患病体的机能代谢的动态变化及其机制从而揭示疾病发生发展和转归的规律阐明疾病的…
-
病理生理学名词解释总结
1.基本(典型)病理过程:是指多种疾病中可能出现的、共同的、成套的功能、代谢和结构的变化。如水水、电解质和酸碱平衡紊乱、缺氧、发热…
-
病理生理学大题总结(小字体)
1DIC的发展过程可分为哪几期?简述各期的发生机制*典型DIC的发展过程可分为三期:①高凝期②消耗性低凝期③继发性纤溶亢进期发生机…
-
重庆医科大学 病理生理学 重点总结
名词解释?病理过程:是指多种疾病中可能出现的、共同的、成套的功能、代谢和结构变化。?疾病:机体在各种病因的作用下,因自身调节紊乱而…
-
精神病学完整重点总结
名词解释情绪认知行为等方面的改变伴有痛苦体验和或功能损害系能调整自己以适应不良环境是体内难以言表难以定位的不适感特点为部位不固定描…
-
温州医科大学病理生理学重点总结
名词解释病理过程是指多种疾病中可能出现的共同的成套的功能代谢和结构变化疾病机体在各种病因的作用下因自身调节紊乱而发生的机能代谢和形…