气液平衡 实验报告
化工专业实验报告
实验名称: 二元气液平衡数据的测定
实验人员:
同组人
实验地点:天大化工技术实验中心 606 室
实验时间: 2015年4月20日下午14:00
年级: 2014硕;专业:工业催化;组号: 10(装置2);学号:
指导教师:______赵老师________
实验成绩:_____________________
一.实验目的
(1) 测定苯-正庚烷二元体系在常压下的气液平衡数据;
(2) 通过实验了解平衡釜的结构,掌握气液平衡数据的测定方法和技能;
(3) 应用 Wilson 方程关联实验数据。
二.实验原理
气液平衡数据是化学工业发展新产品、开发新工艺、减少能耗、进行三废处理的重要基础数据之一。化工生产中的蒸馏和吸收等分离过程设备的改造与设计、挖潜与革新以及对最佳工艺条件的选择,都需要精确可靠的气液平衡数据。这是因为化工生产过程都要涉及相间的物质传递,故这种数据的重要性是显而易见的。
平衡数据实验测定方法有两类,即间接法和直接法。直接法中又有静态法、流动法和循环法等。其中循环法应用最为广泛。若要测得准确的气液平衡数据,平衡釜是关键。现已采用的平衡釜形式有多种,而且各有特点,应根据待测物系的特征,选择适当的釜型。用常规的平衡釜测定平衡数据,需样品量多,测定时间长。所以,本实验用的小型平衡釜主要特点是釜外有真空夹套保温,釜内液体和气体分别形成循环系统,可观察釜内的实验现象,且样品用量少,达到平衡速度快,因而实验时间短。
以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图 1 所示。当体系达到平衡时,两个容器的组成不随时间变化,这时从 A 和 B 两容器中取样分析,即可得到一组平衡数据。
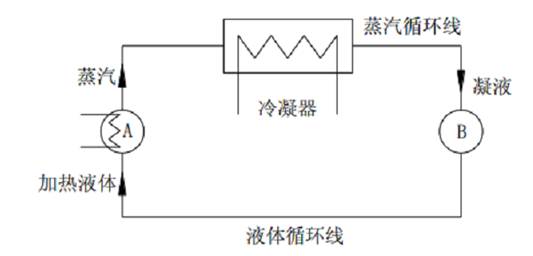
图1 平衡法测定气液平衡原理图
当达到平衡时,除了两相的压力和温度分别相等外,每一组分的化学位也相等,即逸度相等,其热力学基本关系为:
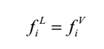

常压下,气相可视为理想气体,Φi=1;再忽略压力对液体逸度的影响,fi=pi0, 从而得出低压下气液平衡关系式为:
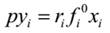
式中,p----------------体系压力(总压);
pi0------------纯组分i在平衡温度下饱和蒸气压;
xi、yi-------分别为组分i在液相和气相中的摩尔分率;
ri-------------组分i的活度系数;
由实验测得等压下气液平衡数据,则可用下式计算不同组成下的活度系数:

计算出不同组成下的活度系数:
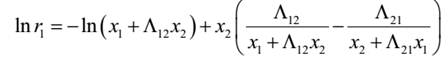
本实验中活度系数和组成关系采用 Wilson 方程关联。 Wilson 方程为:
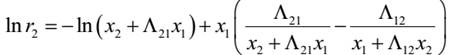
目标函数选为气相组成误差的平方和,即:
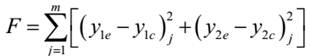
三、实验装置和试剂
(1)平衡釜一台。平衡釜的选择原则:易于建立平衡、样品用量少、平衡温度测定准确、气相中不夹带液滴、液相不返混及不易爆沸等。本实验用气液双循环的小平衡釜,其结构如图 2 所示。
(2)阿贝折射仪一台。
(3)超级恒温槽一台
(4)50-100十分之一的标准温度计一支、0-50十分之一的标准温度计一支。
(5)所用试剂(苯、正庚烷)为优级品。
(6)注射器(1ml、5ml)若干。
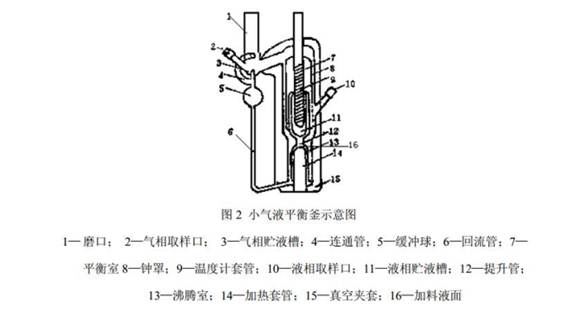
图2 小气液平衡釜示意图
四、实验过程
(1)首先开启超级恒温槽,调节温度至测定折射率所需温度 25℃。
(2)测温套管中道入甘油,将标准温度计插入套管中,并在温度计露出部分中间固
定一支温度计。因本实验对温度要求较严,需对温度进行校正。
(3)检查整个系统的气密性,因为我们这个系统都是密闭的。检测方法是将 100 毫
升针筒与系统相连,并使系统与大气隔绝,针筒缓缓抽出一点压力,发现硅油 U 型管的两个液柱差不变时(说明系统是密闭的),然后再通大气(已由教师检测完成)。
(4)我们做的是常压下的气液平衡,当天的大气压需要读出。
(5)在平衡釜内加入一定浓度的苯—正庚烷混合液约 20-30ml(已加好),使液体
处在图 2 中加料液面处,一般由实验点数决定,通常取摩尔浓度在 0.1 -0.15 之间变化,故开始加入的浓度可使轻组分含量较多,然后慢慢增加重组分的浓度。打开冷却水,安放好加热器,接通电源。控制加热电流,开始时给 0.1A, 5min 后给 0.2A,慢慢调到 0.25A左右即可,以平衡釜内液体沸腾为准。冷凝回流液控制在每秒 2-3 滴。稳定地回流 15min左右,以建立平衡状态。
(6)达到平衡后,需要记录下两个温度计的读数,此温度为平衡温度,并用微量注
射器分别取两相样品,通过阿贝折射仪测定样品的折射率,然后根据平衡图,查得不同的组成含量。关掉电源,加热器拿下,釜液停止沸腾。
(7)用注射器从釜中取出 3ml 的混合液,然后加入 4或5ml 左右的苯纯溶液,重新建立平衡。加哪一种纯物料,根据你上一次的平衡温度而定,以免各实验点分配不均,重复上述操作5次,得到不同组成下平衡组成。
(8)实验完毕,关掉电源和水源。
五、实验数据记录和处理
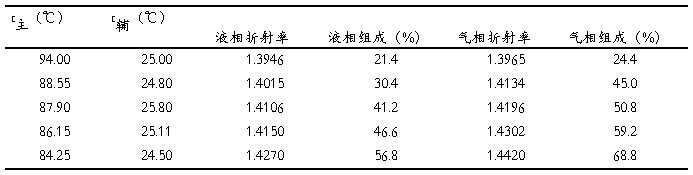
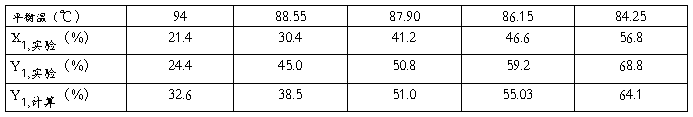
通过多次改变混合液的组成,得到五组实验数据如下表1 所示:
(一)混合液气液平衡时原始数据
表1 实验数据记录表
(二)实际平衡温度的计算
平衡温度的计算方法如下:
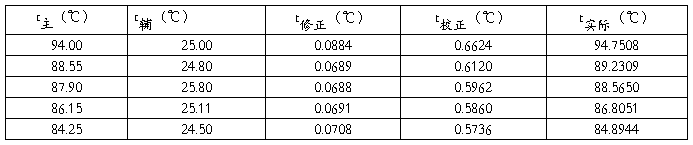
t实际= t主+t修正+t校正
其中:t校正=kn(t主-t辅) k取0.00016;n取60℃;
t修正可以通过温度计修正记录表(表2)数据使用三阶样条插值法,得到每次的修正温度。
表2温度计修正记录表

例如使用t主=87.9℃为例:(当x=87.9时,修正值:0.069)

经过计算得到液体平衡时实际的温度如表3 所示:
表3 气液平衡时实际温度
(三)苯和正庚烷纯组分在本实验不同温度下的饱和蒸汽压和活度系数的计算
(1)苯和正庚烷纯组分在本实验不同温度下的饱和蒸汽压的计算
由Antoine(安托尼)公式:
lgPi0=Ai–Bi/(Ci+t)
式中:
t—温度,℃(即计算所得的实际温度) P0—饱和蒸汽压,mmHg
所以可得到:
Pi0=10(Ai-Bi/(Ci+t))
纯物料的Antoine常数见表4
表4:纯物料的安托尼常数

以87.90℃为例:
苯的饱和蒸气压p10=10(6.87987-1196.76÷(219.161+88.5650))=979.10mmHg
正庚烷的饱和蒸气压P20=10(6.89386-1264.37÷(216.64+88.5650)=563.86mmHg
计算五组纯组分饱和蒸汽计算结果见表5
表5:纯组分饱和蒸汽在实验温度下计算结果
(2)苯和正庚烷纯组分在本实验不同温度下的活度系数的计算
由实验测得等压下气液平衡数据,则可用下式计算不同组成下的活度系数:
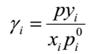
以87.90℃为例计算:
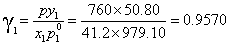

表6 苯和正庚烷活度系数计算表

(四)用非线形最小二乘法回归配偶参数Λ12 、Λ21 并求液相组成
活度系数和组成关系采用Wilson方程关联
lnγ1=-ln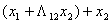

lnγ2=-ln
目标函数选为气相组成误差的平方和,即
F=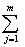 (y1实-y1计)2j+(y2实-y2计)2j
(y1实-y1计)2j+(y2实-y2计)2j
用非线性最小二乘法拟合:matlab拟合程序见下:
function F=li(bb)
x1=[0.214 0.304 0.412 0.466 0.568]
x2=[0.786 0.696 0.588 0.534 0.432]
y1=[0.244 0.450 0.508 0.592 0.688]
y2=[0.756 0.550 0.492 0.0.408 0.312]
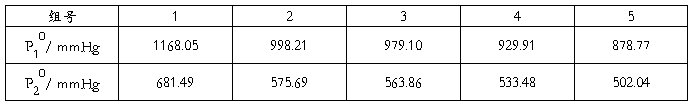
p10=[1168.05 998.21 979.10 929.90 878.77 ]
p20=[681.49 575.69 563.86 533.48 502.04]
fori=1:4 F(i)=y1(i)-p10(i)*x1(i)/760*exp(-log(x1(i)+bb(1)*x2(i))+x2(i)*(bb(1)/(x1(i) +bb(1)*x2(i))-bb(2)/(x2(i)+bb(2)*x1(i))))
end
fori=5:8
j=i-4 F(i)=y2(j)-p20(j)*x2(j)/760*exp(-log(x2(j)+bb(2)*x1(j))+x1(j)*(bb(2)/(x2(j) +bb(2)*x1(j))-bb(1)/(x1(j)+bb(1)*x2(j))))
end
运行得:
bb= 0.0737 2.6058
Resnorm= 0.0137
即所得的二元配偶参数Λ12=0.0737;Λ21=2.6058,方差为 0.0137。
(2)计算苯的气相浓度:
取平衡温度87.90℃为例:
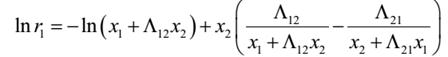
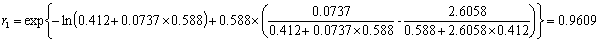
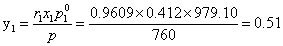
分别计算五组数据可得表5
表5 苯的计算气相浓度
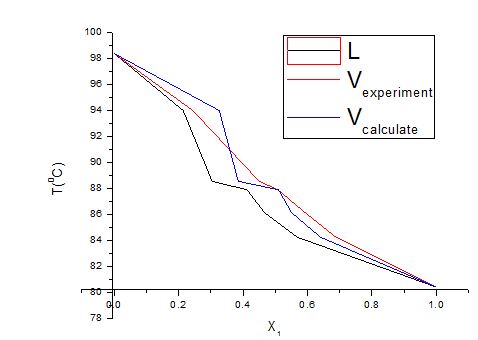
得到实验和计算的t-x-y相图如下:
(六)结果分析讨论
1)实验结果讨论
从实验的结果的相图和气相组成的实验值和计算值的比较来看,本次实验测得以及回归所得实验数据可靠,误差均在实验允许范围内。从相图可以看出,第一点的数据误差大,估计和操作有关,但总体来说本实验数据很好的体现了常规二元气液平衡相图规律。
(2)实验误差分析
由于本次实验只是降温操作,每次均是取出混和液,加入纯苯,所以整个实验过程测定的温度是逐渐下降的,而且实验测定的气液相平衡组成是采集的数据点也不是十分的充足,以致相点分布欠佳。在使用阿贝折射仪测定折射率的时候存在读数误差,以及由折射率在折射率—组成的工作曲线上读取气液相组成时候存在误差。读取温度计的温度的时候存在估读误差。
(七)、思考题
(1)实验中怎样判断气液两相已达到平衡?
答:实验中采用对比法来判断气液两相是否达到平衡。即先记录下来一个体系的温度,然后每隔2至3分钟读一次温度,如果相邻两次温度读数不再发生变化,则可判定气液两相达到平衡。
(2)影响气液平衡测定准确度的原因有那些?
答:①装置的气密性;②平衡温度的读取;③由阿贝折射仪读取混和液折射率的误差;④在阿贝折射仪工作曲线上由折射率读取气液相组成存在读数误差;⑤取样时气液是否达到平衡;⑥是否选取了合理的取样点。
第二篇:色谱实验报告
色 谱 实 验 报 告

项目一:气相色谱流出曲线的研究 一:实验目的
1、
2、
3、 掌握气相色谱仪的基本结构及工作原理 理解色谱流出曲线中各参数的表示方法 掌握气相色谱中定性、定量分析方法
二、实验原理
气相色谱的固定相是涂布在载体表面的固定液,试样气体由载气携带进入色谱柱,与固定液接触时,气相中各组分便溶解在固定液中。随着载气的不断通入,被溶解的组分又从固定液中挥发出来,挥发出的组分随载气向前移动时又再次被固定液溶解。由于各组分在固定液中的溶解能力不同,随着载气的流动,各组分在两相间经过反复的溶解-挥发过程,经过一段时间,最终实现彼此分离。
色谱图是指被测组分从进样开始,经色谱柱分离到组分全部流过检测器后,所产生的响应信号随时间分布的图像。色谱图上有一组色谱峰,每每个峰代表试样中的一个组分。色谱流出曲线是以组分流出色谱柱的时间或载气流出的体积为横坐标,以检测器对各组分的电信号响应值为纵坐标的一条曲线。
三、仪器与试剂
1、仪器
气相色谱仪
2、试剂
乙醇、正丁醇
2
四、实验步骤
1、调试气相色谱仪
2、分别进行进样
3、进乙醇和正丁醇的混合物样品,分别记录保留时间
五、实验记录
1、色谱条件:50m 柱经:320?m 固定液:聚乙二醇
载气:氮气 检测器类型:FID 检测器温度:150℃
柱温:95℃ 气化室温度:165℃
气体流量:载气30ml/min
2、色谱图参数
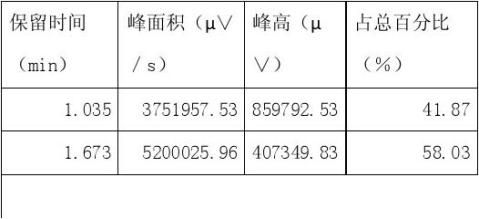
六:实验结果分析
从实验结果所占百分比可以看出该实验出峰效果较明显,乙醇先出峰,正丁醇后出峰。在做实验时我们应注意一些问题,比如说乙醇和正丁醇要按一定的比例来混合,柱温要设置合理,最低要高于正丁 3
醇的沸点,也不能过高,否则会使组分不易分开;过低封效果会不明显。另外进样时要快、准、稳,避免出现拖尾现象。
项目二:白酒中甲醇含量的测定
一、 实验目的
1、
2、 掌握用外标法进行色谱定量分析的方法。 了解氢火焰离子检测器的性能和操作方法。
二、 实验原理
气相色谱法是一种分离效果好,分离速度快,灵敏度高,操作简单,应用范围广的分析方法,它是以气体为流动相,当气体携带着欲分离的混合物流经色谱柱中的固定相时,由于混合物中各组分的性质不同,它们与固定相的作用力大小不同,所以组分在流动相与固定相之间的分配系数不同,经过多次反复分配之后,各组分在固定相中滞留的时间不同,与固定相作用力小的先流出色谱柱,与固定相作用力大的后流出色谱柱,从而实现分离。
外标法是在一定的操作条件下,用纯组分或已知浓度的标准溶液配制一系列不同含量的标准溶液,准确进样,根据色谱图中组分的峰面积(或峰高)对组分含量作标准曲线。在相同操作条件下,依据样品说的峰面积(或峰高),从标准曲线上查出其相应含量。
白酒中甲醇含量的测定,以氢火焰离子化检测器利用醇类物质在氢火焰中的化学电离进行检测,根据甲醇的色谱峰高与标准曲线比较进行定量。
4
三、 仪器与试剂
1、 仪器
气相色谱仪,10?L微量注射器1支
2、 试剂
甲醇(色谱醇),60%乙醇水溶液(不含甲醇)。
四、 实验步骤
1、 色谱柱的准备
将内径为4mm、长为2m的玻璃或不锈钢色谱柱洗净,烘干。采用GDX—102(60~80目)作为固定相制备色谱柱。
2、色谱操作条件:检测器FID;气化室温度200℃;检测室温度150℃;采用程序升温,初始柱温为60℃,保持时间为1min,此后每1min升高20℃直至升至100℃。
3、甲醇标准溶液的配制
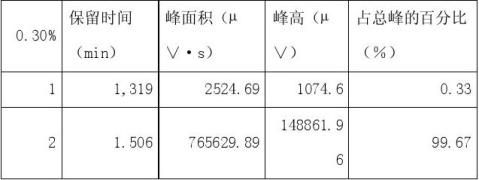
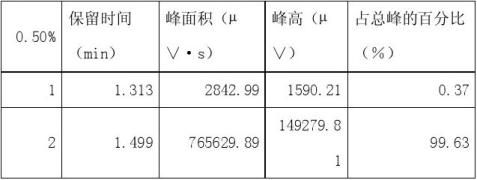
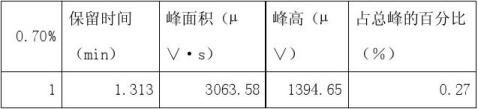
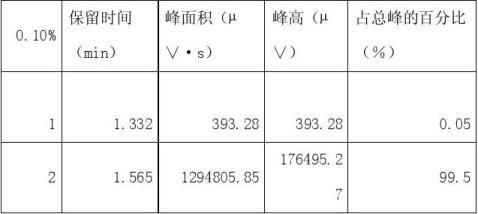
以60%乙醇水溶液为溶剂,配制浓度分别为0.1%、0.3%、0.5%、0.7%的甲醇高标准溶液。
4、甲醇含量的色谱测定
用微量注射器分别吸取10?L各甲醇标准溶液及试样溶液注入色谱仪,获得色谱图,以保留时间作为对照定性,确定甲醇色谱峰。 五:仪器的关机与清洗
六 数据处理及计算结果
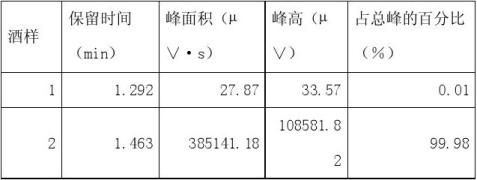
1、 根据试样溶液色谱图中甲醇的峰面积(或峰高),查出试样溶液中甲醇的含量(?g/100mL)。
5
6
七:数据处理与分析
从所得数据可以分析0.1%的甲醇标准溶液和0.7%的甲醇标准溶液出峰效果不太明显,前者可能是由于甲醇的含量少或者进样时不太准确所造成的,后者可能是由于配制甲醇标准溶液时计算出现错误或者是进样人所造成的。从现有数据可得酒样中甲醇的含量为0.01%,与以上相比甚微,所以3含量是不超标的。
实验总结
通过为期一周的实习使我受益颇多,我们要懂得从中查找不足,弥补漏缺。
首先就气相色谱来说最重要的是要注意气路系统、进样系统、柱分离系统检测系统和数据处理系统的打开顺序;而液相色谱也是如 7

此。再则就是配制溶液时要注意各种量的配比,量取物质时如果是定量就要严谨的去称量和移取,如果是定性则可没必要那么精准,只要能定性分析就可以。药品有的有毒性易挥发,如甲醇,要注意!在打开机器前两者要平衡,气相容易平衡,而液相则需流动相来达到平衡,液相平衡前要先脱气谨记脱气完毕要把阀关闭,平衡是个漫长的过程需要的是足够的耐心。然后就是平衡完毕进样前要先设置好合理的方法,否则峰出现得效果不明显或者根本不会出现峰。进样时要把握好方法,达到快、准、稳,液相的微量注射器要到出峰结束拔掉。
实验结束时要把仪器用纯净水清洗干净,且不说价格是多么昂贵,关键是我们要养成良好的实验习惯,这对我们以后踏上工作岗位是有很好的帮助的。
做那么多次实验我们要养成严谨的实验习惯,另外也要多动脑,多动手,不懂就问,不要一知半解,要学会举一反三,毕竟这是我们以后踏上社会时的铁饭碗。

8



9

10
-
物化实验报告_双液系的气液平衡相图
实验5双液系的气液平衡相图丛乐20xx011007生51实验日期20xx年11月10日星期六提交报告日期20xx年11月24日星期…
-
实验五 双液系的气—液平衡相图
深圳大学实验报告课程名称实验项目名称实验五双液系的气液平衡相图学院化学与化工学院报告人班级实验时间实验报告提交时间教务部制目的要求…
-
双液系气—液平衡相图绘制实验报告
双液系气液平衡相图绘制实验目的:①用回流冷凝法测定沸点时气相与液相的组成,绘制双液系相图。找出恒沸点混合物的组成及恒沸点的温度。②…
-
双液系气液平衡相图的绘制
实验四双液系气液平衡相图的绘制姓名谭成彬班级生物工程学院生物工程07级四班学号07041010428一实验目的1测定常压下环己烷乙…
-
双液系的气-液平衡相图的绘制实验报告
实验四双液系的气-液平衡相图的绘制一、目的要求1.用沸点仪测定大气压下乙醇环己烷或异丙醇-环己烷双液系气-液平衡时气相与液相组成及…
-
生产线平衡实验报告
安徽工业大学生产线平衡实验报专业物流专业班级物流101姓名詹庆雯学号109094162日期20xx1223一概述1实验目的及要求告…
-
物化实验报告_双液系的气液平衡相图
实验5双液系的气液平衡相图丛乐20xx011007生51实验日期20xx年11月10日星期六提交报告日期20xx年11月24日星期…
-
物化实验报告-双液系气液平衡相图的绘制
华南师范大学双液系气液平衡相图的绘制实验报告学生姓名戚颖筠同组人黄萍妹李轩娣学号20xx2401162专业化学教育年级班级10化教…
-
研究生液相色谱实验报告
高效液相实验报告实验目的1.了解高效液相色谱仪的类型和各自的优缺点;2.了解液相色谱仪及各检测器的工作原理3.掌握高效液相色谱仪的…
-
分析实验报告 高效液相色谱
华南师范大学实验报告学号专业年级班级课程名称仪器分析实验实验项目液相色谱分析混合样品中的苯和甲苯实验时间一实验目的1掌握高效液相色…
-
液相色谱实验报告
华南师范大学实验报告液相色谱分析混合样品中的苯和甲苯一、实验目的1、掌握高效液相色谱定性和定量分析的原理及方法;2、了解高效液相色…