物理化学实验报告 BZ振荡反应
物理化学实验报告
BZ振荡反应
1.实验报告
(1)了解BZ反应的基本原理。
(2)观察化学振荡现象。
(3)练习用微机处理实验数据和作图。
2. 实验原理
化学振荡:反应系统中某些物理量随时间作周期性的变化。
BZ体系是指由溴酸盐,有机物在酸性介质中,在有(或无)金属离子催化剂作用下构成的体系。有苏联科学家Belousov发现,后经Zhabotinski发现而得名。
本实验以BrO ~ Ce+4 ~ CH2(COOH)2 ~ H2SO4作为反映体系。该体系的总反应为:
~ Ce+4 ~ CH2(COOH)2 ~ H2SO4作为反映体系。该体系的总反应为:
 1
1
体系中存在着下面的反应过程。
过程A:
 2
2
 3
3
过程B:
 4
4
 5
5
 6
6
Br- 的再生过程:

当[Br-]足够高时,主要发生过程A,2反应是速率控制步骤。研究表明,当达到准定态时,有 。
。
当[Br-]低时,发生过程B,Ce+3被氧化。4反应是速率控制步骤。4.5反应将自催化产生 达到准定态时,有
达到准定态时,有 。
。
可以看出:Br- 和BrO 是竞争HbrO2的。当K3 [Br- ]>K4[BrO
是竞争HbrO2的。当K3 [Br- ]>K4[BrO ]时,自催化过程不可能发生。自催化是BZ振荡反应中必不可少的步骤,否则该振荡不能发生。研究表明,Br-的临界浓度为:
]时,自催化过程不可能发生。自催化是BZ振荡反应中必不可少的步骤,否则该振荡不能发生。研究表明,Br-的临界浓度为:

若已知实验的初始浓度[BrO ],可由上式估算[Br- ]crit。
],可由上式估算[Br- ]crit。
体系中存在着两个受溴离子浓度控制的过程A和过程B,当[Br- ]高于临界浓度[Br- ]crit时发生过程A,当[Br- ]低于[Br-]crit时发生过程B。[Br- ]起着开关的作用,他控制着A,B之间的变化。这样体系就在过程A、过程B间往复振荡。
在反应进行时,系统中[Br- ]、[HbrO2]、[Ce+3]、[Ce+4]都随时间作周期性的变化,实验中,可以用溴离子选择电极测定[Br- ],用铂丝电极测定[Ce+4]、[Ce+3]随时间变化的曲线。溶液的颜色在黄色和无色之间振荡,若再加入适量的FeSO4邻菲咯啉溶液,溶液的颜色将在蓝色和红色之间振荡。
从加入硫酸铈铵到开始振荡的时间为t诱 ,诱导期与反应速率成反比。
即

并得到

作图 ~
~ ,根据斜率求出表观活化能
,根据斜率求出表观活化能 。
。
本实验使用的BZ反应数据采集接口系统,并与微型计算机相连。通过接口系统测定电极的电势信号,经通讯口传送到PC。自动采集处理数据。
3.实验仪器与试剂
BZ反应数据采集接口系统
恒温槽 溴酸钾0.25 mol·dm-3
磁力搅拌器 硫酸3.00 mol·dm-3
丙二酸0.45mol·dm-3 硫酸铈铵4×10-3 mol·dm-3
微型计算机 反应器
4.实验步骤
(1)连接电极,将铂电极接入电压输出正端,参比电极接入电压输出负端。
(2)接通恒温槽,调节设定温度至30。启动微机,进入主菜单,打开BZ振荡反应数据采集接口装置。
(3)参数设置菜单中的参数直接使用实验预设的,不必变动。
(4)等待恒温槽达到设定的温度,软件窗口出现提示。
(5)在反应器内加入丙二酸溶液,硫酸溶液,溴酸钾溶液的混合溶液,每种溶液8ml。取硫酸铈铵溶液8ml于锥形瓶中,放入恒温槽内。
(6)5min后,开始实验,将之前准备好的硫酸铈铵溶液倒入反应器中,同时单击记录数据,系统开始采集电位信号。
(7)注意观察反应器中颜色变化,同时观察波形,当画完10完整波形后,点击停止采集。
(8)倒掉反应器中的溶液,用去离子水冲洗反应器和所用电极。
(9)同时调节恒温槽的温度使其升高3度,并电极软件上的“下一次实验”,调整预设温度至33,确定。
(10)重复以上的步骤,每次测量都需要调节温度,并洗刷反应器和电极。
(11)实验完毕后,将原始数据拷贝,关闭仪器电源,冲洗电极和反应器。
5.实验数据及处理
本实验采用A处理方法。
(1)各温度下的电位-时间图像
原始数据中存在一些干扰数据,将干扰数据剔除后作出如下图像。
30℃电位-时间图

33℃电位-时间图

36℃电位-时间图

39℃电位-时间图

计算所绘制的曲线的十个波峰值的平均值,确定此电位差值所对应的时间,这就是起波时间。

(2)作出 -
- 的图像
的图像

斜率值为-4080.607
根据 可求得
可求得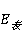 =-8.314*(-4080.607)=33929.16J/mol
=-8.314*(-4080.607)=33929.16J/mol
对于振荡曲线就是由于 浓度的高低会有两种反应过程,
浓度的高低会有两种反应过程, 浓度的高低会决定具体反应的过程,而铂电极是用来
浓度的高低会决定具体反应的过程,而铂电极是用来 浓度的变化,恰好是反应过程B中有
浓度的变化,恰好是反应过程B中有 的参与,所以曲线的这种振荡表示的是
的参与,所以曲线的这种振荡表示的是 浓度的周期性变化,也就间接的表示了
浓度的周期性变化,也就间接的表示了 浓度的周期性变化。
浓度的周期性变化。
6.数据分析
拟合相关度为0.98348,说明拟合较好。但是前两组从拟合直线上还是能明显看出前两组数据偏差较大。本次试验的误差来源有如下几项:
(1)实验过程中温度有变化,从原始数据上可以很明显的看到反应初始温度和反应结束的温度是不同的,而且均偏离预设温度,这说明反应的控温是不到位的。
(2)加入硫酸铈铵溶液和开始记录实验数据没有同步,这样可能会使起波时间受到一定影响,但是这个在时间上的影响对实验结果的影响并不大。
(3)由于实验要求需要恒温硫酸铈铵溶液一段时间,但是在实验时可能溶液的温度还没有达到预定的温度就开始实验了。
(4)仪器本身也是存在一定误差的,从微机上做出的图像可以看出仪器本身对结果有一定的干扰。
7.思考题
(1)什么是化学振荡现象?产生化学振荡需要什么条件?
化学振荡就是反应系统中某些物理量随时间做周期性的变化。
发生化学振荡现象必须满足如下几个条件:
1.反应必须是敞开体系且远离平衡态;
2.反应历程中应包含自催化的步骤;
3.体系必须存在两个或两个以上的稳定状态。
(2)本实验中直接测定的是什么量?目的是什么?
本实验直接测定的是电位差,通过波形和电位差可以求出起波时间,根据起波时间和反应的温度求表观活化能。
第二篇:12 BZ振荡反应
实验十二 BZ振荡反应
一、实验目的
1.了解BZ振荡反应的基本原理;体会自催化过程是产生振荡反应的必要条件。
2.初步理解耗散结构系统远离平衡的非线性动力学机制。
3.掌握测定反应系统中电势变化的方法;了解溶液配制要求及反应物投放顺序。
二、实验原理
自然界存在大量远离平衡的敞开系统,它们的变化规律不同于通常研究的平衡或近平衡的封闭系统,与之相反,它们是趋于更加有秩序、更加有组织。由于这类系统在其变化过程中与外部环境进行了物质和能量的交换,并且采用了适当的有序结构来耗散环境传来的物质和能量,这样的过程称为耗散过程。受非线性动力学控制,系统变化显示了时间、空间的周期性规律。
目前研究的较多、较清楚的典型耗散结构系统为BZ振荡反应系统,即有机物在酸性介质中被催化溴氧化的一类反应,如丙二酸在Ce4+的催化作用下,自酸性介质中溴氧化的反应。BZ振荡反应是用首先发现这类反应的前苏联科学家Belousov及Zhabotinsky的名字而命名的,其化学反应方程式为:
 (1)
(1)
真实反应过程是比较复杂的,该反应系统中HBrO2中间物是至关重要的,它导致反应系统自催化过程发生,从而引起反应振荡。为简洁的解释反应中有关现象,对反应过程适当简化如下:
当Br-浓度不高时,产生的HBrO2中间物能自催化下列过程:
 (2)
(2)
 (3)
(3)
在反应(3)中快速积累的Ce4+又加速了下列氧化反应:
 (4)
(4)
通过反应(4),当达到临界浓度值 后,反应系统中下列反应成为主导反应:
后,反应系统中下列反应成为主导反应:
 (5)
(5)
 (6)
(6)
反应(6)与反应(2)对HBrO2竞争,使得反应(2)、(3)几乎不发生。Br-不断消耗,当Br-消耗到临界值以下,则反应(2)、(3)为主导作用,而反应(5)、(6)几乎不发生。由此可见,反应系统中Br-浓度的变化相当于一个“启动”开关,当 时,反应(2)、(3)起主导作用,通过反应(4)不断使Br-积累;当
时,反应(2)、(3)起主导作用,通过反应(4)不断使Br-积累;当 时,反应(5)、(6)起主导作用,Br-又被消耗。由于反应(2)、(3)中存在自催化过程,使动力学方程式中出现非线性关系,导致反应系统出现振荡现象。Br-在(5)、(6)中消耗,又在反应(4)中产生;Ce3+、Ce4+分别在(3)、(4)中消耗和产生,所以Br-、Ce3+、Ce4+在反应过程中浓度会出现周期性变化,而
时,反应(5)、(6)起主导作用,Br-又被消耗。由于反应(2)、(3)中存在自催化过程,使动力学方程式中出现非线性关系,导致反应系统出现振荡现象。Br-在(5)、(6)中消耗,又在反应(4)中产生;Ce3+、Ce4+分别在(3)、(4)中消耗和产生,所以Br-、Ce3+、Ce4+在反应过程中浓度会出现周期性变化,而 和
和 反应物,在反应过程中不断消耗,不会再生,因此,它们不会出现振荡现象。
反应物,在反应过程中不断消耗,不会再生,因此,它们不会出现振荡现象。
 值又反应(2)、(6)可求得
值又反应(2)、(6)可求得

所以 
三、仪器与试剂:
NDM-1电压测量仪; SYC-15B超级恒温水浴;
磁力搅拌器; 反应器100ml;
217型甘汞电极; 213型铂电极;
数据采集接口装置; 计算机;
溴酸钾(GR); 硝酸铈铵(AR);
丙二酸(AR); 浓硫酸(AR)。
四、仪器装置连接图:

五、实验步骤:
1.用1.00 硫酸作217型甘汞电极液接;
硫酸作217型甘汞电极液接;
2.按图连接好仪器,打开超级恒温水浴,将温度调节至25.0±0.1℃;
3.配制0.45 丙二酸250ml、0.25
丙二酸250ml、0.25 溴化钾250ml、3.00
溴化钾250ml、3.00 硫酸250ml;在0.20
硫酸250ml;在0.20 硫酸介质中配制
硫酸介质中配制 的硫酸铈铵250ml。
的硫酸铈铵250ml。
4.在反应器中加入已配好的丙二酸溶液、溴酸钾溶液、硫酸溶液各15ml;
5.打开磁力搅拌器,调节合适速度;
6.将精密数字电压测量仪置于分辨率为0.1mV档(即电压测量仪的2V档),且为“手动”状态,甘汞电极接负极,铂电极接正极;
7.恒温5min后,加入硫酸铈铵溶液15ml,观察溶液颜色的变化,同时开始计时并记录相应的变化电势;
8.电势变化首次到最低时,记下时间 ;
;
9.用上述方法将温度设置为30℃、35℃、40℃、45℃、50℃重复实验,并记下 ;
;
10.根据 与温度数据
与温度数据 作图。
作图。
六、注意事项
1.实验中溴酸钾试剂要求纯度高,为GR级;其余为AR级。
2.配制硫酸铈铵溶液时,一定要在0.2 硫酸介质中配制,防止发生水解呈浑浊。
硫酸介质中配制,防止发生水解呈浑浊。
3.反应器应清洁干净,转子位置和速度都必须加以控制。
4.电压测量仪一定要置于0.1mV分辨率的手动状态下。
5.跟电脑连接时,要用专用通讯线将电压测量仪的串行口与电脑串行口相接,在相应软件下工作。
七、思考题
1.试述影响诱导期的主要因素。
2.初步说明BZ振荡反应的特征及本质。
3.说明实验中测得的电势的含义。
-
大学物理化学实验报告
物理化学实验报告年月日评定姓名学号年级专业室温大气压一实验名称BET容量法测定固体的比表面积二实验目的三实验原理四实验数据及处理五…
-
物理化学实验报告
《大学化学基础实验2》实验报告课程:物理化学实验专业:环境科学班级:学号:学生姓名:指导教师:实验日期:5月24日实验一、溶解焓的…
-
物理化学实验报告
物理化学实验报告院系班级学号姓名1实验一计算机联用测定无机盐溶解热日期20xxXX同组者姓名XXXXX成绩一实验目的1用量热计测定…
-
物理化学实验实验报告四
二组分完全互溶系统的气液平衡相图一实验目的1学习测定气液平衡数据及绘制二元系统相图的方法加深理解相律和相图等概念2掌握正确测量纯液…
-
物理化学实验总结报告.
物理化学实验总结报告班级11精化学号311120xx30实验1二组分金属相图的绘制11实验的操作关键要点1用电炉加热样品时温度要适…
-
B-Z振荡反应实验报告
BZ振荡反应姓名学号班级同组实验者实验日期提交报告日期实验助教1引言11实验目的1了解BelousovZhabotinski反应的…
-
B-Z振荡反应实验报告
BZ振荡反应姓名何一白学号20xx0119xx班级化22实验日期20xx年11月6日提交报告日期20xx年11月22日带实验的老师…
-
BZ振荡反应实验报告
物理化学实验报告20xx030020BZ振荡反应华天瑞20xx030020生34同组于泽铭实验日期20xx1018提交报告日期20…
-
BZ振荡反应实验报告
验九BZ振荡反应一实验目的1了解BZ振荡反应的基本原理体会自催化过程是产生振荡反应的必要条件2初步理解耗散结构系统远离平衡的非线性…
-
实验八 BZ振荡反应实验报告
实验八BZ振荡反应一实验目的1了解BZ振荡反应的基本原理体会自催化过程是产生振荡反应的必要条件2初步理解耗散结构系统远离平衡的非线…
-
20xx生物化学实验报告册模板
生物化学实验报告姓名:张三学号:20xx000000001专业年级:20xx级生物技术组别:第五实验室生物化学与分子生物学实验教学…