南昌大学液体粘滞系数的测定实验报告
实验三 液体粘滞系数的测定
【实验目的】
1.加深对泊肃叶公式的理解;
2.掌握用间接比较法测定液体粘滞系数的初步技能。
【实验仪器】
1.奥氏粘度计 2.铁架及试管夹 3. 秒表 4.温度计
5.量筒 6.小烧杯1个 7.洗耳球
【实验材料】
蒸馏水50ml 酒精25ml
【实验原理】
由泊肃叶公式可知,当液体在一段水平圆形管道中作稳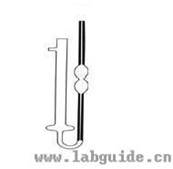 定流动时,
定流动时,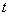 秒内流出圆管的液体体积为
秒内流出圆管的液体体积为
 (1)
(1)
式中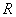 为管道的的截面半径,
为管道的的截面半径, 为管道的长度,
为管道的长度,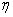 为流动液体的粘滞系数,
为流动液体的粘滞系数,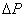 为管道两端液体的压强差。如果先测出
为管道两端液体的压强差。如果先测出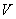 、
、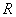 、
、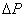 、
、 各量,则可求得液体的粘滞系数
各量,则可求得液体的粘滞系数
 (2)
(2)
为了避免测量量过多而产生的误差,奥斯瓦尔德设计出一种粘度计(见图1),采用比较法进行测量。取一种已知粘滞系数的液体和一种待测粘滞系数的液体,设它们的粘滞系数分别为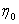 和
和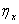 ,令同体积
,令同体积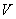 的两种液体在同样条件下,由于重力的作用通过奥氏粘度计的毛细管DB,分别测出他们所需的时间
的两种液体在同样条件下,由于重力的作用通过奥氏粘度计的毛细管DB,分别测出他们所需的时间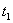 和
和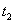 ,两种液体的密度分别为
,两种液体的密度分别为 、
、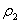 。则
。则
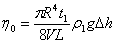 (3)
(3)
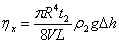 (4)
(4)
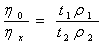 式中
式中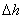 为粘度计两管液面的高度差,它随时间连续变化,由于两种液体流过毛细管有同
为粘度计两管液面的高度差,它随时间连续变化,由于两种液体流过毛细管有同
样的过程,所以由(3)式和(4)式可得:
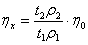 (5)
(5)
如测出等量液体流经DB的时间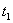 和
和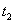 ,根据已知数
,根据已知数 、
、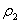 、
、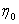 ,即可求出待测液体的粘滞系数。
,即可求出待测液体的粘滞系数。
【实验内容与步骤】
(1) 用玻璃烧杯盛清水置于桌上待用,并使其温度与室温相同,洗涤粘度计,竖直地夹在试管架上。
(2) 用移液管经粘度计粗管端注入6毫升水。用洗耳球将水吸入细管刻度C上。
(3) 松开洗耳球,液面下降,同时启动秒表,在液面经过刻度D时停止秒表,记下时间t。
(4) 重复步骤(2)、(3)测量7次,取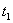 平均值。
平均值。
(5) 取6毫升的酒精作同样实验,求出时间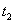 的平均值。
的平均值。
【数据记录与处理】
奥氏粘度计测酒精的粘滞系数数据表 室温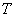 = 27℃
= 27℃

根据公式(5)求出酒精溶液的粘滞系数。
ρ水=0.99654×103kg/m3 ρ酒=0.78352×103kg/m3
η水=0.855×10-3pa/s η标=1.05×10-3pa/s
计算得出η实=1.057×10-3pa/s
相对误差E=(η实-η标)/η标×100%=0.67%
【实验误差分析】
1.用洗耳球将液体吸至刻度C处时不能做到恰好到位,导致两液体V不等。
2.实验过程中对奥氏粘度计的接触使得不与水平面垂直。
3.酒精的密度与理论值有相差。
【注意事项】
1.奥氏粘度计下端弯曲部分很容易折断,操作过程中只能握大管,不要一手同时握两管。
2.实验过程应保持奥氏粘度计竖直。
3.实验不应将秒表太用力按,以免次数太多导致损坏。
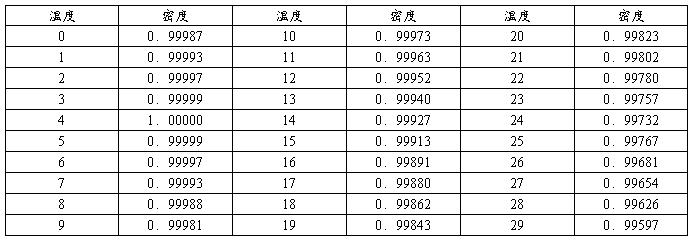
附表一 水的密度(103×kg/m3)
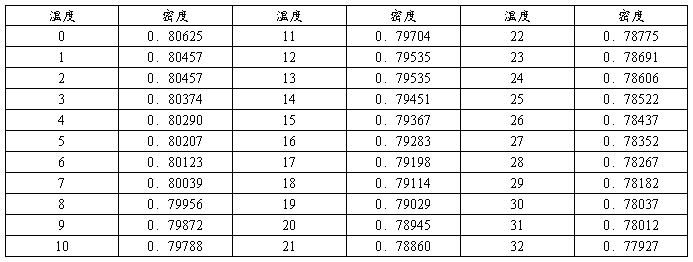
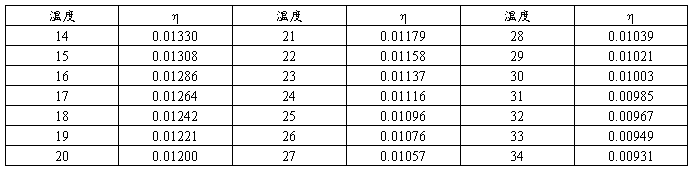
附表二 酒精的密度(103×kg/m3)
附表三 水的粘滞系数(泊)(1泊=0.1泊·秒)
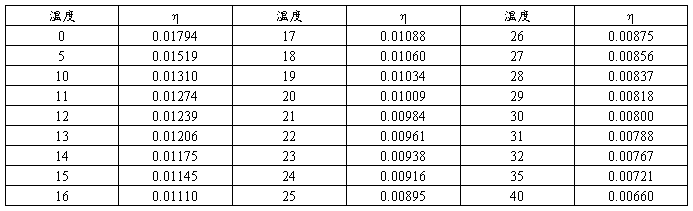
附表四 酒精粘滞系数(泊)
第二篇:溶解热的测定实验报告 (南昌大学)
南昌大学物理化学实验
溶解热的测定实验报告
一、 实验目的
1 .了解电热补偿法测定热效应的基本原理及仪器使用。
2.测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
二、 基本原理
1.物质溶解于溶剂过程的热效应称为溶解热。它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。前者是1mol溶质溶解在n0mol溶剂中时所产生的热效应,以Qs表示。后者是1mol溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。前者是把原含1mol溶质和n01mol溶剂的溶液稀释到含溶剂n02mol时所产生的热效应,以Qd表示,显然。后者是1mol溶剂加到无限量某一定浓度溶液中时所产生的热效应,即。
2.积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:
设纯溶剂、纯溶质的摩尔焓分别为H*m,A和H*m,B,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为Hm,A和Hm,B,若由nAmol溶剂和nBmol溶质混合形成溶液,则
混合前的总焓为 H = nAH*m,A + nBH*m,B (1)
混合后的总焓为 H? = nAHm,A + nBHm,B (2)
此混合(即溶解)过程的焓变为
ΔH = H? – H
= nA(Hm,A – H*m,A)+ nB(Hm,B – H*m,B)
= nAΔHm,A + nBΔHm,B (3)
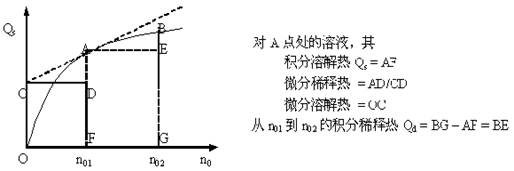
根据定义,ΔHm,A即为该浓度溶液的微分稀释热,ΔHm,B即为该浓度溶液的微分溶解热,积分溶解热则为:
故在Qs ~ n0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。如图所示:
3.本实验系统可视为绝热,硝酸钾在水中溶解是吸热过程,故系统温度下降,通过电加热法使系统恢复至起始温度,根据所耗电能求得其溶解热:Q = IVt = I2Rt 。
三、 实验仪器与用品
量热计(包括杜瓦瓶、电加热器、磁力搅拌器)1套,精密稳流电源1台,电子天平1台,硝酸钾(A.R.)约25.5g,蒸馏水216.2g。
四、 操作步骤
1.在电子天平上称质量约为1.5 g 的硝酸钾(应预先研磨并烘干),记下准确数据并编号。
2.在用量筒量取200mL蒸馏水于杜瓦瓶内。
3.将搅拌小磁棒放入杜瓦瓶内,调节搅拌旋钮使小磁棒在杜瓦瓶内均匀搅拌。然后盖上杜瓦瓶的盖子。
4.几分钟后,当数字显示上的温度稳定,按置零按钮将温度置零。接通电源,调节电流旋钮使电流为0.5A,加热杜瓦瓶内的水。
5.当温度上升到0.5K时,开始计时,并加入第一份硝酸钾样品,当温度再次升到0.5K时,记下时间并加入第二份酸钾样品。重复上述操作,直到加完3份样品。
五、 数据记录与处理
m水=216.2g n水=12.0mol 电流I=0.5A 电阻R=12.4Ω
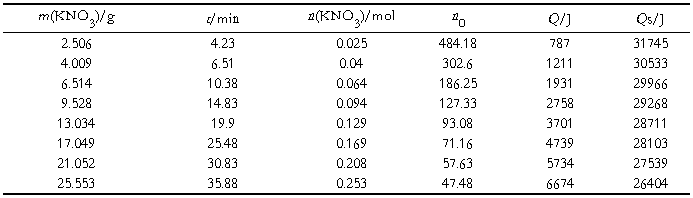
以Qs对n0作图得

进行拟合得Y=1337.41*ln(X-36.85)+23323.03
由于微分稀释热为斜率,积分溶解热为Y值,可算得

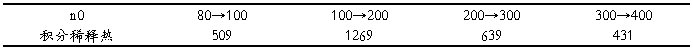
六、 实验注意事项
1.仪器要先预热,以保证系统的稳定性。在实验过程中要求I、V也即加热功率保持稳定。
2.加样要及时并注意不要碰到杜瓦瓶,加入样品时速度要加以注意,防止样品进入杜瓦瓶过速,致使磁子陷住不能正常搅拌,也要防止样品加得太慢,可用小勺帮助样品从漏斗加入。搅拌速度要适宜,不要太快,以免磁子碰损电加热器、温度探头或杜瓦瓶,但也不能太慢,以免因水的传热性差而导致Qs值偏低,甚至使Qs ~ n0图变形。样品要先研细,以确保其充分溶解,实验结束后,杜瓦瓶中不应有未溶解的硝酸钾固体。
3.电加热丝不可从其玻璃套管中往外拉,以免功率不稳甚至短路。
4.配套软件还不够完善,不能在实验过程中随意点击按钮(如不能点击“最小化”)。
5.先称好蒸馏水和前两份KNO3样品,后几份KNO3样品可边做边称。
七、思考题
1.本实验装置是否适用于放热反应的热效应的测定?
答:不适合,因为本实验使用补偿法,硝酸钾在水中溶解吸热,通过电加热法使系统恢复起始的温度,根据所消耗的电能来求其溶解热。所以不能应用于放热反应中。
2.本实验产生温差的主要原因有哪几方面?如何修正?
答:本实验产生温差的原因:(1)电流电压不稳定;(2)加入样品速度太快堵住搅拌棒或加样速度太慢;(3)样品颗粒太大,溶解速度太慢;(4)装置绝热密闭性差,与外界有热交换。
修正:(1)仪器先预热,使实验室电流电压比较稳定;(2)加样速度适中;(3)将颗粒尽量研磨细。
-
实验报告粘滞系数测定
实验报告举例实验题目目的根据斯托克斯公式用落球法测定油的粘滞系数橙色字体的数据是在实验室测量出的原始数据其他数据是计算所得摩擦阻力…
-
落球法测量液体的黏滞系数实验报告
落球法测量液体的黏滞系数实验报告一实验题目落球法测量液体的黏滞系数二实验目的学会使用PID温控试验仪掌握用落球法测量液体的黏滞系数…
-
落球法测量液体的粘滞系数实验报告
一名称落球法测量液体的黏滞系数二目的1观察小球在液体中的下落过程了解液体的内摩擦现象2掌握用落球法测定液体粘滞系数的原理和方法3掌…
-
南昌大学液体粘滞系数的测定实验报告
实验三液体粘滞系数的测定实验目的1加深对泊肃叶公式的理解2掌握用间接比较法测定液体粘滞系数的初步技能实验仪器1奥氏粘度计2铁架及试…
-
液体粘滞系数测定实验
液体粘滞系数的测量与研究一实验目的1了解用斯托克斯公式测定液体粘滞系数的原理掌握其适用条件2学习用落球法测定液体的粘滞系数3熟练运…
-
实验报告粘滞系数测定
实验报告举例实验题目目的根据斯托克斯公式用落球法测定油的粘滞系数橙色字体的数据是在实验室测量出的原始数据其他数据是计算所得摩擦阻力…
-
落球法测量液体的黏滞系数实验报告
落球法测量液体的黏滞系数实验报告一实验题目落球法测量液体的黏滞系数二实验目的学会使用PID温控试验仪掌握用落球法测量液体的黏滞系数…
-
落球法测量液体的粘滞系数实验报告
一名称落球法测量液体的黏滞系数二目的1观察小球在液体中的下落过程了解液体的内摩擦现象2掌握用落球法测定液体粘滞系数的原理和方法3掌…
-
实验报告粘滞系数测定
实验报告举例实验题目实验目的1学习斯托克斯公式用落球法测定油的粘滞系数2了解斯托克公式的修正方法3橙色字体的数据是在实验室测量出的…
-
落球法测量液体的黏滞系数实验报告
实验名称落球法测量液体的黏滞系数实验目的测定蓖麻油的黏滞系数实验器材变温黏度测量仪ZKYPID温控实验仪秒表螺旋测微器钢球若干温控…
-
液体粘滞系数的测定创新实验报告
液体粘滞系数的测定多管落球法创新实验报告学院XXXXXXXXXXXXXXXXXXXXXXX专业XXXXXXXXXXXXXXXXXX…