硝酸钾的制备与提纯实验报告
大学化学实验 报告本 (一)
姓名: 实验室: 周次: 周一 实验柜台: 61 指导老师: 章文伟
硫酸亚铁铵的制备
一.实验目的
1. 学会利用溶解度的差异制备硫酸亚铁铵。
2. 从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质
3. 掌握水浴、减压过滤等基本操作
4. 学习pH试纸、吸管、比色管的使用
5. 学习用目测比色法检验产品质量。
二.原理
铁屑溶于稀硫酸生成硫酸铁。硫酸铁与硫酸铵作用生成溶解度较小的硫酸亚铁铵。
三.仪器及药品
洗瓶、250ml烧杯、10ml量筒、50ml量筒、吸滤瓶、比色管、铁粉、盐酸2mol/L、3mol/L硫酸、
四.实验步骤
1. 硫酸亚铁制备

2.
3. 硫酸亚铁铵的制备


Fe3+的限量分析








五.记录
1. 实验现象:
① 小火加热硝酸钠和氯化钾混合溶液过程中,烧杯内会有氯化钠晶体析出。
② 热过滤后,漏斗滤纸上出现氯化钠白色晶体。
③ 滤瓶内液温降低后,出现白色针状的硝酸钾晶体。
④ 硝酸钾溶液加热浓缩后静置,降至室温出现较多的硝酸钾晶体。
⑤ 抽滤后漏斗上出现干燥的硝酸钾晶体。
2. 产量:粗产品:2.78g
3. 理论产量:
KCl+NaNO3===K NO3+NaCl
m (K NO3) =(8.5*101.1)/85=10.1g
4. 产率:2.78/10.1=27.5%
六.思考题
1. 怎样利用溶解度差别从氯化钾—硝酸钠制备硝酸钾?
当硝酸钠和氯化钾溶液混合时,溶液中会有硝酸钾、氯化钠、硝酸钠和氯化钾四种盐。在不同温度下它们在水中溶解度不同,特别是在较高温度,硝酸钾在水中的溶解度比氯化钠的要大得多,所以在冷却过程中氯化钠首先析出,趁热过滤后滤液中即含有硝酸钾。
2. 实验成败的关键在何处,应采取哪些措施才能使试验成功?
① 热过滤分离氯化钠和硝酸钾时要趁热快速,否则液温下降后硝酸钾也会和氯化钠一
起析出,减低产量。
② 减压过滤时注意不出现穿滤现象。滤纸不可过大,要全部紧贴漏斗底部,可以用双
层滤纸。
3. 产品的主要杂质是什么?怎样提纯?
产品的主要杂质是氯离子,通过重结晶可以除去。
4. 重结晶时,粗产品与水的质量比为什么是2:1?
80℃时硝酸钾的溶解度为169g/100g水,所以1g硝酸钾需水0.6ml,考虑加热时溶剂蒸发,选择粗产品与水的质量比为什么是2:1。
第二篇:实验1 粗盐提纯实验报告
实验1 粗盐提纯
实验目的
1、了解如何除去粗盐中的不溶性杂质和可溶性杂质(硫酸盐、镁离子、钙离子)
2、通过实验进一步巩固溶解、过滤、蒸发等基本操作
实验仪器和药品
药品:粗盐、水、BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸、
仪器:烧杯、玻璃棒、漏斗、滤纸、蒸发皿、酒精灯、铁架台(带铁圈)、坩埚钳、胶头滴管、剪刀、火柴
实验操作
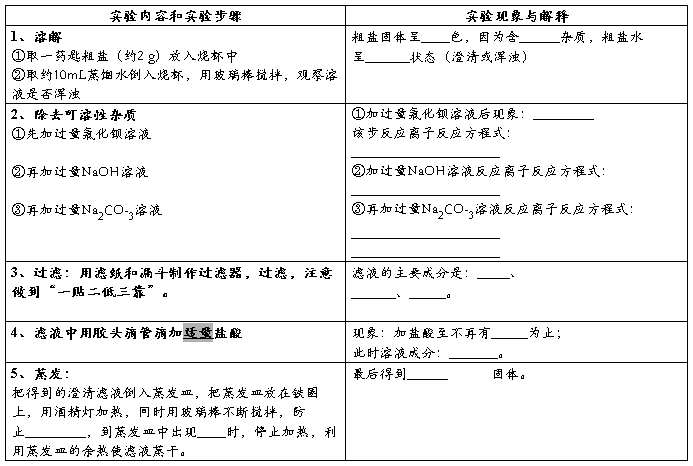
问题与交流
1、如何检验BaCl2溶液已经加过量?具体操作?
2、过滤后滤液仍然浑浊的原因有哪些?
-
无机化学实验十七 硝酸钾的制备
实验十七硝酸钾的制备预习内容转化法一实验目的1利用温度对物质溶解度的影响不同用复分解法制备盐类2练习重结晶法提纯物质进一步巩固溶解…
-
实验十 转化法制备硝酸钾
实验十转化法制备硝酸钾课时安排4学时实验目的1学习用转化法制备硝酸钾晶体2学习溶解过滤间接热浴和重结晶操作实验原理介绍本实验是采用…
-
实验9 转化法制备硝酸钾
实验七转化法制备硫酸钾溶解蒸发结晶和固液分离实验目的学习用转化法制备硫酸钾晶体学习溶解过滤间接热浴和重结晶体操作实验用品仪器量筒烧…
-
大肠杆菌感受态细胞的制备及重组子的转化_实验报告
分子生物学实验报告实验名称大肠杆菌感受态细胞的制备及重组子的转化姓名学号xxx日期大肠杆菌感受态细胞的制备及重组子的转化1引言在分…
-
高考化学 实验化学硝酸钾晶体的制备学案 苏教版修6
硝酸钾晶体的制备思考已知KNO3NaCl的溶解度曲线如图指出除杂方法括号内为少量杂质NaClKNO3KNO3NaCl若上述一次结晶…
-
硝酸钾的制备和提纯
硝酸钾的制备和提纯实验步骤1KNO3的制备1称取100g硝酸钠和80g氯化钾固体导入50mL烧杯中加入200mL蒸馏水2将盛有原料…