实验十 转化法制备硝酸钾
实验十 转化法制备硝酸钾
[课时安排] 4学时
[实验目的]
1、学习用转化法制备硝酸钾晶体;
2、学习溶解、过滤、间接热浴和重结晶操作。
[实验原理介绍]
本实验是采用转化法由NaNO3和KCl来制备硝酸钾,其反应如下:
NaNO3+ KCl?NaCl + KNO3
该反应是可逆的。根据氯化钠的溶解度随温度变化不大,而氯化钾、硝酸钠和硝酸钾在高温时具有较大或很大的溶解度而温度降低时溶解度明显减小(如氯化钾、硝酸钠) 或急剧下降(如硝酸钾)的这种差别,将一定浓度的硝酸钠和氯化钾混合加热浓缩,当温度达118~120℃时,由于硝酸钾溶解度增加很多,达不到饱和,不析出;而氯化钠的溶解度增加很少,随浓缩、溶剂的减少,氯化钠析出。通过热过滤滤除氯化钠,将此溶液冷却至室温,即有大量硝酸钾析出,氯化钠仅有少量析出,从而得到硝酸钾粗产品。再经过重结晶提纯,可得到纯品。
[基本操作与仪器介绍]
1、布氏漏斗及吸滤瓶的使用方法
布氏漏斗和吸滤瓶配套使用于减压过滤。布氏漏斗上有许多小孔,漏斗颈插入单孔橡皮塞,与吸滤瓶相接。橡皮塞插入吸滤瓶内的部分不得超过塞子高度的2/3,漏斗管下方的斜口要对着吸滤瓶的支管口。
2、减压过滤的操作方法
(1) 按1装好仪器,滤纸放入布氏漏斗内(滤纸大小应小于漏斗内径并能将全部小孔盖住为宜)。少量蒸馏水润湿滤纸,开启真空泵,抽气使滤纸紧贴在漏斗上。
(2) 用倾析法先将上清液转移到漏斗上,溶液量不应超过漏斗容量的2/3,待溶液快流尽时再转移沉淀。
(3) 如果吸滤瓶内液面高度快到支管时,拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液,不能从支管口倒出溶液,以免弄脏溶液。
(4) 先拔掉橡皮管,用洗涤液润湿沉淀,然后重新接上橡皮管,尽量抽干,重复此操作2~3次。
(5) 吸滤完毕,拔掉橡皮管,关闭真空泵,如需要的是沉淀,取下布氏漏斗,将沉淀倒在滤纸上或表面皿上,适宜温度下烘干;如需要的是溶液,将溶液从吸滤瓶上口倒入盛接容器。
3、趁热减压过滤操作
(1) 将布氏漏斗热水浴中加热。
(2) 取出漏斗,趁热将滤纸放好,并快速连接好吸滤瓶、真空泵。
(3) 抽滤。
4、蒸发(浓缩)操作
(1) 将溶液倒入蒸发皿内,液体量不能超过其容量的2/3,以防溶液溅出。如液体量较多,可随溶液中水份的不断蒸发继续添加溶液。
(2) 根据物质对热的稳定性选择加热装置——酒精灯、电热板等直接加热或水浴间接加热。
(3) 加热蒸发至出现晶膜,停止加热,冷却,结晶。蒸发皿不能骤冷,以免炸裂。
5、重结晶操作
(1) 根据粗产品质量数,按一定比例加入溶剂,加热溶解。
(2) 加热蒸发至出现晶膜,冷却结晶。
(3) 抽滤,烘干,称重。
[实验重要步骤]
(1)称取11g硝酸钠和7.5g氯化钾放入100mL小烧杯中,加17.5mL蒸馏水,加热并不断搅拌,当小烧杯里的固体全部溶解时(此时温度约84℃),从小烧杯的刻度上粗略地读出此时溶液的体积V1。
(2)继续加热、搅拌,使溶液蒸发浓缩,至烧杯里溶液的体积为原体积的2/3,小烧杯中有较多氯化钠晶体析出。
(3)趁热用热滤漏斗过滤,滤液盛于预先装有1mL蒸馏水(防止氯化钠析出)的小烧杯中。
(4)待滤液冷却至室温后,进行减压过滤,得到较干燥的粗产品硝酸钾晶体,称量。
(5)留下约0.1g粗产品,其余按粗产品与水的质量比为2:1混合,加热、搅拌、待晶体全部溶解后停止加热,冷却至室温后抽滤,水浴烘干,称重。并对重结晶后的产品,进行纯度检验。
[实验中应注意事项]
①先用小火加热使固体全部溶解,然后用大火加热至沸腾,再用小火蒸发浓缩;
②漏斗用热水预热好后,如漏斗是冷的或不太热,硝酸钾就会析出影响产率;
③骤冷结晶过于细小;
④小火烤干(如晶体抽得比较干可省去此步骤)。
实验报告格式(供参考)

[实验习题]
1、何谓重结晶?本实验都涉及哪些基本操作?应注意什么?
答:第一次结晶得到的晶体纯度不合乎要求,可将所得晶体溶于少量溶剂中,然后进行蒸发、浓缩(或冷却)、结晶、分离,如此反复的操作称为重结晶。本实验涉及溶解、热过滤、减压抽滤、重结晶法等基本操作。
2、溶液沸腾后为什么温度高达100℃以上?
答:因为含有盐类,按照溶液依数性,沸点应上升。
3、能否将除去氯化钠后的滤液直接冷却制取纯硝酸钾?
答:不能。因为滤液中仍含有较多氯化钠,属饱和溶液,直接冷却时,会有氯化钠析出。
4、本实验中,影响KNO3产率的主要因素有哪些?
答:影响KNO3产率的因素主要有三点:①蒸发浓缩过程中水量的控制要恰当。若水蒸去太少反应不充分,溶液中的KNO3含量较少;水蒸去太多,溶液中KNO3的饱和度太高,在过滤时随着溶液温度下降会有大量KNO3结晶析出,混在NaCl晶体中被丢弃。②趁热过滤时,漏斗必须预热,保持较高温度。如果漏斗温度较低,滤液骤冷,会有大量KNO3结晶析出,留在滤纸上。③滤液要自然冷却,用于承接滤液的烧杯也要适当预热,防止滤液骤冷,这样才能得到比较大颗粒的晶体。如果滤液骤冷,则得到的结晶颗粒过于细小,抽率时溶液穿过滤纸。
5、实现溶液与沉淀的分离方法有哪几种?用常压过滤实现固液分离,收集滤液,要达到较高的分离效率,过滤操作中应注意什么问题?
答:溶液与沉淀的分离方法有三种:倾析法、过滤法和离心分离法。过滤操作应采用倾析法。即待烧杯中的沉淀下沉以后只将清夜倾入漏斗中,而不是一开始就将沉淀和溶液搅混后过滤。
第二篇:转化法制备硝酸钾相关问题及方案

分子式:KNO3
分子量:101.11
性状:硝酸钾为无色透明斜方晶体或粉末,有潮解性。相对密度2.1109,熔点333℃,易溶于水,溶于乙醇和甘油,不溶于无水乙醇。有强氧化性,与有机物接触、摩擦或撞击能引起燃烧或爆炸。
用途:用作分析试剂,如氧化剂、助熔剂。用于合成钾盐、制造火药、火柴及玻璃生产。还用于显像管生产及电镀行业。
包装:25公斤内塑外编袋包装,或按客户要求
中学用结晶法制备和提纯晶体常用的方法有蒸发结晶,升温结晶、降温结晶和重结晶。晶体的析出过程并非纯粹是一个简单的物理过程,还应考虑干燥过程中酸的挥发,结晶水的丢失,产品本身在高温时易产生的水解、分解或氧化问题。
硝酸钾晶体的制备
步骤:
称取NaNO3和KCl晶体,加少量蒸馏水,小火加热使其中的盐全部溶解,再继续小火加热蒸发至有较多晶体析出,趁热过滤,得KNO3饱和溶液并和NaCl晶体。自然冷却晶体析出(大量的硝酸钾和极少量氯化钠结晶得KNO3晶体,抽滤,用少量饱和KNO3溶液淋洗晶体,晶体置于蒸发皿中烤干,重结晶(加适量水溶解,加热沸腾即止,冷却结晶,抽滤,用饱和KNO3淋洗,在表面皿中水浴烘干) 。
[角度] 本实验都涉及哪些基本操作,应注意什么?
1. 制备硝酸钾的原理?
解析:NaNO3 + KCl = NaCl + KNO3
因为随温度的变化,硝酸钾与氯化钠溶解度的变化不同,硝酸钾随温度升高,溶解度增加很多;而氯化钠随温度升高,溶解度变化很小。所以混合液经蒸发、浓缩后,首先析出氯化钠,趁热过滤除去氯化钠,将已有晶体析出的滤液加沸水溶解,适当蒸发,冷却,析出硝酸钾。
2. 为什么小火加热蒸发?
解析:溶液沸腾后,应调节火焰至小火,以防液体爆沸溅失。
3. 减压过滤(抽滤)和趁热过滤操作都使用的一种主要仪器及作用是什么?
解析:仪器是布氏漏斗,
抽滤:是一种快速过滤法,适用于易溶晶体的分离,若固体需要洗涤,将少量溶剂洒到固体上,静置片刻,再将其抽干。
趁热过滤:目的是防止溶液中的硝酸钾晶体析出。
(如果溶液中的溶质在温度下降时容易析出大量结晶,而我们又不希望它在过滤过程中留在滤纸上,这时就要趁热进行过滤。热过滤有普通热过滤和减压热过滤两种。)
4.预热的目的和方法是什么?
解析:预热的目的是防止冷却析出结晶。
预热方法:将漏斗放在水浴中加热至微沸。
5. 什么情况下需用热过滤法进行固、液分离?
解析:当需要除去热浓溶液中的不溶性杂质,又不能让溶液析出时,一般采用热过滤法。
6.为什么用少量饱和KNO3溶液淋洗晶体?
解析:因硝酸钾的溶解度较大,若用纯水洗涤晶体溶解较多。根据沉淀溶解平衡原理,用少量饱和KNO3溶液淋洗可防止硝酸钾晶体溶解。
7.重结晶的主要步骤及各步的主要目的?
解析:可溶性晶体物质可用重结晶法除去微量杂质
(1)将不纯固体样品溶于适当溶剂: 目的是制成热的近饱和溶液;
(2)将此溶液趁热过滤: 目的是除去不溶性杂质;
(3)将滤液冷却:目的是使结晶析出;
(4)抽气过滤:目的是使晶体与母液分离。
(5)洗涤干燥:目的是除去附着母液和溶剂。
8.若采用重结晶除杂,蒸发温度应控制在什么范围内?
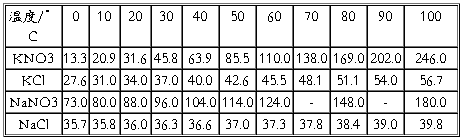
解析:80℃~100℃(参考下表溶解度数据)
四种盐在不同温度下的溶解度/(g/100g水)

9、为什么采用水浴烘干?
解析:防止硝酸钾高温分解。(分解温度380℃)
10、如何检验产品纯度?
解析:0.1g晶体KNO3+2ml水+2滴AgNO3溶液,无白色 AgCl↓
1.何谓重结晶?本实验都涉及哪些基本操作,应注意什么?
2.制备硝酸钾时,为什么要把溶液进行加热和热过滤?
3.试设计从母液提取较高纯度的硝酸钾晶体的实验方案,并加以试验。。
进行产品纯度检验时,应将粗产品和重结晶产品一起检验,进行对比观察。哪个溶液中的浑浊度浅,说明哪个溶液中的Cl-较少。一次重结晶后的产物中还有少量Cl一存在,甚至第二次重结晶后还能检出Cl-。这主要是由于在KNO3晶体长大过程中,Na+和Cl一被包在晶体里,或长大过程中晶体表面不断吸附这些离子造成的,通过多次重结晶能在一定程度上除去杂质,提高产品纯度。
硝酸钾的制备
一.实验目的
1.掌握无机制备中常用的过滤法,着重介绍减压过滤和热过滤。
2.练习加热溶解、蒸发浓缩、结晶等基本操作。
二.实验原理
1.KCl+ NaNO3=KNO3 +NaCl
2.当KCl和NaNO3溶液混合时,混合液中同时存在,由它们组成的四种盐,在不同的温度下有不同的溶解度,利用NaCl、KNO3的溶解度随温度变化而变化的差别,高温除去NaCl,滤液冷却得到KNO3。
表2.1.1 四种盐在水中的溶解度(g/100g H2O)
三.主要仪器与试剂
1 仪器 烧杯 量筒 热过滤漏斗 减压过滤装置 电子天平。
2 试剂 NaNO3(s)、KCl(s)。
四.操作步骤

五.实验结果及分析
结果:1.上述得到的粗KNO3产品重量为:6.7g
2.重结晶后得到的产品重量为:5.00g
分析:1. KCl + NaNO3 = KNO3 + NaCl
75 85 101 59
7.5g 8.5g 10.1g 5.9g
★最后体积为:(15*2/3+7.5)*3/4=13.1
★母液中留有的硝酸钾: 21.2g/100g*13.1g=2.8g
★(在283k时的KNO3溶解度为21.2g/100g水)
★本实验粗产品的理论产量是:10.1g-2.8g=7.3g
★粗产品的产率为:6.7/7.3*100%=91.8%
2 . 理论重结晶率为:(167g-21.2g)/167g*100%=87.3%
实际重结晶率为:5.0 /6.7*100%=74.6%
(在353k时的溶解度为167g/100g水)
六.问题及思考题
●问题:1.产品的主要杂质是什么?怎样提纯?
答:主要杂质是NaCl,可以通过重结晶来提纯。
2.能否将除去氯化钠后的滤液直接冷却制取硝酸钾?
答:不能。滤液直接冷却可以得到较多的硝酸钾,但会混氯化钠,产品纯度下降。
3.考虑在母液中留有硝酸钾,粗略计算本实验实际得到的最高产量。
答:设室温为293K,此时硝酸钾的溶解度为31.6g/100g水,氯化钠的溶解度为36g/100g水,则10mL水可溶解硝酸钾3.2g ,氯化钠为3.6g ,则析出硝酸钾为10.1-3.2 = 6.9g ,氯化钠为4-3.6 = 0.4g ,故共析出7.3g晶体。10.1-21.2*13.1=7.3g
●思考题:1.怎样利用溶解度的差别从氯化钾,硝酸钠制备硝酸钾?
答:NaCl和NaNO3溶液混合时,混合液中同时存在,由它们组成的四种盐,在不同的温度下有不同的溶解度,从利用NaCl、KNO3的溶解度随温度变化的曲线图看出:NaCl的溶解度随温度的变化不大,而KNO3的溶解度随温度的变化而显著变化,所以高温除去NaCl,滤液冷却得到KNO3。
2.实验成败的关键在何处,应采取哪些措施才能使实验成功?
答:在本实验中,热过滤是关键。因此要使实验成功,先准备好合
的滤纸,加热水浴预热漏斗;加7.5mL水在小烧杯内,盖上小
面皿。然后溶解盐,蒸发、浓缩。
七.注意事项
1.热蒸发时,为防止因玻棒长而重,烧杯小而轻,以至重心不稳而倾翻烧杯,应选择细玻棒,同时在不搅动溶液时,将玻棒搁在另一烧杯上
2. 若溶液总体积已小于2/3,过滤的准备工作还未做好,则不能过滤,可在烧杯中加水至2/3以上,再蒸发浓缩至2/3后趁热过滤。
3.要控制浓缩程度,蒸发浓缩时,溶液一旦沸腾,火焰要小,只要保持溶液沸腾就行。烧杯很烫时,可用干净的小手帕或未用过的小抹布折成整齐的长条拿烧杯,以便迅速转移溶液。趁热过滤的操作一定要迅速、全部转移溶液与晶体,使烧杯中的残余物减到最少。
4. 趁热过滤失败,不必从头做起。只要把滤液、漏斗中的固体全部回到原来的小烧杯中,加一定量的水至原记号处,再加热溶解、蒸发浓缩至2/3,趁热过滤就行。万一漏斗中的滤纸与固体分不开,滤纸也可回到烧杯中,在趁热过滤时与氯化钠一起除去
-
硝酸钾的制备与提纯实验报告
大学化学实验报告本一姓名实验室周次周一实验柜台61指导老师章文伟硫酸亚铁铵的制备一实验目的1学会利用溶解度的差异制备硫酸亚铁铵2从…
-
无机化学实验十七 硝酸钾的制备
实验十七硝酸钾的制备预习内容转化法一实验目的1利用温度对物质溶解度的影响不同用复分解法制备盐类2练习重结晶法提纯物质进一步巩固溶解…
-
实验9 转化法制备硝酸钾
实验七转化法制备硫酸钾溶解蒸发结晶和固液分离实验目的学习用转化法制备硫酸钾晶体学习溶解过滤间接热浴和重结晶体操作实验用品仪器量筒烧…
-
大肠杆菌感受态细胞的制备及重组子的转化_实验报告
分子生物学实验报告实验名称大肠杆菌感受态细胞的制备及重组子的转化姓名学号xxx日期大肠杆菌感受态细胞的制备及重组子的转化1引言在分…
-
高考化学 实验化学硝酸钾晶体的制备学案 苏教版修6
硝酸钾晶体的制备思考已知KNO3NaCl的溶解度曲线如图指出除杂方法括号内为少量杂质NaClKNO3KNO3NaCl若上述一次结晶…
-
转化法制备硝酸钾相关问题及方案
KNO3实物分子式KNO3分子量10111性状硝酸钾为无色透明斜方晶体或粉末有潮解性相对密度21109熔点333易溶于水溶于乙醇和…