20xx春季学期 仪器分析实验报告
2013春季学期 仪器分析实验报告
学号 ,姓名 ,成绩
实验一 直接电位法的直接比较法测定饮用水PH值
一、实验目的
1、 熟悉直接电位分析法(离子选择性电极分析法)的概念
2、 掌握离子选择性电极分析法测定原理
3、 了解PH复合电极(复合玻璃电极)结构和使用特点
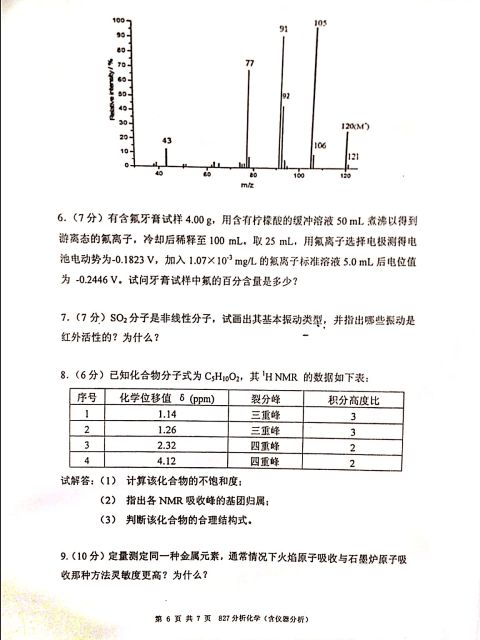
4、 掌握直接比较法测定饮用水PH值的方
二、实验试剂和仪器
1、 ORP电位测定仪(上海大普仪器有限公司)
2、 复合玻璃电极
3、 PH=6.86 标准溶液
三、实验原理
1、 离子选择性电极是一种传感器,它对特定离子有相应。离子选择性电极玻璃电极的敏感膜只对H+有相应。复合玻璃电极是由PH玻璃电极和参比电极组合在一起的复合电极。包括内参比银电极,内参比溶液,玻璃膜,甘汞电极,饱和KCL等构成在一起制作称为PH复合电极。
2、 离子选择性电极分析法测定原理 离子选择性电极(指示电极作为负极,参比电极(常用饱和甘汞电极)作为正极组成电池:
(-)指示电极∣试液‖参比电极(+)
该电池电动势为
E=K′±(0.0592/n)lgai
在一定的条件下,电池电动势E与离子的活度对数lgai成线性关系,这就是定量的基础。离子的活度系数随着离子的强度而改变。因此固定离子强度,离子的活度系数恒定不变,才能保证E与离子的活度对数lgai成线性关系。
四、 实验操作:
ORP电位测定仪操作步骤:
1. 仪器在关机的情况下,小心的将复合玻璃电极将插入离子选择性电极接口上,然后
用超纯水充洗电位的膜表面,再用滤纸吸干水分;
2. 将功能开关置TEM档,然后打开开关,再将温度感应器插入待测水中,,记下温度
测定结果;
3. 将功能开关置mv档,再将PH复合电极插入待测水中,观察显示屏读数,待稳定
后,记下电动势E测定结果(mv)。
五、测定结果与计算
表 1
PH PH=6.86 标准溶液 自来水样 娃哈哈利川水样 电动势E
根据教材P210 公式 (12-16)
计算PHX=
(结果填在上表中)
六、结果讨论
七、思考题
1、离子选择性电极分析测量仪器有什么要求?(见教材P207)
2013春季学期 仪器分析实验报告
学号 ,姓名 ,成绩
实验二 直接电位法测定天然水中的钾和氯含量
一、实验目的
1、 了解钾离子选择电极、氯离子选择电极构成;
2、 熟悉钾离子选择电极、氯离子选择电极的测定原理
3、 掌握比较法和标准加入法测定方法
4、 了解总离子缓冲溶液(TISAB)组成和作用
二、实验仪器和试剂
1、OPR测定仪
2、钾离子选择电极、氯离子选择电极
3、饱和甘汞电极(217电极)
+4、0.10mol/L K 标准溶液
+5、0.001 mol/L K 标准溶液
-6、总离子强度缓冲溶液(TISAB):NaCL 、柠檬酸钠、冰醋酸、氢氧化钠)
7、去离子水
三、离子选择性电极的测定原理 (见教材 P209)
四、实验步骤
1、钾离子电极的准备
+新的钾离子选择电极用0.01 mol/L K 标准溶液侵泡数小时,再用纯净水泡一段时
间,用去离子水冲洗干净。导线插头接离子选择电极的插孔上(负极)。饱和甘汞电极(217电极),小心的打开其上下的橡皮帽,用去离子水冲洗干净。导线插头接参比电极插孔上(正极)。两电极放入小烧杯的水样中,打开OPR测定仪开关,转到mv档,信号稳定后读数。
氯离子选择电极,同上
2、比较法测定水样电位值E
+ 吸取0.001 mol/L K 标准溶液1.00ml于100ml容量瓶中,小心的加入20ml TISAB溶
液,再加去离子水定容的刻度。摇匀。倒出部分溶液入小烧杯,放两电极在其中,开电源,测定,信号稳定后读数Es
吸取水样50.00 ml于100ml容量瓶中,以后同上。读数Ex
3、标准加入法测定水样电位值E1 、E2
吸取水样50.00 ml于100ml容量瓶中小心的加入20ml TISAB溶液,再加去离子水定容的刻度。摇匀。倒出全部溶液入烧杯,放两电极在其中,开电源,测定,信号稳定后读数
+E1 。然后加入1.0 ml,0.001 mol/L K 标准溶液,同样测定,信号稳定后读数E2
五、测定结果及计算
表一 直接比较法
钾 K
-+Es,mv Ex mv Cx mol/L 备注 氯 CL
计算公式
表二 标准加入法
钾 K
-+E1,mv E2 mv Cx mol/L 备注 氯 CL
计算公式
六、结果讨论
七、思考题
总离子缓冲溶液(TISAB)作用是什么?
2013春季学期 仪器分析实验报告
学号 ,姓名 ,成绩
实验三 邻二氮菲分光光度法测定 微量铁
一、 实验目的:
1、 了解测定铁的原理
2、 熟悉标准曲线的测绘
3、 学习吸收曲线的绘制
4、 掌握微量铁含量的测定方法
二、实验仪器与试剂
1、 1.7*10-3 mol/L 铁标准溶储备液
2、 1.0*10-3mol/L 铁标准溶液
3、 100 g/L 盐酸羟胺溶液 (用时配制)
4、 1.50 g/L 邻二氮菲溶液(先用少量乙醇溶液溶解邻二氮菲,再加蒸馏水稀释至所需)
体积
5、 1.0 mol/L 乙酸钠溶液
6、 722型光栅分光光度计
三、实验原理:
四、实验步骤
1、显色标准溶液的配制
2、吸收曲线的绘制
3、标准曲线的测绘
4、按步骤1显色后,再按步骤3测定自来水的吸光度A值
五、实验结果与计算
六、结果讨论
2013春季学期 仪器分析实验报告
学号 ,姓名 ,成绩
实验四 分光光度法测定邻二氮菲—铁络合物 组成
一、实验目的:
1、了解金属离子与配合物配合反应及配位数
2、理解摩尔比法测定络合物组成的原理
3、学习摩尔比法测定络合物组成的方法
二、实验仪器与试剂
1、 1.7*10-3 mol/L 铁标准溶储备液
2、 1.0*10-3mol/L 铁标准溶液
3、 100 g/L 盐酸羟胺溶液 (用时配制)
4、 1.50 g/L 邻二氮菲溶液(先用少量乙醇溶液溶解邻二氮菲,再加蒸馏水稀释至所需)
体积
5、 1.0 mol/L 乙酸钠溶液
6、 722型光栅分光光度计
三、实验原理:
四、实验步骤
1、测定
2、做A -CL/ CM 的图
五、实验结果与计算
六、结果讨论
2013春季学期 仪器分析实验报告
学号 ,姓名 ,成绩
实验五 乙酸的电位滴定分析及解离常数的测定
一、实验目的
1、 学习电位滴定的基本原理和操作方法。
2、 学习PH-V 曲线,ΔPH/ΔV -V曲线作图方法,以及Δ2PH/ΔV 2-V曲线法(二
阶导数法) 用内插法确定滴定终点。
3、 学习测定弱酸解离常数的方法。
二、实验试剂与仪器
1、 酸度计
2、 玻璃复合电极
3、 100ml容量瓶
4、 5ml、10ml移液管
5、 10ml微量碱式滴定管
6、 0.10 mol?l-1 NaOH标准溶液
7、 乙酸试液
8、 PH=4.00标准溶液
三、实验原理
1. 利用滴定过程中电位的变化确定滴定终点的滴定分析法,称为电位滴定分析法。实验时,随着滴定剂的加入,滴定反应的进行,待测离子浓度不断地变化,,在理论终点附近,待测离子浓度发生突跃,因此,测量试液PH的变化,即可确定滴定终点。
电位滴定可用于混浊、有色及缺乏合适指示剂的溶液确定,海口用于浓度较稀、反应不完全如很弱的酸、很弱的碱滴定、并用于混合溶液连续滴定、非水介质中的滴定。且易于实现自动滴定。
2、电位滴定法确定滴定终点
PH-V 曲线法 方法见教材P 213,寻找该PH-V 曲线的拐点,其对应的V′即为滴定终点所消耗滴定剂NaOH标准溶液的体积。做 图1 PH-V
ΔPH/ΔV -V曲线法 方法见教材P 213,滴定终点时,PH改变大,
ΔPH/ΔV达最大值,曲线最高点应的V′即为滴定终点所消耗滴定剂NaOH标准溶液的体积。做 图2 ΔPH/ΔV -V
Δ2PH/ΔV 2-V曲线法(二阶导数法) 用内插法确定滴定终点,终点时,
Δ2PH/ΔV 2=0,此时对应的V′即为滴定终点所消耗滴定剂NaOH标准溶液的体积。
3、弱酸解离常数的确定 (方法见见教材P 215,例12-2,)当用NaOH标准溶液滴定到滴定终点一半时,此时,[H]=Ka,故PKa 等于滴定终点一半所对应的PH值。 +
四、实验操作
1、安装好滴定管、酸度计和磁力搅拌器
2、酸度计调试,校正
3、吸取乙酸试液10ml,置入100ml容量瓶中,定容。再吸取稀释后的乙酸试液10ml
于100 ml烧杯中,加水30 ml,加入搅拌子。
4、开机滴定,按下表1进行粗测。 初步估计PH突跃范围。 5、按第3、第4步操作进行细测.见表2。 表1 粗测
V ml 0 ml 1 ml 2ml 3 ml 4 ml 5 ml 6 ml 7 ml 8 9 PH
表2 细测
V ml 0 1 1.5 1.6 1.7 1.8 1.9 2.0 2.1 2.2 2.3 2.4 3 4 5 6 7 8 9
PH PH/ΔV Δ2
PH/
2
ΔV
五、实验结果及计算
1、按电位滴定法三种方法确定终点,
PH-V 曲线法滴定终点为 ;ΔPH/ΔV -V曲线法终点为 ;Δ2PH/ΔV 2-V曲线法(二阶导数法)终点为 。
1、计算乙酸试液浓度
乙酸试液浓度 C = (g?L-1)
2、查图1 在PH-V 曲线上,滴定终点一半所对应的PH值,即乙酸PKa = ?
六、结果讨论
1、二元弱酸碳酸的PKa1 ,PKa2如何确定的?
2、对混浊、有色及缺乏合适指示剂溶液如何确定滴定终点?
2013春季学期 仪器分析实验报告
学号 ,姓名 ,成绩
实验六 有机化合物的吸收带、吸收峰及其溶剂效应
一、实验目的
1、 明确吸收带的定义及分类(K带、B带、R带)
2、 熟悉发色团、助色团的定义以及与吸收峰之间的关系
3、 了解、观测溶剂对吸收峰的影响,即溶剂效应
4、 了解紫外吸收光谱检测物质的纯度方法。
5、 学习紫外-可见光谱仪的使用
二、实验试剂与仪器
1、 紫外-光谱仪
2、 苯、丙酮、正己烷、乙醇、水
三、实验原理
1、 具有不饱和的有机化合物,如芳香族化合物,在紫外区(200~400nm)有特征的吸收,为有机化合物的鉴定提供了有用的信息。
2、 发色团、助色团的定义
**3、 极性溶剂和非溶剂对π→π 和n→π 的影响
四、实验操作
1 开机
2、调试
3、苯的吸收光谱的测绘
在1 cm的石英吸收池(比色皿)中,加入两滴苯,在紫外-可见光谱仪上,以空白石英吸收池为参比,进行扫描,绘制吸收光谱。确定峰值波长。
4、 乙醇中杂质苯的检查
用在1 cm的石英吸收池中,以乙醇为参比溶液,在230~280 nm波长范围内测绘乙醇试样中的吸收光谱
5、 溶剂极性对紫外吸收光谱的影响
5.1 在1个石英吸收池(比色皿)加入苯-正己烷溶液,以正己烷为参比,测绘200~350 nm范围内的吸收光谱。
另外一个比色皿加入丙酮-正己烷溶液,以正己烷为参比,测绘200~350 nm范围内的吸收光谱。
5.2在在1个石英吸收池(比色皿)加入苯-乙醇溶液,以乙醇为参比,测绘200~350 nm范围内的吸收光谱。
在1个石英吸收池(比色皿)加入丙酮-乙醇溶液,以乙醇为参比,测绘200~350 nm范围内的吸收光谱
五、实验结果与分析
1、苯的吸收光谱的测绘结果
2、乙醇中杂质苯测绘结果
3、溶剂极性对紫外吸收光谱的影响
表 苯、丙酮的溶剂效应
溶剂
*正己烷
*乙 醇 波长位移 备注 π→π nm nm n→π
第二篇:分析化学(含仪器分析)20xx






-
仪器分析实验报告
仪器分析实验报告1质谱仪的简介质谱仪是通过对样品电离后产生的具有不同质荷比mz的离子来进行分离分析的先将待分析样品变成气态在具有一…
-
仪器分析实验1——实验报告
原子吸收分光光度法测定水样中钠离子含量班级09化工3班姓名肖普学号0910370315一实验目的1掌握原子吸收分光光度法测定水样中…
-
仪器分析实验报告书写
每人一份复印后按照要求认真写出实验报告液相色谱实验一实验报告的书写要求实验题目液相色谱仪的结构和工作原理实验目的掌握液相色谱仪的结…
-
仪器分析实验报告
实验一紫外可见分光光度计的性能检验一实验目的1掌握紫外可见分光光度计性能的检验方法2学会UV1100型紫外可见分光光度计的使用方法…
-
仪器分析实验报告
现代分析仪器观摩见习实习报告姓名朱亚伟学号15124059院系生物化学系年级专业12级化学工程与工艺现代分析仪器观摩见习实习报告作…
-
滴定法实验总结报告
蒸馏后碱滴定法1原理亚硫酸盐在酸性条件下用碱中和加热亚硫酸盐被过氧化氢吸收用碱中和并滴定至终点根据消耗标液用量计算其含量H2O2H…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…
-
分析化学实验报告(武汉大学第五版)
分析化学实验报告陈峻贵州大学矿业学院贵州花溪550025摘要熟悉电子天平的原理和使用规则同时可以学习电子天平的基本操作和常用称量方…
-
分析化学实验 碱度的测定 实验报告
实验报告姓名班级同组人项目碱度的测定课程分析化学学号一实验目的1掌握酸碱滴定法测定碱度的原理和方法2掌握碱度测定结果的计算3熟练滴…
-
分析化学实验 过氧化氢含量的测定 实验报告
实验报告姓名班级同组人项目过氧化氢含量的测定课程分析化学学号一实验目的1了解高锰酸钾标准溶液的配制方法和保存条件2掌握以Na2C2…
-
仪器分析实验教学总结
20xx-20xx学年第二学期仪器分析化学实验总结仪器分析法是测定物质化学组成、状态、结构的重要方法,也是监测物理、化学等过程的重…