SnSmOx-共沉淀法制备-实验报告
共沉淀法制备Sn-Sm-Ox复合氧化物催化剂
姓名:
一.实验目的/原理
1. 纯Sm2O3样品制备:将Sm2O3溶于15%的硝酸制成Sm(NO3)3饱和溶液,在磁力搅拌条件下缓慢加入NH3·H2O(浓氨水:水=1:1),抽滤分离得沉淀,经干燥、焙烧,获取纯Sm2O3样品。
2. Sn-Sm-Ox复合氧化物制备:将Sm2O3溶于15%的硝酸制成Pr(NO3)3饱和溶液,加入事先配置的SnCl4·5H2O饱和溶液,在磁力搅拌条件下缓慢加入NH3·H2O(浓氨水:水=1:1),抽滤分离得沉淀,经干燥、焙烧,获取所需复合氧化物。
二.实验仪器与试剂
仪器:电子天平、磁力搅拌器、抽滤瓶、真空泵、干燥箱、马弗炉、管式炉
药品:SnCl4·5H2O(白色)、Sm2O3(淡黄色)、68%的浓硝酸、浓NH3·H2O、AgNO3
三.实验步骤
1. 配制溶液:取ax mol SnCl4·5H2O固体置于250 ml烧杯中,加蒸馏水之恰好溶解。同样取0.5x mol Sm2O3溶于15%的HNO3溶液,搅拌均匀,形成饱和Sm(NO3)3,溶液呈现淡黄色半透明溶液。所得两种溶液分别记有a、b。
2. 纯Sm2O3样品制备:
将Sm2O3溶于15%的硝酸制成Sm(NO3)3饱和溶液,在磁力搅拌条件下缓慢加入NH3?H2O(浓氨水:水=1:1),抽滤分离得沉淀,经干燥、焙烧,得纯Sm2O3样品。
3. Sn-Sm-Ox复合氧化物制备:
1) 共沉淀:将溶解好的a 中缓慢加入b 溶液,形成澄清半透明状淡黄色溶液,将盛有混合溶液的烧杯于磁力搅拌器上搅拌5分钟后,逐滴加入稀释后的NH3·H2O,有白色絮状沉淀生成;继续滴加NH3·H2O,澄清溶液逐渐变浑浊,形成白色悬浮液。随着NH3·H2O的加入悬浊液渐渐变成粘稠状,在瞬间达最大粘度的时候,即到达该溶液NH3·H2O滴定的等电点。此时继续滴加NH3·H2O。直至在上层清液中加入微量NH3·H2O不产生沉淀,停止加NH3·H2O。放通风厨里静置数小时,抽滤。
2) 抽滤:将所得沉淀转移到抽滤瓶中进行真空抽滤。得到淡绿色滤饼。
3) 洗涤:用去离子水将滤饼洗涤数次,用AgNO3检测滤液,直至无Cl-存在,可证明该过程洗涤完全。
4) 干燥:将洗涤后沉淀放入真空干燥箱内,在100 °C下干燥数小时,干燥完全后,放在电子天平秤称重。
5) 焙烧:把干燥后的沉淀分成三等份,分别置于600 °C、800 °C、1000 °C下焙烧6h,称量。
四.实验结果和数据处理
1. 实验前相关计算
1. 考虑到制备过程中存在损耗,纯Sm2O3样品制备4 g,复合氧化物制备8 g。
已知:M(Sm2O3) = 348.8 g/mol, M(SnO2) = 150.69 g/mol,M(SnCl4·5H2O)= 350.58 g/mol,M [Sm (NO3)3·6H2O]= 444.4g/mol
设需制备复合氧化物Sn/Sm=a mol, Sm为x mol
348.8*0.5x+150.69ax=8 得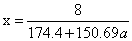
浓硝酸用量
氨水用量约为: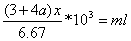
所需药品用量计算如下:
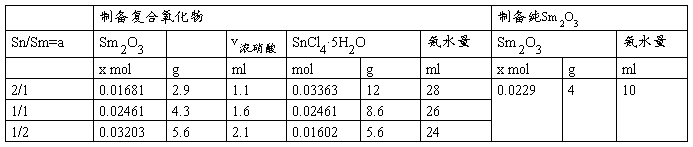
共沉淀法所得的所有样品统计:

第二篇:共沉淀法制备粉体




主要内容
?1.粉体的制备现状
?2.共沉淀法制备粉体?3.影响沉淀的因素
?4.共沉淀法制备粉体的优缺点?5.粉体的团聚
?6.总结
一、粉体的制备现状
?主要有化学方法(沉淀法、醇盐法、溶胶凝胶法、水热合成法等)和物理方法(机械粉碎法、构筑法)。
?采用化学方法制备的粉体纯度高、粒度可控,均匀性好,颗粒微细,并可以实现颗粒在分子级水平上的复合均匀。
粉体的一些制备方法
固相法液相法气相法机械粉碎法
超声波粉碎法
热分解法
爆炸法沉淀法,醇盐法溶胶凝胶法水热法喷雾干燥法
冷冻干燥法
水解反应法
化学凝聚法气相化学反应法(CVD)真空蒸发法(PVD油面蒸发法等离子体法蒸发法
二、共沉淀法制备粉体
?共沉淀法定义:
共沉淀法是指在溶液中含有两种或多种阳离子,它们以均相存在于溶液中,加入沉淀剂,经沉淀反应后,可得到各种成分均一的沉淀,再将沉淀物进行干燥或锻烧,从而制得高纯微细的粉体材料。?它是制备含有两种或两种以上金属元素的复合氧化物超细粉体的重要方法。
共沉淀法的分类
1.单相共沉淀:沉淀物为单一化合物或单相固溶体。
2.混合物共沉淀:沉淀产物为混合物
沉淀原理
?沉淀法也称溶解度法。
?基本原理:根据各种物质的结构差异来改变溶液的某些性质(如:pH、极性、离子强度、金属离子等),从而使抽提液中有效成分的溶解度发生变化。
?就是在溶解有各种成份离子的电解质溶液中添加合适的沉淀剂,反应生成组成均匀的沉淀,沉淀热分解得到高纯微细的粉体材料。

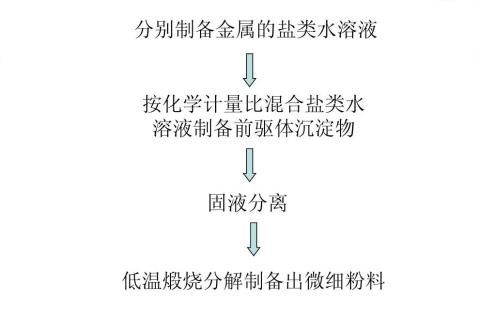
以NH4HCO3为沉淀剂通过共沉淀法制备
2Y-TZP纳米粉体
?以NH4HCO3,ZrOCl2?9H2O和Y(NO3)3为原料,在乙醇溶液中通过共沉淀法制备
2Y-TZP纳米粉体。在沉淀过程中,NH4HCO3和ZrOCl2通过两步反应生成(NH4)3ZrOH(CO3)3-2H2O沉淀。
?首先NH4HCO3和ZrOCl2反应生成Zr(OH)4,?ZrOCl2+2NH4HCOZr(OH)4+2NH4Cl+2CO2+H2O?其后Zr(OH)4和NH4HCO3进一步反应生成(NH4)3ZrOH(CO3)3·2H2O,
?Zr(OH)4+3NH4(NH4)3ZrOH(CO3)3·2H2O
?(NH4)3ZrOH(CO3)3·2H2O不稳定,在130℃即可分解生成ZrO2,并放出氨气、水和二氧化碳,沉淀产物经300和450℃煅烧后得到的2Y-TZP粉体颗粒尺寸细小,不存在大的硬团聚,具有良好的烧结性,在1225℃即可实现高度致密化。

三、影响沉淀的因素
?1.沉淀溶液的浓度
沉淀溶液的浓度会影响沉淀的粒度、晶形、收率、纯度及表面性质。通常情况下,相对稀的沉淀溶液,由于有较低的成核速度,容易获得粒度较大、晶形较为完整、纯度及表面性质较高的晶形沉淀,但其收率要低一些,这适于单纯追求产品的化学纯度的情况;反之,如果成核速度太低,那么生成的颗粒数就少,单个颗粒的粒度就会变大,这对于微细粉体材料的制备是不利的,因此,实际生产中应根据产品性能的不同要求,控制适宜的沉淀液浓度,在一定程度上控制成核速度和生长速度。
?2.合成温度
沉淀的合成温度也会影响到沉淀的粒度、晶形、收率、纯度及表面性质。在热溶液中,沉淀的溶解度一般都比较大,过饱和度相对较低,从而使得沉淀的成核速度减慢,有利于晶核的长大,得到的沉淀比较紧密,便于沉降和洗涤;沉淀在热溶液中的吸附作用要小一些,有利于纯度的提高。在制备不同的沉淀物质时,由于追求的理化性能不同,具体采用的温度应视试验结果而定。例如:在合成时如果温度太高,产品会分解;在采用易分解、易挥发的沉淀剂时,温度太高会增加原料的损失。
?3.沉淀剂
沉淀剂的选择应考虑产品质量、工艺、产率、原料来源及成本、环境污染和安全性等问题。在工艺允许的情况下,应该选用溶解度较大、选择性较高、副产物影响较小的沉淀剂,也便易于除去多余的沉淀剂、减少吸附和副反应的发生。例如:在生产碳酸盐沉淀产品时,可选择的沉淀剂有Na2CO3、NaHCO3 NH4HCO3和其他多种可溶性碳酸盐,但一般以
NH4HCO3为好,因为它的溶解度大、易洗涤、副产物易挥发、污染也较小,而且原料来源广泛、价格也低。
?沉淀剂的选择主要有四个因素:
①沉淀剂与载体生成的共沉淀化合物溶解度要小,以求对欲分离成分沉淀完全;
②对杂质的载带少,净化系数高(相对);③沉淀性能好,易于固液分离;
④有利于后续分离操作和制源测量。
?为使沉淀完全,加入的沉淀剂往往都是过量的,但也不能加的过多,过量的沉淀剂可能会导致生成易溶络合物,而使效果适得其反。
?4.沉淀剂的加入方式及速度
沉淀剂的加入方式及速度均会影响沉淀的各种理化性能。沉淀剂若分散加入,而且加料的速度较慢,同时进行搅拌,可避免溶液局部过浓而形成大量晶核,有利于制备纯度较高、大颗粒的晶形沉淀。
?5.加料顺序
加料方式分正加、反加、并加三种。生产中的“正加”是指将金属盐类先放于反应器中,再加入沉淀剂;反之为“反加”;而把含沉淀物阴、阳离子的溶液同时按比例加入到反应器的方法,称为“并加”。加料顺序与沉淀物吸附哪种杂质以及沉淀物的均匀性有密切的关系。“正加”方式的沉淀主要吸附原料金属盐的阴离子杂质;且在中和沉淀时,先、后生成的沉淀,其所处的环境PH值不同,得到的沉淀产品均匀性差。“反加”方式主要吸附沉淀的阴离子杂质;若是中和填充沉淀时,在整个沉淀过程占卜PH值变化很小,产品均匀性较好。“并加”方式可避免优秀作品溶液的局部过浓,沉淀过程较为稳定,且吸附杂质较小,从而可得到理化性能较好的产品。在实际生产中应视产品的具体要求而定。
?6.沉淀的陈化
沉淀完全后,让初生成的沉淀与母液一起放置一段时间,这个过程称为“陈化”。陈化过程中,因小颗粒沉淀的比表面积大,表面能也大;相同量大颗粒沉淀的比表面积较小,表面能就小,体系的变化有从高能量到低能量的自发趋势,因此小颗粒沉淀会逐渐溶解,大颗粒沉淀可慢慢再长大。其次,从沉淀的溶解度来看,当体系中大、小颗粒共存时,若溶液相对于大颗粒沉淀是饱和的,那么对小颗粒沉淀就不饱和,因此小颗粒沉淀溶解,而大颗粒沉淀会长大,使沉淀颗粒表面完整,减少吸湿和结块,提高沉淀的储存和使用性能。陈化过程由于小颗粒的溶解,减少了杂质的吸附和包裹夹带,起到所谓局部重结晶的作用,可以提高沉淀产品的纯度。陈化时的条件,如时间和温度等也会影响沉淀的性能,因此,应该根据产品的具体要求而确定。在实际生产中,必须注意的是陈化的时间如果超过了一定的范围就可能会引起后沉淀,反而使产品的纯度下降。
四、共沉淀法的优缺点
?优点:
??共沉淀法是所有制备粉体的湿化学方法中, 工艺最简单、成本最低并且最终能制备出优良性能的粉体的方法。其优势在于成本低、工艺简单、可重复性好, 有利于工业化, 制备条件易于控制、合成周期短等优点,已成为目前研究最多的制备方法。
??并且通过溶液中的各种化学反应直接得到化学成分均一的纳米粉体材料,容易制备粒度小而且分布均匀的纳米粉体材
但存在如下缺点:
①所得沉淀物中杂质的含量及配比难以精确控制。
②在共沉淀制备粉体的过程中从共沉淀、晶粒长大到沉淀的漂洗、干燥、煅烧的每一阶段均可能导致颗粒长大及团聚体的形成;
五、粉体的团聚
由于粉体的颗粒细小,具有极大的比表面,从热力学原理可知,这种粉体具有降低其比表面的趋向,即细小颗粒容易互相粘连合并,亦即容易形成团聚体。超细粉体中的颗粒一旦形成了团聚体,其超细的特点就会消失。因此用化学方法合成超细粉体时应该特别注意如何避免形成团聚体,如果团聚不可避免,则应设法控制团聚过程,以减轻团聚的程度或减小团聚体的强度,使其在其后的工艺处理中容易被破坏。
?粉体团聚一般包括软团聚和硬团聚。
?软团聚是由于随着粉体颗粒尺寸的减小,颗粒之间的范德华力、静电吸引力和毛细管力等增强并相互作用形成。
?团聚体强度低,易破碎,一般通过超声等物理机械手段可以使其瓦解而解聚。
?硬团聚颗粒间除了存在范德华力和库仑力外,还存在着化学键作用,是由于化学结合的-OH基团间的氢键作用形成桥氧键,颗粒之间的桥氧键相互作用而形成。
?团聚体不易分散也不易破碎,在制备陶瓷时会得到气孔分布不均匀的低密度坯体,且硬团聚还会发生优先烧结,从而使材料的品质恶化。
?抑制团聚的方法包括:
??选择合理的反应条件(如pH 值、反应浓度和温度等);
??粉体合成过程中,分散剂与表面活性剂的使用;??选择最佳的煅烧条件或采用特殊的工艺,如利用微波加热不需传热、能量利用率高等特点来取代传统高温电炉。
?团集体形成后消除团聚的方法有:沉积或沉降、研磨和超声波处理、加入分散剂等。
六、总结
?主要讲了粉体制备中的共沉淀法的定义、工艺流程、影响因素、优缺点,以及粉体制备过程中出现的粉体团聚问题和解决方法。
That's all.Thank you!
-
反应时实验报告
摘要本实验以华东师范大学心理与认知科学学院2年级学生1人为被试本实验研究的是视觉简单反应时视觉选择反应时和视觉辨别反应时三种不同的…
-
加法反应时实验报告
加法反应时实验报告实验目的1验证斯滕勃格Sternmberg的加法反应时实验实验器材1JGWB型实验台速示器单元计时计数器单元手键…
-
简单、选择与辨别反应时的实验报告
简单选择与辨别反应时的实验报告专业应用心理学年级09应用心理学姓名郑卫荣学号SY0910148专业应用心理学年级09应用心理学姓名…
-
注意和反应时:反应时ABC 实验报告
实验心理学实验实验名称注意和反应时反应时班级13应用心理1班姓名王璐学号20xx326670020实验日期20xx年11月24号指…
-
减法反应时实验报告
减法反应时实验报告20xx0929215725转载标签唐德斯反应时间辨别时间主试杂谈摘要减法技术是认知心理学中比较常用的一种方法它…