旋光法测定蔗糖转化反应的速率常数-实验报告
旋光法测定蔗糖转化反应的速率常数
一、目的要求
1、 测定蔗糖转化反应的速率常数和半衰期。
2、 了解该反应的反应物浓度与旋光度之间的关系。
3、 了解旋光仪的基本原理,掌握旋光仪的正确使用方法。
二、仪器与试剂
WZZ-2B自动旋光仪,样品管,秒表,恒温槽,量筒,锥形瓶,蔗糖水溶液,盐酸水溶液
三、实验原理
蔗糖在水中水解成葡萄糖与果糖的反应为
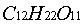 (蔗糖)+
(蔗糖)+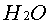
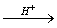
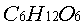 (葡萄糖)+
(葡萄糖)+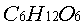 (果糖)这是个二级反应。为使水解反应加速,反应常常以H+为催化剂。由于在较稀的蔗糖溶液中,水是大量的,反应达终点时,虽然有部分水分子参加了反应,但与溶质(蔗糖)浓度相比可以认为它的浓度没有改变。因此,在一定的酸度下,反应速度只与蔗糖的浓度有关,所以该反应可视为一级反应(动力学中称之为准一级反应)。该反应的速度方程为:
(果糖)这是个二级反应。为使水解反应加速,反应常常以H+为催化剂。由于在较稀的蔗糖溶液中,水是大量的,反应达终点时,虽然有部分水分子参加了反应,但与溶质(蔗糖)浓度相比可以认为它的浓度没有改变。因此,在一定的酸度下,反应速度只与蔗糖的浓度有关,所以该反应可视为一级反应(动力学中称之为准一级反应)。该反应的速度方程为:
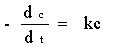 积分之后得:
积分之后得: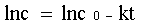
其中C为蔗糖溶液的浓度,k为蔗糖在该条件下的水解反应速度常数
该反应的半衰期与k的关系为: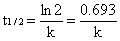
蔗糖、葡萄糖、果糖都是旋光性的物质,即都能使透过它们的偏振光的振动面旋转一定的角度,称为旋光度,以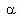 表示。其中蔗糖、葡萄糖能使偏振光的振动面按顺时针方向旋转,为右旋光性物质,旋光度为正值。而果糖能使偏振光的振动面按逆时针方向旋转,为左旋光性物质,旋光度为负值。
表示。其中蔗糖、葡萄糖能使偏振光的振动面按顺时针方向旋转,为右旋光性物质,旋光度为正值。而果糖能使偏振光的振动面按逆时针方向旋转,为左旋光性物质,旋光度为负值。
反应进程中,溶液的旋光度变化情况如下:
当反应开始时,t=0,溶液只有蔗糖的右旋,旋光度为正值,随着反应的进行,蔗糖溶液减少,葡萄糖和果糖浓度增大,由于果糖的左旋能力强于葡萄糖的右旋。整体来说,溶液的旋光度随着时间而减少。当反应进行完全时,蔗糖溶液为零,溶液中只有葡萄糖和果糖,这时,溶液的旋光度为负值。可见,反应过程中物质浓度的变化可以用旋光度来代替表示。

 (α
(α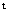 —α
—α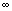 ) =
) =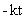 +
+ (α
(α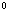 —α
—α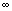 )
)
从上式可见,以 (α
(α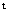 —α
—α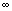 )对 t作图,可得一直线,由直线斜率可求得速度常数k。
)对 t作图,可得一直线,由直线斜率可求得速度常数k。
四、实验步骤
1、旋光仪的零点校正 开启旋光仪,按下“光源”和“测量”,预热10分钟。蒸馏水为非旋光物质,可以用来校正旋光仪的零点。校正时候先洗净样品管,将管的一端加上盖子,并由另一端加满蒸馏水,盖上玻璃盖和套盖,玻璃片紧挨着旋光管,管内不应该有气泡。用吸滤纸把管外的水擦干,放入旋光仪的光路中,之后清零。
2、反应过程的旋光度的测定 把恒温水浴调到50℃。取出锥形瓶蔗糖溶液25ml,盐酸溶液25ml,把盐酸倒入蔗糖中,混合均匀。用该溶液润洗旋光仪之后,加入该溶液进入旋光管,测量各时间的旋光度。从旋光度最大时开始记录,每隔五分钟记录一次,记录40分钟。
3、α 的测量 把混合液放入50℃恒温水浴中加热至四十分钟之后,取出冷却到室内温度,润洗旋光管,测量旋光度。
的测量 把混合液放入50℃恒温水浴中加热至四十分钟之后,取出冷却到室内温度,润洗旋光管,测量旋光度。
五、实验数据记录与处理
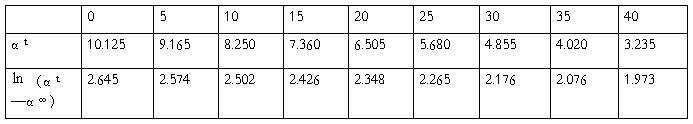
α∞的平均值为 :-3.955
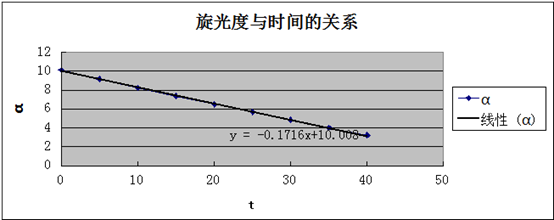
旋光度与时间的关系
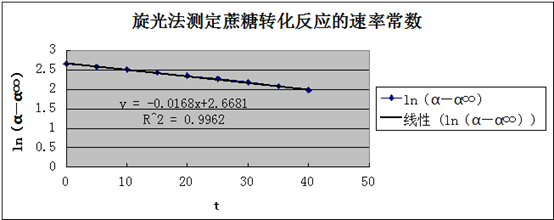
旋光法测定蔗糖转化反应的速率常数
由Ln(α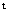 -α∞)~t直线y = -0.0168x + 2.6618可求得:
-α∞)~t直线y = -0.0168x + 2.6618可求得:
蔗糖的转化反应速率K=0.0168
半衰期:t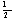 =
= 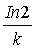 =
=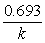 =41.25min
=41.25min
七、思考题
1.实验中,为什么用蒸馏水来校正旋光仪的零点? 在蔗糖转化反应过程中,所测的旋光度α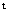 是否需要零点校正?为什么?
是否需要零点校正?为什么?
答:因为蒸馏水无旋光性,可以消除旋光仪的系统误差;实验中,所测的旋光度α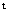 可以不校正零点,因α
可以不校正零点,因α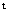 -α∞ ,已将系统的零点误差消除掉。
-α∞ ,已将系统的零点误差消除掉。
2.蔗糖溶液为什么可粗略配制?
答:初始浓度对于数据影响不大。速率常数K与温度和催化剂的浓度有关,实验 测定反应速率常数k,以 (α
(α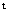 —α
—α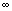 )对t作图,由所得直线的斜率求出反应速率常数k,与初始浓度无关
)对t作图,由所得直线的斜率求出反应速率常数k,与初始浓度无关
3.蔗糖的转化速度和哪些因素有关?
答:温度,催化剂得浓度、种类等。
4.溶液的旋光度与哪些因素有关?
答:溶液的旋光度与溶液中所含旋光物质的种类、浓度、溶剂的性质、液层厚度、 光源波长及温度等因素有关。
5. 反应开始时,为什么将盐酸溶液倒入蔗糖溶液中,而不是相反?
答:因为盐酸是作为催化剂。若把蔗糖倒入盐酸当中,会导致反应液中盐酸的浓度过大,使得蔗糖在还没检测的时候就反应完全,使实验存在很大误差。若那盐酸倒入蔗糖溶液中,可以避免这种事情发生,最大地降低了误差的出现。
八、 实验结果与讨论:
本实验测得蔗糖的转化反应速率K=0.0168,半衰期为41.25min,测得的旋光度变化趋势是从大到小,最终出现负值。证明果糖的旋光度为负值,并在数值上大于葡萄糖的旋光度值。而最终的旋光度几乎不变,这说明反应几乎已经达到极限。
通过该实验,了解该反应的反应物浓度与旋光度之间的关系,同时明白旋光仪的基本原理,掌握旋光仪的正确使用方法。
第二篇:蔗糖水解反应速率常数的测定__实验八
 宁 波 工 程 学 院
宁 波 工 程 学 院
物理化学实验报告
专业班级 化工12-1班 姓名 李威威 序号 12402010128
同组姓名 胡明远 指导老师李秋平、付志强 实验日期 2014.5.5
实验名称 实验八 蔗糖水解反应速率常数的测定
一、实验目的
1. 了解蔗糖水解反应体系中各物质浓度与旋光度之间的关系。
2. 测定蔗糖水解反应的速率常数和半衰期。
3.了解旋光仪的基本原理,掌握其正确的操作技术。
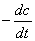 二、实验原理
二、实验原理
反应速率只与某反应物浓度的一次方成正比的反应称为一级反应,速率方程可由下式表示:
—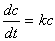
式中c为时间t时的反应物浓度,k为反应速率常数。
积分可得: lnc=-kt + lnc0
c0为反应开始时反应物浓度。
当c= c0/2时,对应t可用t1/2表示,称为反应的半衰期,即反应物浓度反应掉一半所用时间,得一级反应的半衰期为: t1/2=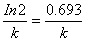
蔗糖在水中转化成葡萄糖与果糖,其反应为:
C12H22O11 + H2O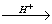 C6H12O6 + C6H12O6
C6H12O6 + C6H12O6
(蔗糖) (葡萄糖) (果糖)
它属于二级反应,在纯水中此反应的速率极慢,通常需要在H+离子催化作用下进行。由于反应时水大量存在,尽管有部分水分子参与反应,仍可近似地认为整个反应过程中水的浓度是恒定的,而且H+是催化剂,其浓度也保持不变。因此蔗糖转化反应可看作为一级反应。
蔗糖及其转化产物,都具有旋光性,而且它们的旋光能力不同,故可以利用体系在反应进程中旋光度的变化来度量反应进程。
测量物质旋光度所用的仪器称为旋光仪。溶液的旋光度与溶液中所含旋光物质的旋光能力,溶剂性质,溶液浓度,样品管长度及温度等均有关系。当其它条件均固定时,旋光度α与反应物浓度c呈线性关系,即
α=Kc
式中比例常数K与物质旋光能力,溶剂性质,样品管长度,温度等有关。
物质的旋光能力用比旋光度来度量,比旋光度用下式表示:
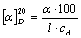
式中“20”表示实验时温度为20℃,D是指用纳灯光源D线的波长(即589毫微米),α为测得的旋光度,l为样品管长度(dm),cA为浓度(g/100mL)。
作为反应物的蔗糖是右旋性物质,其比旋光度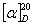 =66.6°;生成物中葡萄糖也是右旋性物质,其比旋光度
=66.6°;生成物中葡萄糖也是右旋性物质,其比旋光度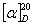 =52.5°,但果糖是左旋性物质,其比旋光度
=52.5°,但果糖是左旋性物质,其比旋光度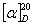 =-91.9°。由于生成物中果糖的左旋性比葡萄糖右旋性大,所以生成物呈左旋性质。因此随着反应的进行,体系的右旋角不断减小,反应至某一瞬间,体系的旋光度可恰好等于零,而后就变成左旋,直至蔗糖完全转化,这时左旋角达到最大值α∞。
=-91.9°。由于生成物中果糖的左旋性比葡萄糖右旋性大,所以生成物呈左旋性质。因此随着反应的进行,体系的右旋角不断减小,反应至某一瞬间,体系的旋光度可恰好等于零,而后就变成左旋,直至蔗糖完全转化,这时左旋角达到最大值α∞。
设最初系统的旋光度为 α0=K反cA,0 (t=0,蔗糖尚未水解)(1)
最终系统的旋光度为 α∞=K生cA,0 (t=∞,蔗糖已完全水解)(2)
当时间为t时,蔗糖浓度为cA,此时旋光度为αt
αt= K反cA+ K生(cA,0-cA) (3)
联立(1)、(2)、(3)式可得:
cA,0=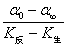 =K′(α0-α∞) (4)
=K′(α0-α∞) (4)
cA=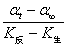 = K′(αt-α∞) (5)将(4)、(5)两式代入速率方程即得:
= K′(αt-α∞) (5)将(4)、(5)两式代入速率方程即得:
ln(αt-α∞)=-kt+ln(α0-α∞)
我们以ln(αt-α∞)对t作图可得一直线,从直线的斜率可求得反应速率常数k,进一步也可求算出t1/2。
三、实验仪器、试剂
仪器:旋光仪,停表,恒温水浴一套,移液管(50mL),磨口锥形瓶(100mL),烧杯(100mL),台秤,洗耳球
试剂:蔗糖(AR),盐酸 (3mol/L,AR)
四、实验步骤
(一)旋光仪的校正
1.了解旋光仪的构造、原理,掌握其使用方法(见附录)。
2.开启水浴恒温水槽的电源开关,并将水浴恒温槽的温度控制在60℃。
3.蒸馏水为非旋光性物质,可用来校正仪器的零点(即α=0时,仪器对应的刻度)。洗净样品管,将样品管一端盖子打开,转入去离子水,然后盖上玻璃片,此时管内不应有空气泡存在,再旋上套盖,使玻璃片紧贴旋光管,勿使漏水。但必须注意旋紧套盖时,不能用力过猛,以免压碎玻璃片,用滤纸擦干样品管,再用擦镜纸将样品管两端的玻璃片擦干净。放入旋光仪,打开电源,预热5-10min,钠灯发光正常。调目镜聚焦,使视野清晰;调检偏镜至三分视野暗度相等为止,记录游标(右边)刻度为检偏镜旋角,记录仪器零点。读数注意0度以下的实际旋光度(读数-180)。读数三次取平均值,即为零点,用来校正仪器的系统误差。
(二)测定
1、 配制蔗糖溶液:用天平称取10克蔗糖放入烧杯中,加蒸馏水溶解后转移到50ml容量瓶中,稀释至刻度。
2、用50ml移液管移取50mlHCL溶液放入蔗糖水溶液,边放边振荡,当HCL溶液放出一半时按下秒表开始计时(注意:秒表一经启动,勿停直至实验完毕)。迅速用反应混合液将样品管洗涤三次后,将反应混合液装满样品管,擦净后放入旋光仪,测定规定时间的旋光度。测得第一个数据时间应该为反应开始的前三分钟内。测量时先将三分视场调节到全暗,再记录时间(注意时间要记录准确,以实际反应时间为准),后读数。分别记录5min、10min、15min、20min、25min、30min、40min、50min、60min的旋光度。
3、α∞的测量:测定过程中,可将剩余的反应混合物放入60℃恒温槽中加热30min,使反应充分后,冷却至室温后测定体系的旋光度,连续读数三次平均值。
由于反应液的酸度很大,因此样品管一定要擦干净后才能放入旋光仪内,以免酸液腐蚀旋光仪,实验结束后必须洗净样品管。
五、数据记录与处理
实验温度: 24.4℃ ;HCl浓度: 3mol/L 零点:0.000 α∞ : -3.15 。
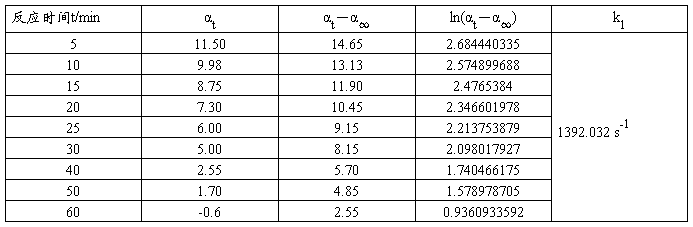
以ln(αt—α∞)对t作图,并由直线斜率求速率常数k1。
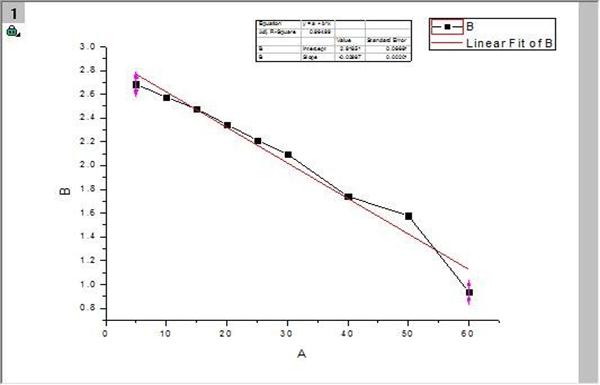
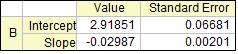
斜率=-0.02987,所以k1=0.02987 min -1=4.97833×10-4 s-1
t1/2= ln 2 /k1 =0.693 / k1 = 0.693 / .97833×10-4 =1392.032 s-1
六、结果与讨论
1、装样品时,旋光管管盖旋至不漏液体即可,不要用力过猛,以免压碎玻璃片。
2、在测定α∞时,通过加热使反应速度加快转化完全。但加热温度不要超过60℃。
大约60min后基本分解完全。
3、由于酸对仪器有腐蚀,操作时应特别注意,避免酸液滴漏到仪器上,实验结束后必须将旋光管洗净。
4、实验过程存在误差,比如仪器调节误差,读数误差,但误差在接受范围内。
-
实验报告蔗糖水解反应速率常数的测定
蔗糖水解反应速度常数的测定一实验目的1根据物质的光学性质研究蔗糖水解反应测定其反应速度常数2了解旋光仪的基本原理掌握使用方法3学习…
-
蔗糖水解反应速率常数的测定
宁波工程学院物理化学实验报告专业班级化工112姓名姚志杰序号114020xx235同组姓名田飞成金鹏指导老师付志强姚利辉实验日期2…
-
实验八蔗糖水解反应速率常数的测定
宁波工程学院物理化学实验报告实验名称实验八蔗糖水解反应速率常数的测定一实验目的1了解蔗糖水解反应体系中各物质浓度与旋光度之间的关系…
-
旋光法测定蔗糖转化反应的速率常数-实验报告
六旋光法测定蔗糖转化反应的速率常数一目的要求1测定蔗糖转化反应的速率常数和半衰期2了解该反应的反应物浓度与旋光度之间的关系3了解旋…
-
蔗糖水解反应速率常数的测定实验报告
蔗糖水解反应速率常数的测定一实验目的1根据物质的旋光性质研究蔗糖水解反应测定蔗糖转化反应的速率常数和半衰期2了解该反应的反应物浓度…
-
旋光法测定蔗糖转化反应的速率常数实验报告。。
旋光法测定蔗糖转化反应的速率常数一实验目的1了解反应的反应物浓度与旋光度之间的关系2了解旋光仪的基本原理掌握其基本使用方法3利用旋…
-
旋光法测定蔗糖转化反应的速率常数实验报告
旋光法测定蔗糖转化反应的速率常数实验报告一实验名称旋光法测定蔗糖转化反应的速率常数二实验目的1了解旋光仪的基本原理掌握旋光仪的正确…
-
旋光法测定蔗糖转化反应的速率常数实验报告
杭州师范大学学生实验报告实验名称最大泡压法测定溶液的表面张力一实验目的1掌握旋光仪的正确使用方法了解反应物浓度与旋光度之间的关系2…
-
旋光法测定蔗糖转化反应的速率常数实验报告
物理化学实验报告20xx年03月28日总评姓名学校陕西师范大学年级20xx级专业材料化学室温100大气压100kpa一实验名称旋光…
-
实验27用旋光仪测旋光性溶液的浓度
实验27用旋光仪测旋光性溶液的浓度实验目的1观察光的偏振现象和偏振光通过旋光物质后的旋光现象2了解旋光仪的结构原理学习测定旋光性溶…
-
旋光法测定蔗糖转化反应的速率常数-实验报告
六旋光法测定蔗糖转化反应的速率常数一目的要求1测定蔗糖转化反应的速率常数和半衰期2了解该反应的反应物浓度与旋光度之间的关系3了解旋…