旋光法测定蔗糖转化反应的速率常数实验报告
20##年 03 月 28 日 总评:
姓名: 学校: 陕西师范大学
年级: 2010级 专业: 材料化学
室温: 10.0℃ 大气压: 100kpa
一、实验名称:旋光法测定蔗糖转化反应的速率常数
二、实验目的:
1、了解反应的反应物浓度与旋光度之间的关系;
2、了解旋光仪的基本原理,掌握其基本使用方法;
3、利用旋光法测定蔗糖水解反应的速率常数与半衰期。
三、实验原理:
蔗糖在水中水解成葡萄糖的反应为:
C12H22O11+H2O→C6H12O6(葡萄糖)+C6H12O6(果糖)
为使水解反应加速,反应常数以H3O+为催化剂,故在酸性介质中进行水解反应中。在水大量存在的条件下,反应达终点时,虽有部分水分子参加反应,但与溶质浓度相比认为它的浓度没有改变,故此反应可视为一级反应,其动力学方程式为:
LnC=-kt+LnC0
式中:C为反应开始时蔗糖的浓度;C0为t时间时的蔗糖的浓度。当C=1/2 C0时,t可用t1/2表示,即为反应的半衰期。 t1/2=Ln2/k
上式说明一级反应的半衰期只决定于反应速率常数k,而与起始无关,这是一级反应的一个特点。蔗糖及其水解产物均为旋光物质,当反应进行时,如测定体系的旋光度的改变就可以量度反应的进程。而溶液的旋光度与溶液中所含旋光物质的种类、浓度、液层厚度、光源波长及反应温度等因素有关。
为了比较各种物质的旋光能力,引入比旋光度[α]这一概念,并表示为:
[α]D=α*100/(L*C)
式中:t为实验时温度;D为实验温度为20℃,所用钠灯光源D线,波长589nm,α为旋光度;L为液层厚度(dm);C为浓度(g*100mL-1),当其他条件不变时,即:
α= βC
β在一定条件下是一常数。
蔗糖[α]=66.5°,葡萄糖[α]=52.0°, 果糖[α]=-91.9°,式中整个反应过程中,旋光度由右旋向左旋变化(旋光度与浓度成正比,且溶液的旋光度为各组成旋光度之和——加和性),且当温度及测定条件一定时,其旋光度与反应物浓度有下列关系:
反应时间为0时: α0=β反C0
反应时间为t时: αt=β反C+β生(C0-C)
反应时间为 ∞ 时: α∞=β生C0
式中α0、αt、α∞为反应时间为0、t、∞ 时的溶液的旋光度。
联立以上三式:
Ln(αt-α∞)= -kt + Ln(α0-α∞) 整理即为:Ln(αt-α∞) - Ln(α0-α∞)= - kt
由上式可以看出,以 Ln(αt-α∞) 对t 作图可得一直线,由截距可得到α0值,由直线斜率即可求得反应速度常数k。
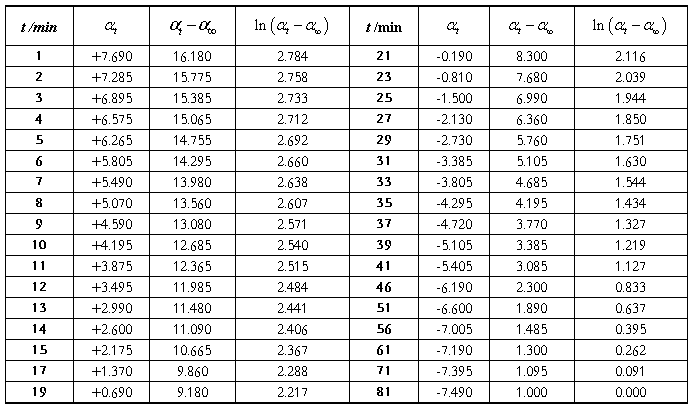
四、实验数据及处理:
1. 蔗糖浓度:C蔗糖= HCl浓度:C盐酸=
2. 完成下表: 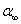 =
=
表1 蔗糖转化反应旋光度的测定结果(实验数据):
五、作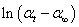 ~ t图,求出反应速率常数k及半衰期t1/2 :
~ t图,求出反应速率常数k及半衰期t1/2 :
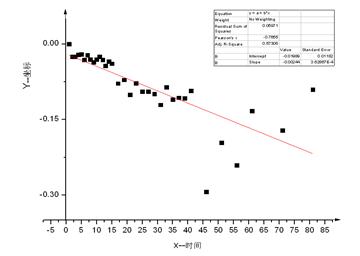
求算过程:
六、讨论思考:
1、配制蔗糖溶液时称量不够准确,对测量结果有否影响?
2、混合蔗糖溶液和盐酸溶液时,可否将蔗糖溶液加到盐酸溶液中去?为什么?
第二篇:旋光法测定蔗糖转化反应的速率常数实验报告
旋光法测定蔗糖转化反应的速率常数实验报告
一、实验名称:旋光法测定蔗糖转化反应的速率常数
二、实验目的
1、了解旋光仪的基本原理,掌握旋光仪的正确使用方法;
2、了解反应的反应物浓度与旋光度之间的关系;
3、测定蔗糖转化反应的速率常数。
三、实验原理
蔗糖在水中水解成葡萄糖的反应为:
C12H22O11+H20→ C6H12O6+C6H12O6
蔗糖 葡萄糖 果糖
为使水解反应加速,反应常以H3O+ 为催化剂,故在酸性介质中进行水解反应中。在水大量存在的条件下,反应达终点时,虽有部分水分子参加反应,但与溶质浓度相比认为它的浓度没有改变,故此反应可视为一级反应,其动力学方程式为:
lnC=-kt+lnC0 (1)
式中:C0为反应开始时蔗糖的浓度;C为t时间时的蔗糖的浓度。
当C=0.5C0时,t可用t1/2表示,即为反应的半衰期。
t1/2=ln2/k
上式说明一级反应的半衰期只决定于反应速率常数k,而与起始无关,这是一级反应的一个特点。
本实验利用该反应不同物质蔗比旋光度不同,通过跟踪体系旋光度变化来指示lnC与t的关系。在蔗糖水解反应中设β1、β2、β3分别为蔗糖、葡萄糖和果糖的旋光度与浓度的比例常数
C12H22O11(蔗糖)+H20→ C6H12O6 (葡萄糖)+C6H12O6 (果糖)
t=0 C0β1 0 0 α= C0β1
t=t Cβ1 (C-C0)β2 (C-C0)β3 αt=Cβ1+(C-C0)β2+(C-C0)β3
t=∞ 0 β2C0 β2C0 α∞=β2C0+ β2C0
由以上三式得:
ln(αt-α∞)=-kt+ln(α0-α∞)
由上式可以看出,以ln(αt-α∞) 对t 作图可得一直线,由直线斜率即可求得反应速度常数k 。
四、实验数据及处理:
1. 蔗糖浓度:0.3817 mol/L HCl浓度:2mol/L
2. 完成下表: =-1.913
=-1.913
表1 蔗糖转化反应旋光度的测定结果

五、作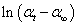 ~ t图,求出反应速率常数k及半衰期t1/2
~ t图,求出反应速率常数k及半衰期t1/2
求算过程:
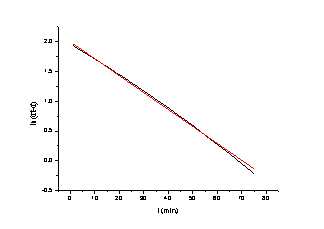
由计算机作图可得斜率=-0.02 既测得反应速率常数k=0.02
t1/2 =ln2/k=34.66min
六、讨论思考:
1.在测量蔗糖转化速率常数的,选用长的旋光管好?还是短的旋光管好?
答:选用较长的旋光管好。根据公式〔α〕=α×1000/Lc,在其它条件不变情况下,L越长,α越大,则α的相对测量误差越小。
2.如何根据蔗糖、葡萄糖和果糟的比旋光度计算α0和α∞?
答:α0=〔α蔗糖〕Dt℃L[蔗糖]0/100
α∞=〔α葡萄糖〕Dt℃L[葡萄糖]∞/100+〔α果糖〕Dt℃L[果糖]∞/100
式中:[α蔗糖]Dt℃,[α葡萄糖]Dt℃,[α果糖]Dt℃分别表示用钠黄光作光源在t℃时蔗糖、葡萄糖和果糖的比旋光度,L(用dm表示)为
旋光管的长度,[蔗糖]0为反应液中蔗糖的初始浓度,[葡萄糖]∞和[果糖]∞表示葡萄糖和果糖在反应完成时的浓度。
设t=20℃ L=2 dm [蔗糖]0=10g/100mL 则:
α0=66.6×2×10/100=13.32°
α∞=×2×10/100×(52.2-91.9)=-3.94°
3.在旋光度的测量中,为什么要对零点进行校正?可否用蒸馏水来进行
校正?在本实验中若不进行校正,对结果是否有影响?
答:若需要精确测量α的绝对值,则需要对仪器零点进行校正,因为仪器本身有一系统误差;水本身没有旋光性,故可用来校正仪器零
点。本实验测定k不需要对α进行零点校正,因为αt,α∞是在同一台仪器上测量,而结果是以ln(αt-α∞)对t作图求得的。
4.记录反应开始的时间晚了一些,是否影响k值的测定?为什么? 答:不会影响;因为蔗糖转化反应对蔗糖为一级反应,本实验是
以ln(αt-α∞)对t作图求k,不需要α0的数值。
5.如何判断某一旋光物质是左旋还是右旋?
答:根据公式[α]t℃D=α×100/Lc,在其它条件不变的情况下,α与浓度成正比。配制若干不同浓度的溶液,测定其旋光度。即可判断。
6.配制蔗糖溶液时称量不够准确或实验所用蔗糖不纯对实验有什么影响?
答:此反应对蔗糖为一级反应,利用实验数据求k时不需要知道蔗糖的初始浓度。所以配溶液时可用粗天平称量。若蔗糖中的不纯物对
反应本身无影影响,则对实验结果也无影响。
-
实验报告蔗糖水解反应速率常数的测定
蔗糖水解反应速度常数的测定一实验目的1根据物质的光学性质研究蔗糖水解反应测定其反应速度常数2了解旋光仪的基本原理掌握使用方法3学习…
-
蔗糖水解反应速率常数的测定
宁波工程学院物理化学实验报告专业班级化工112姓名姚志杰序号114020xx235同组姓名田飞成金鹏指导老师付志强姚利辉实验日期2…
-
实验八蔗糖水解反应速率常数的测定
宁波工程学院物理化学实验报告实验名称实验八蔗糖水解反应速率常数的测定一实验目的1了解蔗糖水解反应体系中各物质浓度与旋光度之间的关系…
-
旋光法测定蔗糖转化反应的速率常数-实验报告
六旋光法测定蔗糖转化反应的速率常数一目的要求1测定蔗糖转化反应的速率常数和半衰期2了解该反应的反应物浓度与旋光度之间的关系3了解旋…
-
蔗糖水解反应速率常数的测定实验报告
蔗糖水解反应速率常数的测定一实验目的1根据物质的旋光性质研究蔗糖水解反应测定蔗糖转化反应的速率常数和半衰期2了解该反应的反应物浓度…
-
旋光法测定蔗糖转化反应的速率常数实验报告。。
旋光法测定蔗糖转化反应的速率常数一实验目的1了解反应的反应物浓度与旋光度之间的关系2了解旋光仪的基本原理掌握其基本使用方法3利用旋…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
实验报告模版(以蔗糖水解速率常数的测定为例)
实验三蔗糖水解速率常数的测定实验报告样式一实验目的1了解旋光仪的简单结构原理和测定旋光物质旋光度的原理正确掌握旋光仪的使用方法2根…
-
恒压过滤实验常数测定实验报告
恒一实验目的1掌握恒压过滤常数K通过单位过滤面积当量滤液量qe当量过滤时间e的测定方法加深Kqee的概念和影响因素的理解2学习滤饼…
-
恒压过滤实验常数测定实验报告
恒压过滤实验一实验目的1掌握恒压过滤常数K通过单位过滤面积当量滤液量qe当量过滤时间e的测定方法加深Kqee的概念和影响因素的理解…
-
旋光法测定蔗糖转化反应的速率常数-实验报告
旋光法测定蔗糖转化反应的速率常数一目的要求1测定蔗糖转化反应的速率常数和半衰期2了解该反应的反应物浓度与旋光度之间的关系3了解旋光…