植物组织培养综合实验报告
生物工程中游技术
综合实验
百合花的组织培养
——探究并比较不同部位诱导愈伤组织的生长情况
学院:生命科学学院
班级:生物工程101班
摘要:实验选取百合花的子房、花柱、花药、花丝和花茎为外植体, ;利用植物组织培养技术,探究百合花不同部位诱导愈伤组织的生长情况,并比较不同的植物生长素对百合花愈伤组织诱导分化影响的差异。
关键词: 百合 组织培养 生长素 愈伤组织
1 前言
百合(L ilium tenuim folium Fisch)为百合科百合属多年生球根花卉。我国约有47 种,占世界种数的51% ,其中的36个种、15个变种是我国特有的珍稀种类 。由于其花形独特、芳香宜人而深受人们的喜爱,成为近年来国内外市场热销的花卉种类之一。百合是通过杂交育种选育出来的,种子高度败育,传统的分球、扦插等繁育方式易使百合病毒积累、种性退化 。目前,国内为了降低生产成本,实现种球的自主繁育,进行组织培养与快速繁殖已十分必要。
最早关于百合组培的文章是Robb于1957年发表的,到现在关于百合组织培养的方法已有40多种 ,百合的许多组织和器官都可作为外植体,例如鳞片、根尖、叶片、子房、花柱、花托、花丝等。本实验选取百合花的子房、花柱、花药、花丝和花茎为外植体, 利用植物组织培养技术,探究百合花不同部位诱导愈伤组织的生长情况,并比较不同的植物生长素对百合花愈伤组织诱导分化影响的差异。
2 材料和方法
2.1 材料
2.11 外植体
百合花的子房、花柱、花药、花丝和花茎
2.1.2培养基
配方一:MS+6-BA3+NAA0.05+3%蔗糖+8g琼脂(1L,pH=5.8)
配方二: MS+6-BA1.5+NAA0.05+3%蔗糖+8g琼脂(1L,pH=5.8)
2.1.3试剂
蔗糖、琼脂、培养基母液(大量元素、微量元素、铁盐、有机附加物)
2.1.4仪器设备
高压灭菌锅、分析天平、果酱瓶、烧杯、量筒、培养皿、灭菌的滤纸、称量纸、玻璃棒、电炉、石棉网、移液瓶,剪刀,镊子,解剖刀、酒精灯、记号笔、标签纸、药匙等。
2.2 方法
2.2.1配制培养基
2.2.1.1计算:计算500mL培养基所需MS母液的吸取体积
配制500mL培养基的母液用量

2.2.1.2移液与溶化:取50mL小烧杯一只,用移液管按照上表分别吸取各母液装入该烧杯中。
取100mL烧杯,先用量筒量取100mL蒸馏水倒入烧杯中,用记号笔画好液位线,再将一半蒸馏水倒出。将剩下的蒸馏水全都倒入电炉中,待水沸腾后,再把称量好的琼脂、蔗糖、酵母提取物、活性炭依次加入,充分溶解后,再加入母液混合液,用蒸馏水冲洗盛过母液的烧杯三次,一并倒入电炉中。加热至沸腾后。将溶液倒入100mL烧杯中,冲洗电炉3次,加蒸馏水定容至设定的液位线。
2.2.1.3调节PH:用酸度计测定PH,用1mol/L HCl或1mol/L NaOH溶液将培养基PH调节至5.8
2.2.1.4分装:将溶化的培养基趁热分装于果酱瓶中,每瓶30mL,随即封口。每种培养基装3瓶果酱瓶。用记号笔注明培养基代号、日期、第几组。
2.2.2培养基及实验用具灭菌
将分装好的培养基及其他用报纸包好的实验用具(剪刀、镊子、解剖刀、装有滤纸的培养皿)及3瓶蒸馏水,置于121℃高压灭菌锅中灭菌。时间为15~20min。
2.2.3外植体的选择
选取百合花的子房、花柱、花药、花丝和花茎
2.2.4外植体表面消毒
将百合花的子房、花柱、花药、花丝和花茎用洗衣粉清洗干净,在清水下冲洗15min,然后在无菌条件下用75%酒精消毒15-30s,无菌水冲洗一次,再用0.1%HgCl2消毒5-8 min,无菌水冲洗三次。
2.2.5接种
在酒精灯上方,打开培养瓶口,把镊子和瓶口在火焰上灼烧一会,待镊子稍冷却后,夹取消毒后的外植体放入瓶中,使其与培养基充分接触,培养瓶口还要在酒精灯上灼烧一下,然后迅速盖上瓶盖。
2.2.6培养与观察
把接种完毕的培养瓶放在25℃的培养箱,光照培养。
每周一次生长情况和污染情况记录,并对比:
A、对比不同配方同种部位的生长情况
B、对比不同部位同种配方的生长情况
3 结果与分析
3.1 百合花不同部位培养的污染情况
对百合花不同部位进行接种培养,本次实验有两种培养配方,每种配方接种不同部位的外植体6-7瓶,每瓶接种2-3个外植体。其中
污染率(%)=(污染的材料数/总接种材料数)×100
诱导率(%)=(形成愈伤组织的材料数/总接种材料数)×100

分析:从上表可知,花药的污染率最高,其次是花茎、花丝,子房、花柱的污染率相对前面外植体较低,总体来说污染率较高,主要原因可能是在接种时操作技术不规范造成的污染:①接种过程中,没有及时对接种工具进行灭菌,应该每使用一段时间后沾乙醇灼烧一下灭菌;②接种时在讲话、打喷嚏也会造成材料及培养基的污染;③在接种时,手臂从培养基、无菌材料、无菌滤纸的上方经过,造成了污染;④在打开瓶盖时,没有灼烧一下瓶口,或者接种结束后没有灼烧瓶口再盖瓶盖,使瓶口上沾有微生物。部分外植体被污染可能是因为材料本身是带菌的,在接种之前没有对外植体清毒彻底。有些外植体是后期污染的,原因是手接触的瓶口,使得手中的微生物通过瓶口进入瓶中,造成材料或者培养基的污染。
3.2百合花不同部位在不同培养基下诱导愈伤组织的培养情况

实验原始图片如下:


图1 配方二花丝子房的生长情况 图2 配方一花丝的生长情况

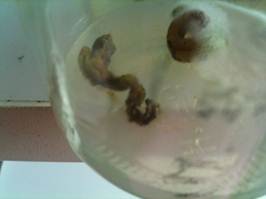
图3 配方一花柱的生长情况 图4 配方二花柱的生长情况


图5 配方二花药的生长情况 图6 配方一花茎的生长情况


图7 配方一子房的生长情况 图8 配方二子房的生长情况
分析:从上表可以看出,两种配方的愈伤组织诱导率很低,并且大部分外植体都死亡了;原因可能是:在切割时,增大了其的伤口面积,并使伤口在空气中暴露时间过长,或者培养的温度、pH造成了褐变。从图中可以看到,子房的诱导率最高,花茎、花丝、花药、花柱的诱导率都较低,总体来说诱导率很低,其中花柱的诱导率为零。由于两种培养基中长出的愈伤组织较少,无法比较哪种培养基更有利于诱导杜鹃花不同部位的愈伤组织。
4 总结
本次实验是以百合花的子房、花柱、花药、花丝和花茎为外植体,探究百合花的不同部位诱导愈伤组织的生长情况,并观察和分析不同的生长素浓度对百合花愈伤组织诱导分化影响的差异。并在实验的过程中掌握植物快速繁殖的基本方法和过程和外植体愈伤组织诱导的方法及其培养的操作技术。经过为期几周的实验,得到的愈伤组织数较少,原因是污染率较高,且所设计的培养基配方不是最适诱导愈伤组织的配方,大部分的外植体死亡。
本次实验了解了无菌操作在整个实验中起着至关重要的作用,如果无菌操作技术不规范,就会造成外植体的污染,使实验结果不能较好的体现出来。本次实验中存在这不足的地方:比如对无菌操作的重要性的意识不强,没有严格进行无菌操作,导致材料的污染。
我们组的实验算失败了,无菌操作技术不够规范,导致外植体的污染率较高,使诱导愈伤组织的材料数减少。且愈伤组织的诱导率很低,较多的外植体死亡。并且无法达到实验目的,即无法探究百合花不同部位诱导愈伤组织的生长情况和比较不同的植物生长素对百合花愈伤组织诱导分化影响的差异。
最后,感谢老师在实验中提供的实验材料和仪器,以及在实验过程中给予我们的帮助和解答我们的疑问。
5 参考文献
[1] 刘丽敏,卢赛清,陈燕霞,杨美纯.百合花器官的组织培养.广西农业科学.2007 ,38(3)
[2] 姚连芳,周俊国,殷桂琴,郝梅,李江华. 百合组织培养试验研究[J]. 贵州农业科学. 1999(03)
[3] 蔡宣梅,郑伟文,黄建华,刘建,庄志鸿. 百合花丝组织培养试验[J]. 福建农业科技. 2001(06)
[4] 姜春华. 西伯利亚百合花丝组织培养研究[J]. 甘肃农业. 2008(08)
[5] 李敏,王俊. 百合鳞片离体培养的研究[J]. 北方园艺. 2008(02)
[6] 钟海丰,黄宇翔,钟淮钦,叶秀仙,黄敏玲. 新铁炮百合花器官组织培养研究 [J]. 福建农业学报. 2010(02)
[7] 李标,胡琼华,何显静. 紫斑百合的组织培养[J]. 云南大学学报(自然科学版). 2001(S1)
第二篇:植物组织培养——设计性实验报告
设计性实验报告
姓名 张繄一 学号 201001122466
专业生物科学 班级 师范一班
实验课程名称 植物组织培养
指导教师
开课学期 20##-2013(1)

-
植物组织培养实验报告
植物组织培养实验报告学院:生命科学技术学院班级:10生技植物班学号:XXX姓名:XXX植物组织培养实验报告一、实验目的1.掌握无菌…
-
植物组织培养综合性实验报告
本科学生综合性实验报告学号104120xx1姓名李胜美学院生命科学学院专业班级10应用生物教育B班实验课程名称胡萝卜肉质根愈伤组织…
-
植物组织培养实验报告
植物组织培养实验报告一实验目的让植物组织经过脱分化作用形成愈伤组织经过再分化作用愈伤组织又能重新分化为有结构的组织和器官最终形成完…
-
园林植物组织培养实验报告
GDOUB11112广东海洋大学学生实验报告书学生用表实验名称学院系学生姓名实验一农学院马经国专业课程名称园林园林工程管理班级课程…
-
植物组织培养实验报告
植物组织培养实验报告实验一母液的配置与保存一实验目的通过配置MS培养基母液掌握母液的配置和保存方法二实验原理配置培养基时为了使用方…
-
植物组织培养实验报告
植物组织培养实验报告学院:生命科学技术学院班级:10生技植物班学号:XXX姓名:XXX植物组织培养实验报告一、实验目的1.掌握无菌…
-
植物组织培养实验报告
植组织培养验报告班级学号20xx19xxxx姓名李鹏物实植物组织培养实验报告实验一植物组织培养母液的配制一实验目的1了解植物组织培…
-
植物组织培养综合性实验报告
本科学生综合性实验报告学号104120xx1姓名李胜美学院生命科学学院专业班级10应用生物教育B班实验课程名称胡萝卜肉质根愈伤组织…
-
植物组织培养实验报告
植物组织培养实验报告一实验目的让植物组织经过脱分化作用形成愈伤组织经过再分化作用愈伤组织又能重新分化为有结构的组织和器官最终形成完…
-
植物组织培养实验报告
植物组织培养实验报告实验一母液的配置与保存一实验目的通过配置MS培养基母液掌握母液的配置和保存方法二实验原理配置培养基时为了使用方…
-
植物组培实验个人总结
植物组培实验个人总结一、项目简介我们在实验中以植物为研究对象,通过对它们进行组织培养来观察植物的生长状况、激素对植物的促进作用、植…