实验七:卤素离子的分离及检出讨论报告
卤素离子的分离及检出讨论报告
完成日期:20xx年11月11日
作者:吴亦歌 刘春宏 刘树青 刘薇 徐璐颖 戴安婧
生命科学学院
指导老师:王睿博
一、 摘要
讨论了利用连续法进行氯离子、溴离子和碘离子的分离和检出时控制条件对实验结果的影响,设计了验证实验。总结了本实验所用分离方法,说明其原理和适用范围。
二、 前言
物质的分离、提纯和成分分析是化学学科的一个重要领域。在进行成分分析时,由于离子或分子间存在相互干扰的现象,因此在成分分析前,分离、检出就显得尤为重要。本次实验,我们小组就利用连续法进行氯离子、溴离子和碘离子的分离和检出时控制条件对实验结果的影响进行了讨论与研究,并总结了本实验中所用的分离方法,阐述其原理和适用范围。
三、 内容
㈠我们小组将题中所说的“条件”分为内部条件与外部条件(此处的分类只为了讨论方便,无严格界限),分别进行了总结归纳:
(1) 内部条件:
内部条件是指试验中试剂的浓度、纯度等,有:
? 混合液中溴离子、氯离子、碘离子的浓度的相对多少:
当溶液中氯离子过多时,在用氨水溶解氯化银时,可能会使少量的碘化银和溴化银溶解(氨水所加量过多导致溶解),导致分离不完全,对氯离子的检验造成一定干扰。(计算见下)
当溶液中碘离子远多于溴离子时,首先是将碘离子氧化为碘酸根所需氯水的量较大,可能无法完全转化,且使溴离子检出的现象不明显;溴离子过少,同上,将其转化溴单质后,溶在有机层中颜色不明显,导致漏检溴离子。
实际中,一部分同学在观察到碘单质溶于四氯化碳后,滴加很多滴氯水无法观察溴单质的颜色,在吸出部分碘的四氯化碳溶液后才成功观察到溴单质的橙色,这一事实说明了以上几点。
? 溶解氯化银时所加氨水的浓度:
本实验中,所加氨水浓度为2mol/L,此时仅氯化银溶于其中。那么,溴化银、碘化
银绝对不溶于氨水么?
对于反应
AgBr+2NH3*H2O=Ag(NH3)2Br+2H2O
它可以拆成
AgBr=Br- +Ag+ K1=5.35*10^-13 2NH3*H2O+ Ag+= 2H2O+ Ag(NH3)2+ K2=1.1*10^7 所以,对于溴化银溶于氨水的反应,其K=K1K2=5.89*10^-6
由于“溶解”的最低限度为0.01mol/L,因此,氨水的最低浓度约为17mol/L,而常温下氨水浓度可达约20mol/L。因此,若所用氨水浓度过大,可能将溴化银溶解,从而干扰氯离子的检出(碘化银溶度积过小,很难用氨水溶解)。
? 溶液的pH值
? 溴化银及碘化银见光分解
溴化银及碘化银有感光性,见光易分解,从而影响溴离子和碘离子的检出。如溴化银,其反应方程式为:
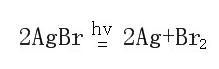
由于实验并未持续较长时间,本因素的作用较小。
(2) 外部条件:
指人为操作中的错误与误差。
? 所加硝酸银的量:
本实验为了将卤素离子以沉淀形式分离,利用硝酸银作沉淀剂。若硝酸银所加量过少,由于氯化银是最后沉淀,可能会导致氯离子沉淀不完全,难以检验,若氯离子很少,可能导致无氯化银生成,漏检氯离子。因此,硝酸银应适当多加一些,
? 所加锌粉的量,以及是否充分搅拌:
与硝酸银同理,若锌粉加少了,或搅拌不够完全,可能会使溶液中溴离子和碘离子过少,从而导致使其难检或漏检。
? 所加四氯化碳的量:
若四氯化碳加得过多,会稀释溶在其中的卤素单质,导致其颜色变浅,若卤素单质较少,可能难以分辨(特别是溴单质),导致漏检。
若四氯化碳加的少,有机层过浅,也会导致颜色难以辨认。
? 硝酸加入量及其浓度:
若硝酸过浓、加入量过多,可能将碘离子氧化,导致碘离子无法检出。已知: NO3-+4H++3e=NO+2H2O的标准电极电势为+0.96V,I2+2e=2I-的标准电极电势为+0.54V,所以一定浓度一定量的硝酸是可以将碘离子氧化的。
? 氯气通入量及其快慢:
若氯气通入得过多过快,可能使碘单质的四氯化碳溶液的紫色不易观察到,从而影响碘离子的检出;对溴离子的影响亦然。
? 实验环境的温度:
温度会影响化学反应速率的快慢(虽然溶液中的反应速率极快),且会影响难溶物的溶度积,可能会导致分离不完全。(影响极小)
㈡本实验所用的分离方法
? 硫化物沉淀分离法
一、硫化物沉淀分离的原理
能形成难溶硫化物沉淀的金属离子约有40余种,除碱金属和碱土金属的硫化物能溶于水外,重金属离子个分别在不同的酸度下 形成硫化物沉淀。因此在某些情况下,利用硫化
物进行沉淀分离还是有效的。 硫化物沉淀分离法所用的主要的沉淀剂H2S。H2S是二元弱酸,溶液中的[S2-]于溶液的酸度有关,随着[H+]的增加,[S2-]迅 速的降低。因此,控制溶液的pH值,即可控制[S2-],使不同溶解度的硫化物得以分离。
二、硫化物沉淀分离的适用范围
(1)硫化物的溶度积相差比较大的,通过控制溶液的酸度来控制硫离子浓度,而使金属离子相互分离。

(2)硫化物沉淀分离的选择性不高。
(在H2S饱和溶液中,)
(3)硫化物沉淀大多是胶体,共沉淀现象比较严重,甚至还存在继沉淀现象,且H2S是有毒气体,为了避免使用H2S带来的污染,可采用硫代乙酰胺均匀沉淀分离代替硫化氢沉淀分离,即通过在不同pH介质中加热分解硫代乙酰胺达到选择沉淀不同硫化物的目的。
在酸性溶液中: CH3CSNH2+2H2O+H+===CH3COOH+H2S+NH4+
在碱性溶液中: CH3CSNH2+3OH-===CH3COO-+S2-+NH3 +H2O
(4)适用于分离除去重金属(如Pb2+)
? 均相沉淀法 均相沉淀是指通过均相成核效应产生的沉淀。均相成核是指通过溶液本身的性质形成晶格,并让晶格自己缓慢长大的结晶方法。本实验中在分离检出硫离子时使用硫代乙酰胺,使其缓慢水解出硫离子,从而消除硫化物沉淀的共沉淀和继沉淀现象。(见上)
一、 均相沉淀法的原理 在均相溶液中,借助于适当的化学反应,有控制地产生为沉淀作用所需的离子,使在整个溶液中缓慢地析出密实而较重的无定形沉淀或大颗粒的晶态沉淀的过程。通常的沉淀操作是把一种合适的沉淀剂加到一个欲沉淀物质的溶液中,使之生成沉淀。这种沉淀方法,在相混的瞬间,在相混的地方,总不免有局部过浓现象,因此整个溶液不是到处均匀的。这种在不均匀溶液中进行沉淀所发生的局部过浓现象通常会给分析带来不良后果。例如,它会引起溶液中其他物质的共沉淀,使沉淀玷污;它会使晶态沉淀成为细小颗粒,给过滤和洗涤带来困难;而无定形沉淀则很蓬松,既难过滤洗涤,又很容易吸附杂质。
二、 均相沉淀法的适用范围
可克服某些溶液共沉淀、继沉淀严重的现象
? 萃取分离法
某些共价无机化合物,如I2, Br2, Cl2,GeCl4,AsI3,SnI4和OsO4 ,它们在水溶液中主要以分子形式存在,不带电荷,利用惰性有机溶剂可将其萃取出来。本实验通过萃取分离法将电离子与溴离子分离检出。
一、萃取分离法的原理 利用化合物在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使化合物从一种溶剂内转移到另外一种溶剂中。经过反复多次萃取,将绝大部分的化合物提取出来。萃取时如果各成分在两相溶剂中分配系数相差越大,则分离效率越高、如果在水提取液中的有效成分是亲脂性的物质,一般多用亲脂性有机溶剂,如苯、氯仿或乙醚进行两相萃取,如果有效成分是偏于亲水性的物质,在亲脂性溶剂中难溶解,就需要改用弱亲脂性的溶剂,例如乙酸乙酯、丁醇等。还可以在氯仿、乙醚中加入适量乙醇或甲醇以增大其亲水性。提取黄酮类成分时,多用乙酸乙脂和水的两相萃取。提取亲水性强的皂甙则多选用正丁醇、异戊醇和水作两相萃取。不过,一般有机溶剂亲水性越大,与水作两相萃取的效果就越不好,因为能使较多的亲水性杂质伴随而出,对有效成分进一步精制影响很大。
萃取率与分配比的关系

式中的co 和cw人别为溶质在有机相和水相中溶质的浓度,Vo和Vw分别为有机相和水相的体积。Vw/Vo也称为相比。当相比为1时

D 1
10 100 1000
E(%) 50 91
99 99.9
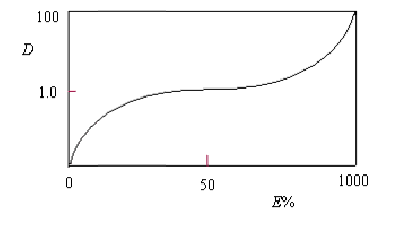
当E ≥ 99.9% 时,分析上称为完全萃取。若一次萃取要求萃取率达到99.9%,D值必须大于1000 。当相比为10 时,则要求D值大于10000 。
增大萃取率,可采用两种方法:
1)减小相比,即增大Vo 。这种方法实际意义不大。大量使用有机溶剂,既不经济又增加环境污染,此外,减小相比,达不到浓缩富集的作用。
2)增加萃取的次数。这是实际工作中常采用的方法。
二、萃取分离法的适用范围
1)溶质在互不相溶的溶剂中溶解度需要有较大差别。
2)两种溶剂一定要不相溶。
3)溶质不能与萃取剂反应。
四、 结论
? 在利用连续法进行氯离子、溴离子和碘离子的分离和检出时, 混合液中溴离子、氯
离子、碘离子的浓度的相对多少、溶解氯化银时所加氨水的浓度、所加硝酸银的量、所加锌粉的量,以及是否充分搅拌、所加四氯化碳的量、硝酸加入量及其浓度、氯气通入量及其快慢、实验环境的温度不同程度上影响了实验结果,其中混合液中溴离子、氯离子、碘离子的浓度的相对多少、所加四氯化碳的量和氯气通入量及其快慢起到较大作用。
? 本实验采用了硫化物沉淀分离法、均相沉淀法及萃取分离法,它们有各自的适用范
围。
五、 设计实验
设计实验方案:
实验目的:探究实验条件对连续法进行Cl-、Br-和I-的分离检出实验结果的影响
实验原理:分别改变三种离子的浓度、反应体系的温度,以及反应体系的PH值,与原实验进行对照,得出结论。
实验所需的试剂及仪器:
Cl-、Br-和I- 混合溶液,饱和NaCl溶液,饱和NaBr溶液,饱和KI溶液,2mol/L HNO3溶液,6mol/L HNO3溶液,0.1 mol/L AgNO3 溶液,2mol/L 氨水,锌粉,CCl4 ,去离子水
离心管,滴管,水浴锅,离心机,小试管
实验步骤:
1.Cl-浓度对实验结果的影响
1)分别取0ml、2ml、4ml、6ml、8ml饱和NaCl溶液与2ml Cl-、Br-和I- 混合溶液配成10ml 含有高浓度Cl-的Cl-、Br-和I- 混合溶液,从混合溶液中各取2ml 分别置于离心管中;
2)用2~3滴6mol/L HNO3溶液酸化,再加入0.1 mol/L AgNO3 溶液至沉淀完全,在水浴上加热2min使卤化银聚沉,离心后弃去清液,沉淀用去离子水洗一次;
3)向沉淀中加入2ml 2mol/L 氨水,搅拌1min,离心分离,将清液移至另一试管中,用6mol/L HNO3溶液酸化,检出Cl- ;
4)向3)中沉淀中加入1ml 左右的去离子水,并加入少量锌粉,水浴加热并充分搅拌,使沉淀颗粒均变为黑色,离心后取出清液,弃去残渣;
5)向清液中加入1ml CCl4 ,然后滴加氯水,边加边摇动,观察CCl4 层颜色的变化,记录CCl4 变为紫色和橙色的时间,进行比较;
6)分别做出检出Br-和I- 的时间—饱和NaCl溶液量的函数图象,观察是否有变化及其变化趋势。
2.Br-浓度对实验结果的影响
1)分别取0ml、2ml、4ml、6ml、8ml饱和NaBr溶液与2ml Cl-、Br-和I- 混合溶液配成10ml 含有高浓度Br-的Cl-、Br-和I- 混合溶液,从混合溶液中各取2ml 分别置于离心管中;
2)用2~3滴6mol/L HNO3溶液酸化,再加入0.1 mol/L AgNO3 溶液至沉淀完全,在水浴上加热2min使卤化银聚沉,离心后弃去清液,沉淀用去离子水洗一次;
3)向沉淀中加入2ml 2mol/L 氨水,搅拌1min,离心分离,将清液移至另一试管中,用6mol/L HNO3溶液酸化,检出Cl- ;
4)向3)中沉淀中加入1ml 左右的去离子水,并加入少量锌粉,水浴加热并充分搅拌,使沉淀颗粒均变为黑色,离心后取出清液,弃去残渣;
5)向清液中加入1ml CCl4 ,然后滴加氯水,边加边摇动,观察CCl4 层颜色的变化,
记录CCl4 变为紫色和橙色的时间,进行比较;
6)分别做出检出Br-和I- 的时间—饱和NaCl溶液量的函数图象,观察是否有变化及其变化趋势
3.I-浓度对实验结果的影响
1)分别取0ml、2ml、4ml、6ml、8ml饱和KI溶液与2ml Cl-、Br-和I- 混合溶液配成10ml 含有高浓度Br-的Cl-、Br-和I- 混合溶液,从混合溶液中各取2ml 分别置于离心管中;
2)用2~3滴6mol/L HNO3溶液酸化,再加入0.1 mol/L AgNO3 溶液至沉淀完全,在水浴上加热2min使卤化银聚沉,离心后弃去清液,沉淀用去离子水洗一次;
3)向沉淀中加入2ml 2mol/L 氨水,搅拌1min,离心分离,将清液移至另一试管中,用6mol/L HNO3溶液酸化,检出Cl- ;
4)向3)中沉淀中加入1ml 左右的去离子水,并加入少量锌粉,水浴加热并充分搅拌,使沉淀颗粒均变为黑色,离心后取出清液,弃去残渣;
5)向清液中加入1ml CCl4 ,然后滴加氯水,边加边摇动,观察CCl4 层颜色的变化,记录CCl4 变为紫色和橙色的时间,进行比较;
6)分别做出检出Br-和I- 的时间—饱和NaCl溶液量的函数图象,观察是否有变化及其变化趋势。
4.温度对实验结果的影响
1)分别取2ml Cl-、Br-和I- 混合溶液置于3支离心管中;
2)用2~3滴6mol/L HNO3溶液酸化,再加入0.1 mol/L AgNO3 溶液至沉淀完全,在水浴上加热2min使卤化银聚沉,离心后弃去清液,沉淀用去离子水洗一次;
3)向沉淀中加入2ml 2mol/L 氨水,搅拌1min,离心分离,将清液移至另一试管中,用6mol/L HNO3溶液酸化,检出Cl- ;
4)向3)中沉淀中加入1ml 左右的去离子水,并加入少量锌粉,水浴加热并充分搅拌,使沉淀颗粒均变为黑色,离心后取出清液,弃去残渣。将清液分别放置在0℃冰水混合物、50℃水浴和室温下静置5分钟;
5)向清液中加入1ml CCl4 ,然后滴加氯水,边加边摇动,观察CCl4 层颜色的变化,记录CCl4 变为紫色和橙色的时间,进行比较。
5.溶液PH值对实验结果的影响
为了防止其他阴离子的影响,该反应只能在酸性环境下进行,因此只探究溶液酸性强弱对实验结果的影响。
1)按下表配制混合溶液:
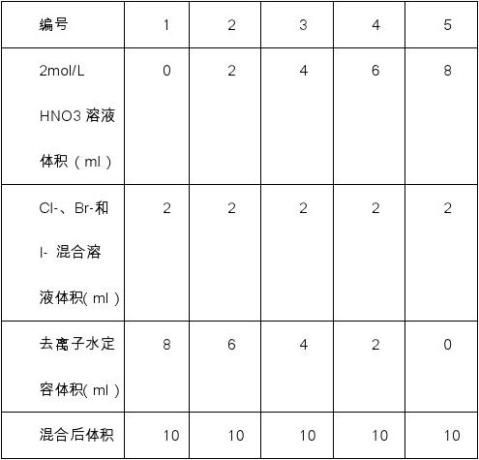

从混合溶液中各取2ml 分别置于离心管中;
2)用2~3滴6mol/L HNO3溶液酸化,再加入0.1 mol/L AgNO3 溶液至沉淀完全,在水浴上加热2min使卤化银聚沉,离心后弃去清液,沉淀用去离子水洗一次;
3)向沉淀中加入2ml 2mol/L 氨水,搅拌1min,离心分离,将清液移至另一试管中,用6mol/L HNO3溶液酸化,观察现象 ;
4)向3)中沉淀中加入1ml 左右的去离子水,并加入少量锌粉,水浴加热并充分搅拌,使沉淀颗粒均变为黑色,离心后取出清液,弃去残渣;
5)向清液中加入1ml CCl4 ,然后滴加氯水,边加边摇动,观察CCl4 层颜色的变化,记录CCl4 变为紫色和橙色的时间,进行比较;
6)分别做出检出Br-和I- 的时间—饱和NaCl溶液量的函数图象,观察是否有变化及其变化趋势。
六、 参考文献
百度百科
《化学教育》 19xx年01期
《在无机化学中的硫化氢系统分析》 任所财
七、 小组分工表
第二篇:卤素离子的分离及检验
卤素离子的分离及检出
完成时间:20##年10月21日
作者:郑旭辉 古欣 李雅颂 张金阳
生命科学学院
一、摘要
在分离并检验Cl-、Br-、I-的试验中,一些内部条件和外部条件不同会影响实验效果,如反应物的浓度与纯度、所加试剂的量、溶液pH值、实验环境的温度等,这些因素的影响都可以通过实验来进行验证。
二、前言
在日常生活与科研工作中,我们遇到的物质大多数为混合物,因此,从复杂的混合物中将我们所需的物质一一分离、检出就显得尤为重要。本次化学实验课上,我们进行了关于卤素离子分离与检出的实验,我们小组就此实验中各种条件对实验的影响进行了讨论与研究,并总结了以下观点。
三、内容
我们小组将题中所说的“条件”分为内部条件与外部条件(此处的分类只为了讨论方便,无严格界限),分别进行了总结归纳:
(1) 内部条件:
内部条件是指试验中试剂的浓度、纯度等,有:
① 混合液中溴离子、氯离子、碘离子的浓度的相对多少:
当溶液中氯离子过多时,在用氨水溶解氯化银时,可能会是少量的碘化银和溴化银溶解(氨水的配位作用所加溶液量过多导致溶解),导致分离不完全,对氯离子的检验造成一定干扰。
当溶液中碘离子远多于溴离子时,首先是将碘离子氧化为碘酸根所需氯水的量较大,可能无法完全转化;二溴离子过少,将其转化维溴单质后,溶在有机层中颜色不明显,导致漏检溴离子。
② 溶解氯化银时所加氨水的浓度:
本实验中,所加氨水浓度为2mol/L,此时仅氯化银溶于其中。那么,溴化银、碘化银绝对不溶于氨水么?
对于反应
AgBr+2NH3*H2O=Ag(NH3)2Br+2H2O
它可以拆成
AgBr=Br- +Ag+ K1=5.35*10^-13
2NH3*H2O+ Ag+= 2H2O+ Ag(NH3)2+ K2=1.1*10^7
所以,对于溴化银溶于氨水的反应,其K=K1K2=5.89*10^-6
由于“溶解”的最低限度为0.01mol/L,因此,氨水的最低浓度约为17mol/L,而常温下氨水浓度可达约20mol/L。因此,若所用氨水浓度过大,可能将溴化银溶解,从而干扰氯离子的检出(碘化银溶度积过小,很难用氨水溶解)。
③ 溶液的pH值
(2) 外部条件:
指人为操作中的错误与误差。
① 所加硝酸银的量:
本实验为了将卤素离子以沉淀形式分离,利用硝酸银作沉淀剂。若硝酸银所加量过少,由于氯化银是最后沉淀,可能会导致氯离子沉淀不完全,难以检验,若氯离子很少,可能导致无氯化银生成,漏检氯离子。因此,硝酸银应适当多加一些,
② 所加锌粉的量,以及是否充分搅拌:
与硝酸银同理,若锌粉加少了,或搅拌不够完全,可能会导致溴离子难检或漏检。
③ 所加四氯化碳的量:
若四氯化碳加得过多,会稀释溶在其中的卤素单质,导致其颜色变浅,若卤素单质较少,可能难以分辨(特别是溴单质),导致漏检。
若四氯化碳加的少,有机层过浅,也会导致颜色难以辨认。
④ 实验环境的温度
温度会影响化学反应速率的快慢(虽然溶液中的反应速率极快),且会影响难容物的溶度积,可能会导致分离不完全。
四、设计实验
设计实验方案:
实验目的:探究实验条件对连续法进行Cl-、Br-和I-的分离检出实验结果的影响
实验原理:分别改变三种离子的浓度、反应体系的温度,以及反应体系的PH值,与原实验进行对照,得出结论。
实验所需的试剂及仪器:
Cl-、Br-和I- 混合溶液,饱和NaCl溶液,饱和NaBr溶液,饱和KI溶液,2mol/L HNO3溶液,6mol/L HNO3溶液,0.1 mol/L AgNO3 溶液,2mol/L 氨水,锌粉,CCl4 ,去离子水
离心管,滴管,水浴锅,离心机,小试管
实验步骤:
1. Cl-浓度对实验结果的影响
1) 分别取0ml、2ml、4ml、6ml、8ml饱和NaCl溶液与2ml Cl-、Br-和I- 混合溶液配成10ml 含有高浓度Cl-的Cl-、Br-和I- 混合溶液,从混合溶液中各取2ml 分别置于离心管中;
2) 用2~3滴6mol/L HNO3溶液酸化,再加入0.1 mol/L AgNO3 溶液至沉淀完全,在水浴上加热2min使卤化银聚沉,离心后弃去清液,沉淀用去离子水洗一次;
3) 向沉淀中加入2ml 2mol/L 氨水,搅拌1min,离心分离,将清液移至另一试管中,用6mol/L HNO3溶液酸化,检出Cl- ;
4) 向3)中沉淀中加入1ml 左右的去离子水,并加入少量锌粉,水浴加热并充分搅拌,使沉淀颗粒均变为黑色,离心后取出清液,弃去残渣;
5) 向清液中加入1ml CCl4 ,然后滴加氯水,边加边摇动,观察CCl4 层颜色的变化,记录CCl4 变为紫色和橙色的时间,进行比较;
6) 分别做出检出Br-和I- 的时间—饱和NaCl溶液量的函数图象,观察是否有变化及其变化趋势。
2. Br-浓度对实验结果的影响
1) 分别取0ml、2ml、4ml、6ml、8ml饱和NaBr溶液与2ml Cl-、Br-和I- 混合溶液配成10ml 含有高浓度Br-的Cl-、Br-和I- 混合溶液,从混合溶液中各取2ml 分别置于离心管中;
2) 用2~3滴6mol/L HNO3溶液酸化,再加入0.1 mol/L AgNO3 溶液至沉淀完全,在水浴上加热2min使卤化银聚沉,离心后弃去清液,沉淀用去离子水洗一次;
3) 向沉淀中加入2ml 2mol/L 氨水,搅拌1min,离心分离,将清液移至另一试管中,用6mol/L HNO3溶液酸化,检出Cl- ;
4) 向3)中沉淀中加入1ml 左右的去离子水,并加入少量锌粉,水浴加热并充分搅拌,使沉淀颗粒均变为黑色,离心后取出清液,弃去残渣;
5) 向清液中加入1ml CCl4 ,然后滴加氯水,边加边摇动,观察CCl4 层颜色的变化,记录CCl4 变为紫色和橙色的时间,进行比较;
6) 分别做出检出Br-和I- 的时间—饱和NaCl溶液量的函数图象,观察是否有变化及其变化趋势
3. I-浓度对实验结果的影响
1) 分别取0ml、2ml、4ml、6ml、8ml饱和KI溶液与2ml Cl-、Br-和I- 混合溶液配成10ml 含有高浓度Br-的Cl-、Br-和I- 混合溶液,从混合溶液中各取2ml 分别置于离心管中;
2) 用2~3滴6mol/L HNO3溶液酸化,再加入0.1 mol/L AgNO3 溶液至沉淀完全,在水浴上加热2min使卤化银聚沉,离心后弃去清液,沉淀用去离子水洗一次;
3) 向沉淀中加入2ml 2mol/L 氨水,搅拌1min,离心分离,将清液移至另一试管中,用6mol/L HNO3溶液酸化,检出Cl- ;
4) 向3)中沉淀中加入1ml 左右的去离子水,并加入少量锌粉,水浴加热并充分搅拌,使沉淀颗粒均变为黑色,离心后取出清液,弃去残渣;
5) 向清液中加入1ml CCl4 ,然后滴加氯水,边加边摇动,观察CCl4 层颜色的变化,记录CCl4 变为紫色和橙色的时间,进行比较;
6) 分别做出检出Br-和I- 的时间—饱和NaCl溶液量的函数图象,观察是否有变化及其变化趋势。
4. 温度对实验结果的影响
1) 分别取2ml Cl-、Br-和I- 混合溶液置于3支离心管中;
2) 用2~3滴6mol/L HNO3溶液酸化,再加入0.1 mol/L AgNO3 溶液至沉淀完全,在水浴上加热2min使卤化银聚沉,离心后弃去清液,沉淀用去离子水洗一次;
3) 向沉淀中加入2ml 2mol/L 氨水,搅拌1min,离心分离,将清液移至另一试管中,用6mol/L HNO3溶液酸化,检出Cl- ;
4) 向3)中沉淀中加入1ml 左右的去离子水,并加入少量锌粉,水浴加热并充分搅拌,使沉淀颗粒均变为黑色,离心后取出清液,弃去残渣。将清液分别放置在0℃冰水混合物、50℃水浴和室温下静置5分钟;
5) 向清液中加入1ml CCl4 ,然后滴加氯水,边加边摇动,观察CCl4 层颜色的变化,记录CCl4 变为紫色和橙色的时间,进行比较。
5. 溶液PH值对实验结果的影响
为了防止其他阴离子的影响,该反应只能在酸性环境下进行,因此只探究溶液酸性强弱对实验结果的影响。
1) 按下表配制混合溶液:

从混合溶液中各取2ml 分别置于离心管中;
2) 用2~3滴6mol/L HNO3溶液酸化,再加入0.1 mol/L AgNO3 溶液至沉淀完全,在水浴上加热2min使卤化银聚沉,离心后弃去清液,沉淀用去离子水洗一次;
3) 向沉淀中加入2ml 2mol/L 氨水,搅拌1min,离心分离,将清液移至另一试管中,用6mol/L HNO3溶液酸化,观察现象 ;
4) 向3)中沉淀中加入1ml 左右的去离子水,并加入少量锌粉,水浴加热并充分搅拌,使沉淀颗粒均变为黑色,离心后取出清液,弃去残渣;
5) 向清液中加入1ml CCl4 ,然后滴加氯水,边加边摇动,观察CCl4 层颜色的变化,记录CCl4 变为紫色和橙色的时间,进行比较;
6) 分别做出检出Br-和I- 的时间—饱和NaCl溶液量的函数图象,观察是否有变化及其变化趋势。
五、参考文献
百度百科
《化学教育》 1989年01期
六、小组分工表

-
实验七:卤素离子的分离及检出讨论报告
卤素离子的分离及检出讨论报告完成日期20xx年11月11日作者吴亦歌刘春宏刘树青刘薇徐璐颖戴安婧生命科学学院指导老师王睿博一摘要讨…
-
实验1卤素
大化实验二实验1卤素实验目的1掌握卤素氧化性和卤离子还原性2了解卤素的歧化反应3掌握卤素含氧酸盐的氧化性4了解卤化氢的实验室制法和…
-
实验一 卤素化学性质实验
实验一卤素元素的化学性质实验一教学目标一掌握Cl2Br2I2的氧化性及ClBrI还原性二掌握卤素的歧化反应三掌握次氯酸盐氯酸盐强氧…
-
化学实验报告
四川化工职业技术学院化学实验报告课题名称:环境友好化学院(系):制药与环境工程技术专业班级:环境监测与治理技术1432班学生姓名:…
-
实验报告
关于本实验中所用的分离方法完成日期:20xx.11.24一、摘要:本文主要讨论本实验中所用的分离方法及使用条件和优势。二、前言:物…
-
实验报告
关于本实验中所用的分离方法完成日期:20xx.11.24一、摘要:本文主要讨论本实验中所用的分离方法及使用条件和优势。二、前言:物…
-
化学实验报告
四川化工职业技术学院化学实验报告课题名称:环境友好化学院(系):制药与环境工程技术专业班级:环境监测与治理技术1432班学生姓名:…
-
实验1卤素
大化实验二实验1卤素实验目的1掌握卤素氧化性和卤离子还原性2了解卤素的歧化反应3掌握卤素含氧酸盐的氧化性4了解卤化氢的实验室制法和…
-
实验一 卤素化学性质实验
实验一卤素元素的化学性质实验一教学目标一掌握Cl2Br2I2的氧化性及ClBrI还原性二掌握卤素的歧化反应三掌握次氯酸盐氯酸盐强氧…
-
B-Z振荡反应实验报告
BZ振荡反应姓名何一白学号20xx0119xx班级化22实验日期20xx年11月6日提交报告日期20xx年11月22日带实验的老师…