【襄樊五中】第四章 《卤素的相关实验》
第四章 卤素
本章实验(1课时)
一、本课要点
1. HCl的水溶性的喷泉实验
2. Cl2制备及卤素单质和化合物性性质实验
二、课前思考
1. 喷泉实验成败的关键是什么?
2. 以综合性实验题如何分析和解答?你能总结归纳几种适合自己的独特方法吗?
三、同步训练
1.  在一个圆底烧瓶里先盛小半瓶水,加热使水的温度上升至沸腾,用带玻璃的塞子塞紧瓶口,然后将烧瓶倒置,放置在铁架台上,使玻璃管放进盛有石蕊的
在一个圆底烧瓶里先盛小半瓶水,加热使水的温度上升至沸腾,用带玻璃的塞子塞紧瓶口,然后将烧瓶倒置,放置在铁架台上,使玻璃管放进盛有石蕊的
烧杯里。这时如果用冷水浇瓶底部或用湿毛巾放在烧瓶底部,烧杯里
的溶液即由玻璃管喷入烧瓶,形成美丽的喷泉。
在干燥的圆底烧瓶里装满氯化氢,用带有玻璃管和滴管(滴管里预先
吸入水)的塞子塞紧瓶口,立即倒置烧瓶,使玻璃管放进盛着石蕊溶
液的烧杯里,挤压滴管的胶头,使少量水进入烧瓶,形成美丽的喷泉。
试根据以上材料回答下列问题:
(1)以上两个实验形象地说明了氯化氢易溶解于水的性质,请说明其道理。
(2)在图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯内的液体b呈喷泉状喷出,最后几乎充满烧瓶,则a和b分别是( )

2. 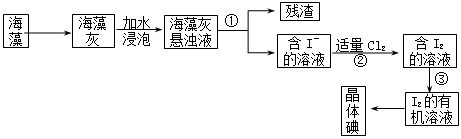 海藻中含有丰富的碘元素(设以I―形式)。某学生课外活动小组设计从海藻中提取碘的流程如下:
海藻中含有丰富的碘元素(设以I―形式)。某学生课外活动小组设计从海藻中提取碘的流程如下:
(1)过程①中实验中操作的名称是_______;过程②中有关反应的离子方程式是_______。
(2)检验过程②所得溶液是否含有I2的方法是__________。
(3)过程③包含两步实验操作,它们的名称是_______和________,此过程操作中必须使用的一种仪器是____________。
(4)过程③中需加入的有机溶剂不可选用的是_________(填序号字母)
A.苯 B.酒精 C.醋酸 D.四氯化碳
3.
 某学生课外活动小组设计的实验如下:
某学生课外活动小组设计的实验如下:
(1)写出下列反应的化学方程式:
①NaCl和浓H 2SO 4共热___________;
②制取气体E____________________。
(2)写出下列反应的离子方程式:
①C → D____________;
②E和NaBr溶液________________。
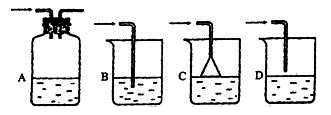
(3)气体B极易溶于水,B溶于水时的最适宜装置(从下图中选)是______(填序号)
(4)检验B溶液中两种主要离子的方法是:①____________;②____________。
4.  实验室中用MnO2与浓盐酸反应制Cl2,再用Cl2和Ca(OH)2反应制漂白粉。已知Cl2和Ca(OH)2的反应是放热反应,温度稍高即发生副反应:6Cl2 + 6 Ca(OH)2 === Ca(ClO3)2 + 5CaCl2 + 6H2O。现有三位学生设计的甲、乙、丙三套装置如图所示:甲、乙、丙三套装置中,B、D、G中试管均放有石灰乳,E中放有NaOH溶液,B中水槽放有冷水。填写下列空白:
实验室中用MnO2与浓盐酸反应制Cl2,再用Cl2和Ca(OH)2反应制漂白粉。已知Cl2和Ca(OH)2的反应是放热反应,温度稍高即发生副反应:6Cl2 + 6 Ca(OH)2 === Ca(ClO3)2 + 5CaCl2 + 6H2O。现有三位学生设计的甲、乙、丙三套装置如图所示:甲、乙、丙三套装置中,B、D、G中试管均放有石灰乳,E中放有NaOH溶液,B中水槽放有冷水。填写下列空白:
(1)a:不易控制反应速率 b. 容易控制反应速率
c. 有副反应发生 d. 可防止副反应发生
e. 容易污染环境 f. 可防止污染环境
(2)请从甲、乙、丙三套装置中选择合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流从左到右方向)为__________,在此套装置中,还缺少的必要仪器装置是______________,说明理由____________
本章实验
第一课时
1.(1)在第一个实验中,当用冷水浇注烧瓶底部时,瓶内气体温度降低,导致瓶内压强减小,大气压的作用下,石蕊溶液进入玻璃管而形成喷泉。第二个实验也是由于瓶内压强的减少而形成喷泉。压强减少的原因就是在于挤压胶头滴管时有少量水进入烧瓶。如果HCl溶解度较小,则此时所造成的内外压之差不能形成持久的喷泉。正是由于HCl气体极易溶解于水,因此少量进入烧瓶后,使HCl大量溶解,瓶内压强聚降,在大气压作用下形成了美丽的喷泉(2)BD
2.(1)过滤:Cl2+2I―= 2Cl―+I2 (2)加入淀粉溶液呈蓝色为含I2
(3)萃取、分液、分液漏斗 (4)B、C
3.(1)①2NaCl+H2SO4(浓) △ Na2SO4+2HCl↑
②MnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2O↑
(2)①Ba2++SO42― BaSO4↓ ②Cl2+2Br― 2Cl―+Br2
(3)C
(4)①加石蕊试液变红(或加Zn产生无色气体),证明含H+
②加AgNO3溶液产生白色沉淀,再加稀HNO3,沉淀不溶解,证明含Cl―
4.(1)甲:d,ae;乙:f,ac;丙:b,ce
(2)FBE,除去Cl2中混有的HCl的洗气装置
HCl与Ca(OH)2、Ca(ClO)2均能发生反应
第二篇:卤素
《卤族元素》
卤族元素 教案
第一课时
教学目标:
知识目标:1.掌握卤族元素性质变化规律
2.了解可逆反应的涵义
能力目标:通过对卤素与氯气性质的比较,初步形成元素族的概念。了解卤素性质随着核电荷数的增加,原子半径的增大而递变的规律,提高对同族元素性质进行类比和递变的推理、判断能力。
情感目标:使学生认识到矛盾的普遍性和特殊性,认识量变与质变的关系。
教学重点:卤素性质比较
教学方法:引导-探究-实验验证
教学过程:
引入:前面已经学习过金属钠,利用由个别到一般的科学方法认识了碱金属性质的递变。今天我们将继续利用这种方法,学习卤素的性质。
展示:氟、氯、溴、碘、砹结构的图片,让学生找出卤素原子结构的异同点。再根据结构的特点推测性质的特点。
小结:卤素原子结构特点。
板书:第二节卤族元素
一、原子结构的特点
1. 卤素原子结构的相同点是原子的最外层都有7个电子。
2. 卤素原子结构的不同点是核电荷数不同,电子层数不同,原子半径不同。
展示:氟、氯、溴、碘、砹单质的图片或者部分单质的实物样品。让学生观察颜色和状态。
阅读:教材中卤素单质的物理性质的图表,得出物理性质的递变规律,把物理性质和结构联系起来,不同单质的分子吸收带不同(即吸收谱线的区域不同)。白色的太阳光被吸收了一部分以后,剩下未被吸收的部分,就是我们观察到的物质的颜色。
观察:关于溴的颜色和状态要让学生观察,存放在试剂瓶中水封保存。碘的升华以演示实验的形式让学生认识到碘可以从固体直接变为气体。利用这个性质可以从混合物中分离出碘。例如:砂子和碘的混合物。
实验:溴和碘易溶于有机溶剂可以以实验的形式加以讲解。列出表格

讲述:实际生活中的应用。例如:碘酒,此处还可以讲解一些生活常识:碘酒与红药水不能混用。
板书:二、物理性质
状态:气态  固态
固态
颜色:浅  深
深
密度:逐渐增大
熔沸点:逐渐升高
复习:氯气的化学性质,从氯出发从相似性和递变性两个方面把氯的知识推向全族。
讨论:得出相似性
板书:三、化学性质
1.相似性:
(1)一定条件下均可与氢气反应:H2 + X2 =2HX
(2)Cl2、Br2、I2均可与水反应:X2 + H2O=HX+ HXO
讲述:卤族氢化物均为无色,极易溶于水,有刺激性气味,在空气中冒白雾的气体。
明确:由于前面分析了卤族元素原子结构存在差异,因此在性质上一定也有所不同。讲课时注意对比反应的剧烈程度,生成物的稳定性等。此处可以播放课件“卤族元素”。
板书:2. 递变性
(1)与金属反应:
(2)与氢气反应:
讲述:可逆反应并举例说明。分析氢气和氧气反应生成水和电解水为什么不是可逆反应。
回顾:氯气和水的反应,讲述其它卤素单质与水反应的情况。
板书:(3)与水反应:氟特殊,氯、溴、碘相似。反应的剧烈程度逐渐减弱。
小结:卤素原子结构的异同决定了性质上的相似和递变,通过对比卤素单质与金属、与氢气、与水的反应,初步得出结论:氧化性的强弱顺序: 。
。
作业 :书后习题
板书设计:
第二节卤族元素
一、原子结构的特点
1. 卤素原子结构的相同点是原子的最外层都有7个电子。
2. 卤素原子结构的不同点是核电荷数不同,电子层数不同,原子半径不同。
二、物理性质
状态:气态 固态
固态
颜色:浅 深
深
密度:逐渐增大
熔沸点:逐渐升高
三、化学性质
1.相似性:
(1)一定条件下均可与氢气反应:H2 + X2 =2HX
(2)Cl2、Br2、I2均可与水反应:X2 + H2O=HX+ HXO
2. 递变性
(1)与金属反应:氟(F2)可以与所有的金属反应;氯(Cl2)可以与绝大多数金属反应;溴、碘也可以与大多数金属反应。例如:2Fe+3Cl2  2FeCl3 而2Fe+3I2
2FeCl3 而2Fe+3I2  2FeI2
2FeI2
(2)与氢气反应:反应条件由易到难;反应剧烈程度由剧烈变为缓慢;卤化氢的稳定性逐渐减弱。
(3)与水反应:氟特殊,氯、溴、碘相似。反应的剧烈程度逐渐减弱。
第二课时
教学目标:
知识目标:1.掌握卤族元素性质变化规律
2.了解卤化银的性质、用途及碘与人体健康等知识
3.掌握卤离子的检验及其干扰离子的排除
4.联系生产和生活实际,通过对卤化物、海水资源及其综合利用的介绍,了解有关卤素的现代科技发展的情况。
能力目标:通过学习学习氯、溴、碘和卤化物的鉴别,培养观察、分析能力。
情感目标:使学生认识到矛盾的普遍性和特殊性,认识量变与质变的关系。
教学重点:卤素单质化学性质的规律性及其特殊性。
教学方法:引导-探究-实验
教学过程:
复习提问:1. 卤素原子结构的异同点是什么?2. 卤素单质的化学性质有哪些相似性和递变性。
引入:卤素单质间能否发生置换反应呢?通过实验来说明,还可播放动画“卤素单质间的置换反应”。
实验:可以分成三组:1. 将少量新制的饱和氯水分别注入盛有NaBr溶液和KI溶液的试管中,用力振荡后,再注入少量CCl4,振荡静置观察现象。2. 将少量溴水注入盛有NaCl溶液和KI溶液的试管中,用力振荡后,再注入少量CCl4,振荡静置观察现象。3. 将少量碘水注入盛有NaCl溶液和NaBr溶液的试管中,用力振荡后,再注入少量CCl4,振荡静置观察现象。(说明:每次完成一组实验后,要求学生记录现象,写出反应的化学方程式和离子方程式,分析电子得失的情况,指明氧化剂和还原剂。)
小结:氯、溴、碘的氧化性强弱顺序。
讲解:氟气不能从卤化物的溶液中置换出氯、溴、碘。因为氟会首先与水剧烈反应,生成氢氟酸和氧气。但是若在熔融状态下,可以发生如下反应:F2 + 2NaCl(熔融)=2NaF + Cl2,说明氟的氧化性强于氯。
总结:单质氧化性的强弱顺序和离子还原性的强弱顺序。
板书:(4)卤素单质间的置换反应
Cl2 + 2Br- = 2Cl- + Br2 氧化性:Cl2 > Br2 还原性: Br- > Cl-
Cl2 + 2I- = 2Cl- + I2 氧化性:Cl2 > I2 还原性: I- > Cl-
Br2 + 2I- = 2Br- + I2 氧化性:Br2 > I2 还原性: I- > Br-
结论:单质氧化性:
离子还原性:
提问:请你从卤素原子结构的角度来分析为什么随着氟、氯、溴、碘的顺序,它们的非金属性依次减弱?
老师总结:
过渡:卤素性质上有相似性和递变性,同时也有特殊性。
演示实验:在装有少量淀粉的溶液的试管中,滴入几滴碘水。然后在装有少量淀粉的溶液的试管中,滴入几滴碘化钾溶液。对比现象。
板书:3. 碘遇淀粉变蓝
提问:为什么氯气可以使湿润的淀粉碘化钾试纸变蓝呢?还有哪些物质可以使之变蓝?
提示:在注重卤素性质的相似和递变的同时不要忽略了某些特性。例如:HF为弱酸,其它氢卤酸都是强酸;氟无正价;溴在常温下是液态(唯一的液态非金属单质)等。
板书:四、含卤化合物的主要用途
1. 卤化银
实验:分别生成氯化银、溴化银、碘化银的沉淀。要求学生观察现象,写出反应的离子方程式。提示AgF是可溶的。此法可以用来检验卤离子。
讨论:检验卤离子的方法(结合前面的知识)。
教师小结:方法一:根据卤化银的不同颜色,使硝酸银与卤化物反应,从而检验。方法二:利用卤离子的不同还原性和卤素单质在不同溶剂中的溶解性不同,加入少量有机溶剂加以检验。
讲述:不溶性卤化银见光分解的性质及其用途。
学生交流:碘与人体健康以及预防碘缺乏病。
小结本节内容
作业:书后习题及补充练习,也可以安排学生写一篇关于我国利用海水资源的小论文。
板书设计:(4)卤素单质间的置换反应
Cl2 + 2Br- = 2Cl- + Br2
氧化性:Cl2 > Br2 还原性: Br- > Cl-
Cl2 + 2I- = 2Cl- + I2
氧化性:Cl2 > I2 还原性: I- > Cl-
Br2 + 2I- = 2Br- + I2
氧化性:Br2 > I2 还原性: I- > Br-
结论:单质氧化性:
离子还原性:
3. 碘遇淀粉变蓝
四、含卤化合物的主要用途
1. 卤化银 X- + Ag+ =AgX↓(X为Cl、Br、I)具有感光性、人工降雨。
卤离子检验:硝酸银溶液和稀硝酸
2. 碘化合物的主要用途
-
实验七:卤素离子的分离及检出讨论报告
卤素离子的分离及检出讨论报告完成日期20xx年11月11日作者吴亦歌刘春宏刘树青刘薇徐璐颖戴安婧生命科学学院指导老师王睿博一摘要讨…
-
实验1卤素
大化实验二实验1卤素实验目的1掌握卤素氧化性和卤离子还原性2了解卤素的歧化反应3掌握卤素含氧酸盐的氧化性4了解卤化氢的实验室制法和…
-
实验一 卤素化学性质实验
实验一卤素元素的化学性质实验一教学目标一掌握Cl2Br2I2的氧化性及ClBrI还原性二掌握卤素的歧化反应三掌握次氯酸盐氯酸盐强氧…
-
化学实验报告
四川化工职业技术学院化学实验报告课题名称环境友好化学院系制药与环境工程技术专业班级环境监测与治理技术1432班学生姓名陈强学号46…
-
实验报告
关于本实验中所用的分离方法完成日期:20xx.11.24一、摘要:本文主要讨论本实验中所用的分离方法及使用条件和优势。二、前言:物…
-
实验报告
关于本实验中所用的分离方法完成日期:20xx.11.24一、摘要:本文主要讨论本实验中所用的分离方法及使用条件和优势。二、前言:物…
-
化学实验报告
四川化工职业技术学院化学实验报告课题名称环境友好化学院系制药与环境工程技术专业班级环境监测与治理技术1432班学生姓名陈强学号46…
-
实验七:卤素离子的分离及检出讨论报告
卤素离子的分离及检出讨论报告完成日期20xx年11月11日作者吴亦歌刘春宏刘树青刘薇徐璐颖戴安婧生命科学学院指导老师王睿博一摘要讨…
-
实验1卤素
大化实验二实验1卤素实验目的1掌握卤素氧化性和卤离子还原性2了解卤素的歧化反应3掌握卤素含氧酸盐的氧化性4了解卤化氢的实验室制法和…
-
实验一 卤素化学性质实验
实验一卤素元素的化学性质实验一教学目标一掌握Cl2Br2I2的氧化性及ClBrI还原性二掌握卤素的歧化反应三掌握次氯酸盐氯酸盐强氧…