生化实验报告
实验一 过氧化物酶同工酶的分离提取
一、实验目的
1、初步掌握蛋白质分离纯化的一般步骤,熟悉离心的使用及蛋白质提取中的注意事项。
2、了解过氧化物酶的作用。
二、原理:
过氧化物酶是植物提内普遍存在、活性较高的一种酶,它与呼吸作用、光合作用及生长素的氧化等都有密切关系,在植物生长发育过程中,它的活性不断发生变化,因此测定这种酶的活性,可以反映某一时期植物体内代谢的变化。
本实验以苜蓿种子为材料,低速离心去除细胞碎片,上清用丙酮或硫酸铵沉淀得过氧化物酶同工酶粗品。
三、实验材料、器材及试剂:
(一)材料:苜蓿种子
(二)器材:研钵、超声波粉碎仪、高速冷冻离心机 酸度计
(三)实验试剂:
1.丙酮
2.提取缓冲液 PBS。
四、实验步骤
1.精确称取4g左右植物样品(若是苜蓿种子,提前用水溶胀好,)加15ml提取缓冲液匀浆;[先将种子称好研碎,再逐渐加入提取缓冲液,匀浆用去10ml,最后洗涤用5ml]
2.13000g离心10min;
3.取清液(量体积),沉淀弃去(清液少许低温保存测定酶活和含量 样1);
4.沿烧杯壁缓慢加入等体积-30℃事先放置在冰柜中],4℃放置30min;
5.13000g离心10min,沉淀用3 ml 0.05 M PBS回溶( 记录体积,留作实验二测含量和活性 样2)低温保存;
6.上清液缓慢加入等体积-30℃预冷的丙酮,4℃放置30min。13000g离心10min,沉淀。沉淀用5ml 0.05 M PBS回溶(记录体积后,测含量和活性 样3)低温保存。
五、实验结果与分析
第3步中清液的4ml,留取1ml作样品1。
第5步中回溶后体积为3ml,即为样品2。
第6步中回溶后体积为5ml,即为样品3。
实验二 过氧化物酶同工酶含量测定
一、实验目的:
掌握用考马斯亮蓝G-250染色法测定酶含量的原理与方法。
二、实验原理:
考马斯亮蓝G-250(coomassie brilliant blue G-250)测定蛋白质酶含量属于染料结合法的一种。该染料在游离状态下呈红色,在稀酸溶液中当它与蛋白质的疏水区域结合后变为青 1
色,前者最大吸收值在465nm,后者在595nm。在一定蛋白质浓度范围内(1~1000μg),蛋白质与色素结合后在595nm吸光值的大小与蛋白质的浓度呈正比,故可用于蛋白质的定量测定。
考马斯亮蓝G-250与蛋白质的结合十分迅速,2min左右即可达到平衡,其结合物在室温下1小时内保持稳定。此法灵敏度高,易于操作,干扰物较少,是一种比较好的定量方法。其缺点是在蛋白质浓度太高时线形偏低,且不同来源蛋白质与色素的结合状况有一定差别。 三、实验材料、试剂和仪器设备 (一)材料
苜蓿种子 (二)仪器设备
722分光光度计 烧杯 量筒 移液管 具塞刻度试管 (三)试剂
1.标准牛血清白蛋白溶液(100μg/ ml)。 2.考马斯亮蓝G-250: 四、实验步骤
(一)标准曲线的绘制
取6支具塞刻度试管,按下表依次加入标准蛋白,向各管中加入考马斯亮蓝G-250溶液5ml,摇匀,放置5min左右,用1cm的比色皿在595nm处测定吸光值,以蛋白的μg作纵坐标,吸光值为横坐标绘制标准曲线。
表 绘制标准曲线各试剂加入量
管号
标准蛋白质(ml) 蒸馏水(ml)
1 0 1.0 2 0.1 0.9 3 0.2 0.8 4 0.3 0.7 5 0.4 0.6 6 0.5 0.5

(二) 样品的测定
取7支具塞刻度试管,空白1支,其它6支分别加入实验一的3、5、6步骤中的样品(每一样品2个平行样)0.1ml,各加用蒸馏水0.9ml,向各管中加入考马斯亮蓝G-250溶液5ml,充分摇匀,放置2min左右,用1cm的比色皿在595nm处测定吸光值,从标准曲线上查得样品中蛋白的含量。 五、结果计算
式中:C为标准曲线上查得样品中蛋白的含量,μg;VT为提取液的总体积,ml;WF为
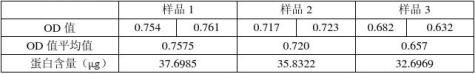

由下面标曲图可知,标准曲线的回归方程是直线方程:y=49.767x。 标准曲线图
2
实验三 过氧化物酶的活性测定
一、实验目的
掌握愈创木酚法测定过氧化物酶活性原理与方法。 二、实验原理
在过氧化物酶的催化下,H2O2将愈创木酚氧化成茶褐色产物。此产物在470nm处有最大吸收值,故可通过测定470nm处的吸光值的变化可以测定过氧化物酶的活性。 三、实验材料、试剂和仪器设备 (一)材料
菠菜叶片(或苜蓿种子) (二)仪器设备
722型分光光度计 烧杯 量筒 移液管 试管 研钵 离心机 (三)试剂
1.pH5.5 0,05M PBS;
2.0.05M愈创木酚溶液 100 ml; 3.2% H2O2;
4.20%的三氯乙酸。 四、实验步骤
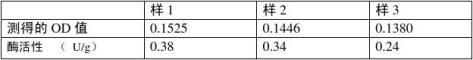
1.样品液:以实验一的3、5、6步(稀释10倍后)中低温保存的酶样液进行测定. 2.过氧化物酶活性测定
按以下表格依次加入各试剂。
表 测活体系中各试剂加入量
管 号
pH5.5 0.05M PBS(ml) 0.05M愈创木酚溶液(ml)
2% H2O2(ml) 酶样液(ml)
样1 2.9 1.0 1.0 0.1
3
样2 2.9 1.0 1.0 0.1
样3 2.9 1.0 1.0 0.1
对照 2.9 1.0 1.0
0.1(灭活酶液)
37℃保温15min, 迅速冰浴
2 2 2 20%三氯乙酸(ml) 2
然后离心5000g10min,取清液,适当稀释后,470nm处测吸光值。
五、结果计算
以每分钟内A470变化0.01为1个过氧化物酶活性单位(u)。
式中:ΔA470为反应时间内吸光值的变化;W为所称样品重,g;t为反应时间,min;VT为提取酶液总体积,ml;VS为测定时取用酶液体积,ml。
实验四 葡聚糖凝胶过滤分离蛋白质
一、实验目的:
学会用凝胶过滤层析分离物质的基本操作,深刻理解其分离物质的原理。
二、实验原理:
凝胶过滤层析利用有一定孔径的多孔的亲水性凝胶作为载体,当分子大小不同的混合物 通过这种凝胶柱时,各物质在柱中存在两种运动,一是随洗脱液垂直向下移动,二是无定向的扩散运动。直径大于凝胶孔径的大分子,不能进人胶粒内部,便直接沿着胶粒间隙溶剂先流出,称为全排出);小分子物质,直径小于凝胶孔径,能自由进出能容纳下它们的孔穴,绕道而行,结果在柱中的保留时间增长而最后流出;中等大小的分子,能进人部分胶粒内部,从而在柱中的保留时间较大分子长,但较小分子短,中间流出。于是,流过凝胶柱的混合物按其分子大小W被分离。

混合物中某一被分离成分在一定的凝胶层析柱内的洗脱行为,通常用分配系数
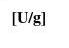
(Kd)来表示。其定义为,
Kd=(Ve一V0)/ Vi
Ve,某一被分离物成分被洗脱时所用洗脱液的体积
Vo,凝胶颗粒间自由空间的总体积,
Vi,胶颗粒内部孔穴的总容积
大分子物质,其Kd=0,小分子能全部进人胶粒内的Kd=1,中等大小分子,Kd在O~1 之间。
凝胶过滤法的分辨率(ρ)是凝胶层析中的另一个主要特征常数。从数学角度上可以表示为,
ρ=2(V2-V1)/(W1+W2) (≥1)
V2、V1,是两种被分离物的洗脱体积
4
W1、W2,是两个物质的洗脱峰的宽度。两个相的物质要想完全分离,ρ≥,1。
三、使用试剂及器材:
胰蛋白酶(分子量为23KD)和牛血清白蛋白(分子量68KD)混合物、蛋白marker、层析柱50cm×l.lcm、核蛋检测仪、部分收集器、sephadex G一l5O
四、实验步骤:
1.凝胶的处理:取干燥的Sephadex G一l0O浸泡在洗脱液(本实验用蒸馏水,含5%的乙醇)中,充分溶胀,注意不要过分搅拌,以防颗粒破碎。为了缩短溶胀时间,可在沸水浴上加热至将近1OO℃30min,还可以排除凝胶内部的汽泡(学生自己做)。
2.装柱:将柱子及其附件清洗干净先将下口接好,加上缓冲液,将出口处的汽泡排除,待柱内剩有2cm左右液柱时,关紧流出口,将己溶胀好的凝胶的上清液吸去,轻轻搅拌凝胶顺层析柱或玻璃棒一次性倾倒入层析柱,待底部自然沉降有一定凝胶后,打开流出口,直至凝胶沉积至所需高度。加盖,并接上贮液瓶,开始滴注洗脱平衡液(本实验用蒸馏水,含5%的乙醇)。至少要滴注2个柱床体积的洗液,使胶床稳定。并检查柱子装得是否均匀、有无断层,有无汽泡(若有需重装)。
3.上样:①用蒸馏水溶解胰蛋白酶(分子量为23KD)60mg和牛血清白蛋白(分子量
68KD)20mg混合物用1ml H2O溶解。上样0.5ml.
②取下洗脱液,吸去柱床上的溶液(或自留流出),直至胶面刚露出为止,夹住下出口,使洗脱液停止流动。
③将样品沿柱壁四周缓慢加入(别搅动胶面)
④打开卡子,使下口流出液体,待样品进入胶床,夹住下出口,使洗脱液停止流动。
⑤再如上法,加1-2次小体积的洗脱液冲洗内壁,完成后,将洗脱剂与流入口相接,打开卡子进行洗脱。
4.洗脱:借助重力洗脱即可,洗脱时要控制流速为4m1/3Omin。收集时用自动部分收集器收集,每管4m1,洗脱物各组分收集根据核蛋仪及层析图谱仪的数据与流速共同来决定(若无采集图谱时,还需要在分光光度计上测定OD28Onm来定)。
5.保存:样品洗脱完毕,根据层析图谱和自动部分收集器的数据将各组分合并,保存可以冷冻,也可浓缩,然后进行进一步鉴定。
6.凝胶的回收:取下层析柱,将上下口的盖子取下,从上口处用吸耳球一吹,胶即可从下口流出, 凝胶可以灭菌保存,干燥保存(乙醇乙醚脱水干燥),和防腐剂保存。
实验五 聚丙烯酰胺凝胶电泳分离蛋白质
一、实验目的:
学会用聚丙烯酰胺凝胶分离物质的基本操作,深刻理解此法分离物质的原理。
二、实验原理:
以聚丙烯酰胺作为支持介质的一种电泳技术。凝胶是聚丙烯酰胺和甲叉双丙烯酰胺交联而成的,催化剂为过硫酸铵,加速剂为TEMED。
本实验采用聚丙烯酰胺凝胶不连续体系与非解离体系,电泳迁移率的大小与带电粒子的 大小、形状和带净电荷的数量等因素有关。不同蛋白质,可根据其所带电荷大小、形状而得到分离。
5
三、试剂与器材:
(一)器材
垂直板电泳糟、直流稳压电源,微量注射器,电泳仪等。
(二)试剂
1.分离胶缓冲液(4X):1.5M Tris一HCl pH8.8,1OOml
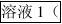
是Tris的摩尔浓度,HCl用来调pH)
2.浓缩胶缓冲液(4X):0.5M Tris一HCl

pH6.7,1OOml 3.胶母液(T34%,C6%):称取丙烯酰胺29.2g,甲又双丙烯酰胺0.8g,用少量煮过10分

钟并冷却的蒸馏水溶至100ml,不能加热。 4.10%过硫酸铵(AP):用少量煮过10分钟并冷却的蒸馏水配制,在4℃可存3-4周,100ml。 5.电极缓冲液(lOX):称Tris l5.lg,甘氨酸72g溶于水中,定容至500ml,使用前1:9稀释(或者再稀释2-5倍也可)。 6.样品染色液( 考马斯亮兰染色液):0.09%考马斯亮兰R一250,227ml甲醇,46m1冰乙酸,227ml水,定容到5O0ml。
7.加样缓冲液:甘油3.2m1,2M Tris一HCl(pH6.8)1.25ml,溴酚兰粉末少许加水至lOml。【先配制2M Tris一HCl(pH6.8)1.25ml的溶液】,
8.脱色液: 20%甲醇,7%~10%的冰乙酸(现用现配)
9.浓缩胶


水3.05ml;1O%AP 27μl,TEMED 5μl。(够2

块胶)
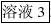
分离胶,水6.25ml,1O%AP 0.O7mL,TEMED 0.OlmL 实验材料:
胰蛋白酶(牛的胰蛋白酶氨基酸残基223个,分子量为23300)、牛血清白蛋白(分子量68KD)、木瓜蛋白酶、胃蛋白酶、中性蛋白酶。
四、实验步骤
1.胶模固定:选两块洗净的玻璃板一高一矮和一根密封条,按要求对齐,将玻璃板和挡板面对面【挡板不平整面和玻璃板的矮—凹板挨着】,其中玻璃板在外侧,装入电泳槽固定好,加蒸馏水不漏水为之,取下玻璃板、密封条洗干净,晾干。(电泳槽按要求清洗干净)。重新按上述步骤装入电泳槽中。
2.制备分离胶:按分离胶配制方法配好分离胶,缓慢注入胶模中(占玻璃板的2/3,可事先用记号笔画一下),为了防止氧化,沿玻璃板壁轻轻加一层水层(注意不能将胶冲起),室温下聚合20—40min。
3.制备浓缩胶:配制好3%浓缩胶。将胶模中上层水倾倒出去,用滤纸吸干余水。倒入浓缩胶至满,插好样品梳(为了加样方便,在梳齿的底部用记号笔画一下线),注意避免汽泡出现。
4.电泳:将玻璃板取出,去胶条后,重新装入电泳槽中,此时玻璃板在内侧,挡板在外侧,为背靠背【挡板平整面和玻璃板的高---直板挨着】,检查是否漏液后,倒入电泳缓冲液,胶模内侧的液面没过矮板但不可超过高板(矮板在内),外侧的缓冲液和内侧缓冲液相平。 6
5.上样:将样品梳拔出,用电极级冲液冲洗样品孔。样品与样品缓冲液按一定比例混合好(蛋白含量大约为1-2μg/μl)。用微量注射器加人加样孔,加样量为5~10μl。
胰蛋白酶(60μg/μl)原液或稀释5倍
牛血清白蛋白(200μg/μl)原液
木瓜蛋白酶(200μg/μl)原液
中性蛋白酶(200μg/μl)原液
胃蛋白酶(200μg/μl)原液
6.电泳:连接直流稳压电源,矮板连负极,打开电源开关。调节电流,进人分离胶之前一个槽子为2OmA,进人分离胶之后为3OmA,电泳到前沿指示剂到达玻璃板底部即可结束电泳。
7.染色: 关闭电源,取下凝胶模。用剪刀轻轻撬起胶模的下方一侧,一个玻璃板即可取下,用刀片轻轻将胶的两侧划一下,掀起胶的一角,慢向前推同时注水,靠水流压力和润滑作用,将玻璃板与胶分开。一次不行,可从另一端再操作或两端同时操作,在脱色摇床上用考马斯亮兰染色1h。
8.脱色:将胶取出,蒸馏水冲洗数次后,放入脱色液中,数小时换液一次,直至背景清晰为止(本实验可直接用少许水煮到背景清晰为止)。
五、实验结果

7
第二篇:生物化学实验报告格式
《生物化学实验》
实验报告本
专业
班级
姓名
学号
目 录
实验一 基本操作 实验二 血糖测定
实验三 血清谷丙转氨酶的测定 实验四 血清蛋白醋酸纤维薄膜电泳 实验五 凝胶层析(分子筛层析)
实验六 饱食和饥饿对白鼠肝糖原含量的比较 实验七 血清脂蛋白琼脂糖凝胶电泳 实验八 分离纯化基因组DNA(一) 实验九 分离纯化基因组DNA(二) 实验十 PCR
实验十一 琼脂糖凝胶电泳鉴定PCR产物
实验题目
1. 实验目的 2. 实验原理 3. 实验步骤 4. 实验数据及处理(或实验现象及分析)5. 结论 6. 讨论
《生物化学实验》
预习与原始记录本
专业
班级
姓名
学号
目 录
实验一 基本操作 实验二 血糖测定
实验三 血清谷丙转氨酶的测定 实验四 血清蛋白醋酸纤维薄膜电泳 实验五 凝胶层析(分子筛层析)
实验六 饱食和饥饿对白鼠肝糖原含量的比较 实验七 血清脂蛋白琼脂糖凝胶电泳 实验八 分离纯化基因组DNA(一) 实验九 分离纯化基因组DNA(二) 实验十 PCR
实验十一 琼脂糖凝胶电泳鉴定PCR产物
实验题目
1. 预习报告
1.1实验目的
1.2实验流程
1.3 预计结果
1.4注意事项
2. 实验原始数据记录(或实验现象)
-
生化实验报告
生化实验报告单位学号姓名实验1多酚氧化酶PPO的分离提取一实验原理与目的植物受到机械损伤和病菌侵染后PPO催化酚与O2氧化形成为醌…
-
生物化学实验报告
20xx年生物化学实验B姓名学号实验时间实验分组组内成员任课教师实验报告XXXX20xx年11月17日摘要本实验通过从小牛肠中通过…
-
生化实验报告4
生物化学实验报告纤维素酶活力的测定还原糖的测定35二硝基水杨酸法刘欣怡20xx0014005720xx级生物基地班周一下午同组者刘…
-
生物化学实验报告
实验一考马斯亮蓝G250染色法测定蛋白质的含量p24一目的要求掌握考马斯亮蓝CoomassieBrilliantBlue法测定蛋白…
-
生化大实验报告
生化实验报告键入文档副标题实验一多酚氧化酶PPO的分离与提取一实验目的1本实验以马铃薯为主要的实验材料通过细胞组织破碎匀浆过滤离心…
-
生物化学实验报告格式
《生物化学实验》实验报告本专业班级姓名学号目录实验一基本操作实验二血糖测定实验三血清谷丙转氨酶的测定实验四血清蛋白醋酸纤维薄膜电泳…
-
20xx生物化学实验报告册模板
生物化学实验报告姓名:张三学号:20xx000000001专业年级:20xx级生物技术组别:第五实验室生物化学与分子生物学实验教学…
-
大学生物化学实验报告标准格式汇总
生物化学实验报告班级姓名实验一血清蛋白质醋酸纤维薄膜电泳目的原理仪器组成操作与结果结果粘贴实验二酶的特异性目的原理操作与结果将以上…
-
生物化学实验报告册模板
生物化学实验报告姓名学号20xx000000001专业年级20xx级生物技术组别第五实验室生物化学与分子生物学实验教学中心一实验室…
-
生物化学实验记录和实验报告的书写
第二节实验记录和实验报告的书写正确记录实验过程及书写实验报告是训练学生进行正规实验训练的重要内容实验是在理论指导下的科学实践目的在…
-
20xx-20xx生化实验室工作总结
北盛中学聂景生化、化学是一门以实验为基础的学科,开展好实验教学,是学好生化的前提条件。生化实验具备培养学生观察和动手能力,培养学生…