新实验十一 铁、钴、镍的性质
实验六 铁、钴、镍的性质
一、实验目的
1、 试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;
2、 试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理
铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+6
1、Fe2+、Co2+、Ni2+的还原性
(1)酸性介质
Cl2 + 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-
(2)碱性介质
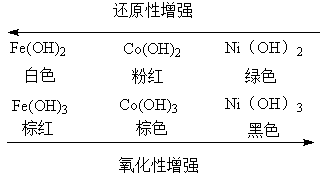
铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)2易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,最后成为红棕色的氢氧化铁。Co(OH)2也能被空气中的氧气慢慢氧化。
2、Fe3+、Co3+、Ni3+的氧化性
由于Co3+和Ni3+都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。CoO(OH)和NiO(OH)通常由Co(II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2、Br2)氧化得到。
Fe3+易发生水解反应。Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+。
3、配合物的生成和Fe2+、Fe3+、Co2+、Ni2+的鉴定方法
(1)氨配合物
Fe2+和Fe3+难以形成稳定的氨配合物。在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH3)6]2+或[Ni(NH3)6]2+。不过[Co(NH3)6]2+ 不稳定,易氧化成[Co(NH3)6]3+。
(2)氰配合物
Fe3+,Co3+,Fe2+,Co2+,Ni2+都能与CN-形成配合物。使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过量时沉淀溶解。
FeSO4+2KCN=Fe(CN)2+K2SO4
Fe(CN)2+4KCN=K4[Fe(CN)6]
从溶液中析出来的黄色晶体是K4[Fe(CN)6]·3H2O,叫六氰合铁(II)酸钾或亚铁氰化钾,俗称黄血盐。在黄血盐溶液中通入氯气(或用其它氧化剂),把Fe(II)氧化成Fe(III),就得到六氰合铁(III)酸钾(或铁氰化钾) K3[Fe(CN)6]。
2 K4[Fe(CN)6]+C12=2 K3[Fe(CN)6]+2KCl
它的晶体为深红色,俗称赤血盐。赤血盐在碱性溶液中有氧化作用。
Fe3+与[Fe(CN)6]4-离子反应可以得到普鲁士蓝沉淀,而[Fe(CN)6]3-离子与Fe2+离子反应得到滕氏蓝沉淀。实验证明两者是相同的物质,都是六氰合亚铁酸铁(III)。
钴和镍也可以形成氰配合物,用氰化钾处理钴(II)盐溶液,有红色的氰化钴析出,将它溶于过量的KCN溶液后,可析出紫色的六氰合钴(II)酸钾晶体。该配合物很不稳定,将溶液稍加热,就会发生下列反应:
2[Co(CN)6]4-+H2O=2[Co(CN)6]3-+2OH-+H2
所以[Co(CN)6]4-是一个相当强的还原剂。 而[Co(CN)6]3-稳定的多。
(3)离子鉴定
① Fe3+的鉴定
K+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6] (蓝色沉淀)(普鲁士蓝)
Fe3+ + n SCN- = [Fe(NCS)n]3-n(血红色)
② Co2+的鉴定
Co2+ + SCN- = Co(NCS)42-(戊醇中显蓝色)
③ Ni2+的鉴定
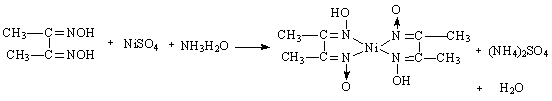
鲜红色
(4)CoCl2×6H2O粉红色,无水CoCl2蓝色,硅胶干燥剂中作指示剂。
粉红CoCl26H2O—325K—〉紫红CoCl22H2O—3l3K—〉蓝紫CoCl2H2O—393K—〉蓝CoCl2
4、Fe的防腐-铁钉发蓝
3Fe + NaNO2 +5NaOH=3Na2FeO2 + NH3 + H2O
6 Na2FeO2 + NaNO2 + 5H2O= 3Na2Fe2O4 + NH3 + 7 NaOH
Na2FeO2 + Na2Fe2O4+ 2H2O= Fe2O3 + 4NaOH
三、仪器与试剂
四、实验步骤
1、二价铁、钴、镍氢氧化物的生成和还原性
(1) Fe2+的还原性
①酸性介质
Cl2 + 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-
②碱性介质
Fe2+ + 2OH- = Fe(OH)2(白色沉淀)
Fe(OH)2 + O2 +2H2O = 4Fe(OH)3(棕红色) 反应迅速
(2)Co2+、Ni2+的还原性
① Co2+ + 2OH- = Co(OH)2 (粉红色沉淀)
Co(OH)2 + 2H+= Co2++ 2H2O
2Co(OH)2 + H2O2 = 2CoO(OH)(棕色沉淀) +2H2O
Co(OH)3在HNO3中溶解不显著,在酸性溶液中用 H2O2还原可提高溶解性,反应如下: 2Co(OH)3 + H2O2 +4H+ → 2Co2+ + 6H2O + O2
4Co(OH)2 + O2 =4CoO(OH) + 2H2O(棕褐色沉淀) 缓慢需加热
② Ni2+ + 2OH- = Ni(OH)2 (绿色沉淀)
Ni(OH)2 + 2H+= Ni2+ + 2H2O
2Ni(OH)2 + H2O2 = 2NiO(OH) (黑色沉淀)+2H2O
2Ni2+ + 6OH- + Br2 = 2Ni(OH)3(黑色沉淀) + 2Br-
2、三价铁、钴、镍氢氧化物的生成和氧化性
(1) Fe3+ + 3OH- = Fe(OH)3 (棕色沉淀)
Fe(OH)3 +3HCl = FeCl3 + 3H2O
(2) 2Co2+ + 6OH- + Br2 = 2Co(OH)3 + 2Br-
2Co(OH)3 + 6HCl = 2CoCl2 + 6H2O + Cl2
(遇淀粉KI试纸变蓝色)
2Ni2+ + 6OH- + Br2 = 2Ni(OH)3 + 2Br-
2Ni(OH)3 + 6HCl = 2NiCl2 + 6H2O + Cl2

3、配合物的生成与性质及离子鉴定
(1)Fe3+、Co2+、Ni2+与氨水反应
Fe3+难以形成稳定的氨配合物。在水溶液中加入氨时形成Fe(OH)3沉淀。将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH3)6]2+或[Ni(NH3)6]2+。不过[Co(NH3)6]2+ 不稳定、易被空中的氧气氧化成[Co(NH3)6]3+。
4[Co(NH3)6]2+ + O2 +2H2O = 4[Co(NH3)6]3++ 4OH-
[Ni(NH3)6]2+稳定性较高。
加氯化铵的目的是使BrO3和BrO3沉淀在浓氨水中完全溶解。
(2)Fe2+、Fe3+、Co2+与K4[Fe(CN)6]、K3[Fe(CN)6]的反应
K+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6] (蓝色沉淀)(普鲁士蓝)
K+ + Fe2+ + [Fe(CN)6]3- = KFe[Fe(CN)6] (蓝色沉淀)( 滕氏蓝)
Co2+ + [Fe(CN)6]4- = Co2[Fe(CN)6] (绿色沉淀)
Co2+ + [Fe(CN)6]3- = Co3[Fe(CN)6]2 (淡棕色沉淀)
(3)Fe3+、Co2+、Ni2+的鉴定反应
① K+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6] (蓝色沉淀)(普鲁士蓝)
Fe3+ + n SCN- = [Fe(NCS)n]3-n有血红色
[Fe(NCS)n]3-n + 6F- = [FeF6]3- + nSCN- (血红色变无色)
② Co2+ + SCN- = Co(NCS)42-(有机相显蓝色)
③ Co2+ + 3K+ + 7NO2- +2H+= K3[Co(NO2)6] (黄色晶体)+ NO +H2O
微热,HAc介质
④ 
红色
4、氧化还原反应与配合物形成的关系
2Fe3+ +2 I- = 2Fe2+ + I2
I2 + [Fe(CN)6]4- = I- + [Fe(CN)6]3-
E0(Fe3+/Fe2+) > E0(I2/I-) > E0([Fe(CN)6]3-/[Fe(CN)6]4-)
5、CoCl2水合物的颜色
CoC12·6H2O 325K CoC12·2H2O 363K CoC12·H2O 393K CoC12
(粉红) (紫红) (紫蓝) (蓝色)
6、铁、钴、镍的硫化物
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
如果加过量的Na2S,则
Fe2+ + S2- = FeS (黑色沉淀)
Ni2+ + S2- = NiS (黑色沉淀)
Co2+ +S2- = CoS (黑色沉淀)
MS + 2HCl = MCl2 + H2S (M=Fe,Co,Ni)(事实上,因为晶形问题,CoS、NiS都不溶解)
FeS不溶于氨水而NiS和CoS溶于氨水形成配合物
MS +HNO3 发生氧化还原反应
7、铁的腐蚀和防腐
(1) 铁的腐蚀
镀锌铁(俗称白铁)和镀锡铁(俗称马口铁),当它们的表面镀层有破损时,铁被腐蚀速度为白铁低于马口铁.三种金属的活动性为Zn>Fe>Sn.一旦镀层破损形成Zn—Fe原电池,Zn为负极被腐蚀,铁为正极得到保护,因此白铁更耐用. 而Fe—Sn原电池,Fe为负极,加速了铁的腐蚀.
(2) 铁的防腐
3Fe + NaNO2 +5NaOH=3Na2FeO2 + NH3 + H2O
6 Na2FeO2 + NaNO2 + 5H2O= 3Na2Fe2O4 + NH3 + 7 NaOH
Na2FeO2 + Na2Fe2O4+ 2H2O= Fe2O3 + 4NaOH
五、注意事项
1、制备Fe(OH)2时,要细心操作,注意不能引入空气。
2、欲使 Co(OH)2 Ni(OH)2沉淀在浓氨水中完全溶解,最好加入少量的固体NH4Cl。
3、 Zn粒和Sn粒均需用砂纸擦净表面的氧化物,使用完后必须回收。
六、思考题
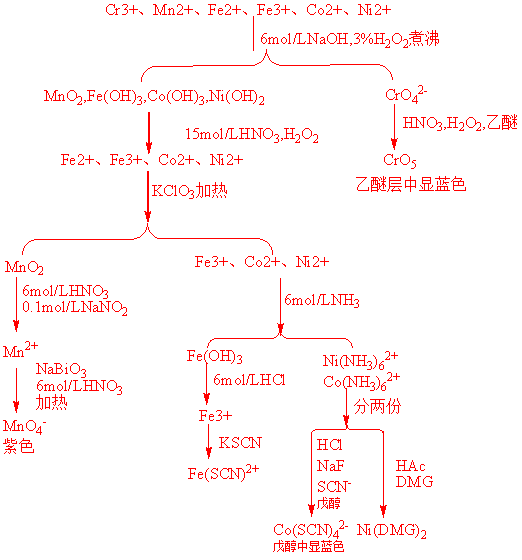
1、 已知溶液中含有Cr3+、Mn2+、Fe2+、Fe3+、Co2+、Ni2+,用流程图将它们分离并鉴别出来。
2、 在碱性介质中氯水能将Ni(OH)2氧化为NiO(OH),而在酸性介质中NiO(OH)又能将Cl-氧化为Cl2,两者是否矛盾,为什么?要求查不同介质中的标准电极电势值回答。
3、 有时氯水或溴水能将Co2+、Ni2+氧化为M2+,有时Co3+、Ni3+却可将HCl或HBr氧化为X2,这是否矛盾,为什么?要求查不同介质中的标准电极电势值回答。
4、 衣服上沾有铁锈时,常用草酸洗,试说明原因。
答:草酸可与铁锈发生氧化还原反应生成铁的可溶性盐而溶解。草酸为弱酸,不会对衣服造成伤害。
5、 在中滴加溶液时,为何刚开始有蓝色沉淀出现?
CoCl2溶液中逐滴加入NaOH溶液先生成蓝色Co(OH)Cl沉淀,继续加入NaOH溶液才生成粉红色沉淀,放置一段时间,Co(OH)2被空气氧化而成棕色。
6、 试解释:Fe3+能将I-氧化成I2,而[Fe(CN)6]3-则不能;[Fe(CN)6]4-能将I2还原成I-。而Fe2+不能。要求查标准电极电势值回答。
7、 总结并比较二价Fe、Co、Ni的氢氧化物的稳定性及Fe3+、Co3+、Ni3+氧化能力的大小。
答:二价氢氧化物的稳定性依次增强,其离子的氧化能力依次减弱
8、 实验室的硅胶干燥剂常用来指示其吸湿程度,这是基于的什么性质?
在硅胶中加入少量无水二氯化钴,制得的硅胶为蓝色硅胶,当硅胶在空气中吸收水以后,蓝色无水CoCl2转化为红色水合[Co(H2O)6]Cl2, 使蓝色硅胶变成 红色硅胶,表示硅胶已失去吸水作用,因此可以作为硅胶干燥剂的指示剂。
第二篇:铁、钴、镍实验报告
铁、钴、镍实验报告
一、实验目的
二、实验内容
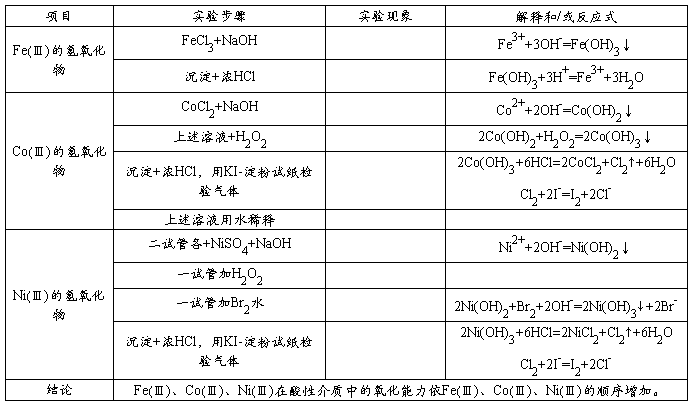
1、Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的氢氧化物的生成和性质
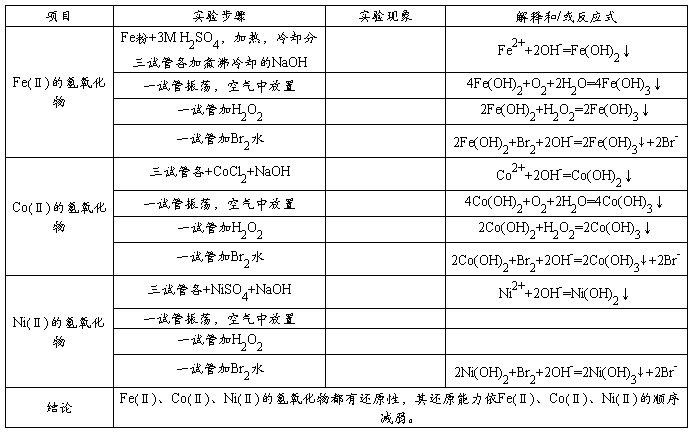
2、Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)的氢氧化物的生成和性质
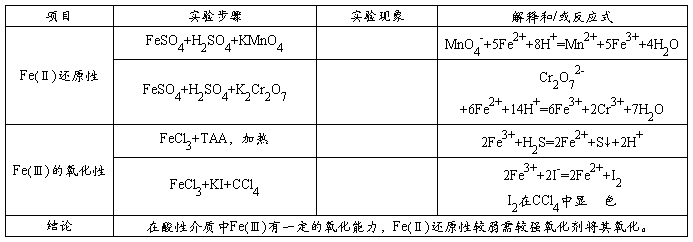
3、铁盐的氧化还原性
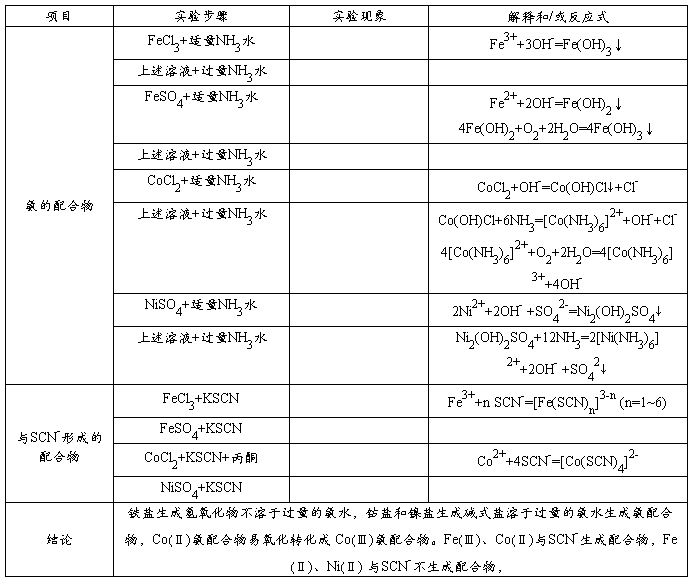
4、Fe、Co、Ni的配合物
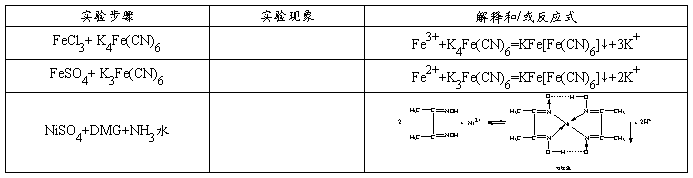
5、离子的鉴定
- 铁、钴、镍实验报告
- 第一过度系元素 铁钴镍实验报告
-
无机化学实验二十五 铁、钴、镍
实验二十五铁钴镍实验目的1试验并掌握二价铁钴镍的还原性和三价铁钴镍的氧化性2试验并掌握铁钴镍配合物的生成和Fe2Fe3Co2Ni2…
-
新实验十一 铁、钴、镍的性质
实验六铁钴镍的性质一实验目的12试验并掌握铁钴镍氢氧化物的生成和氧化还原性质试验并掌握铁钴镍配合物的生成及在离子鉴定中的作用二实验…
-
无机化学实验第四版实验24 铁钴镍
凡事贵在坚持实验24铁钴镍一实验目的12试验并掌握铁钴镍氢氧化物的生成和氧化还原性质试验并掌握铁钴镍配合物的生成及在离子鉴定中的作…
-
物理实验报告 铁磁材料的磁滞回线和基本磁化曲线
实验铁磁材料的磁滞回线及基本磁化曲线铁磁物质是一种性能特异用途广泛的材料如航天通信自动化仪表及控制等都无不用到铁磁材料铁钴镍钢以及…
-
铁磁材料动态磁滞回线的观测和研究的实验报告
铁磁材料动态磁滞回线的观测和研究的实验报告铁磁材料的磁滞回线和基本磁化曲线实验目的1认识铁磁物质的磁化规律比较两种典型的铁磁物质的…
-
用示波器观察铁磁材料的动态磁滞回线_实验报告
用示波器观察铁磁材料动态磁滞回线摘要铁磁材料按特性分硬磁和软磁两大类铁磁材料的磁化曲线和磁滞回线反映该材料的重要特性软磁材料的矫顽…
- 铁、钴、镍实验报告
- 第一过度系元素 铁钴镍实验报告