CIP清洁验证报告






第二篇:设备CIP清洁效果验证
一般情况下,1台设备做一个方案、出1份报告。
清洁的目的
1、清洁验证要达到的目的是:确认清洁方法和程序能够足以使污染物降低到“可接受”的水平。
有人认为清洁验证只是要对产品的残留进行评估,这不全面,清洁验证必须对所有污染物的残留进行评估。
2、污染物的种类
(1)物理性物质(可通过挑拣简单去除,不在验证讨论范围)
(2)化学性物质
(3)微生物
化学性物质又可分为:
①上批产品的残留物,包括主药和辅料。
②清洗液残留物。
③空气中和灰尘和微粒。
④润滑剂
⑤消毒剂
⑥清洗过程发生的分解产物(产品、清洁剂)
清洁验证主要围绕化学性污染物和微生物污染物进行。
验证方案
验证方案的内容应包括:
1.验证的目的
2.执行人和职责
3.使用设备的描述
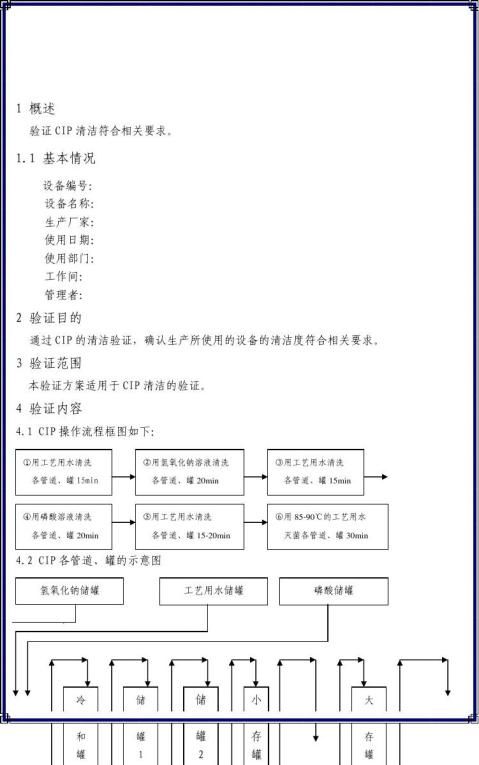
4.生产结束、清洁开始、清洁结束,生产再开始的时间间隔(要考虑设备在使用后到清洁前放置的最长时间,和清洁后到再次使用前的最长时间)
5.清洁SOP
6.监测设备
7.取样程序、方法和原理
8.取样位置
9.连续执行的清洁循环的次数
10.回收率研究的数据
11.分析方法(包括检测的限度和定量的限度)
12.可接受标准和确定的理由
13.QA的参与和领导层的批准
验证记录的报告
验证记录必须完整的清洁操作记录和具体操作者的签名,应该由生产管理人员检查并由QA人员审核。
验证记录必须由完整的检测结果的原始数据。
验证报告必须有结论
而且结论必须达到:所有的检测结果都符合可接受的标准
检查要点
1.验证人员:检查执行验证方案的人员是否具备足够资格和经验,是否经过培训(清洁方法。清洁SOP、检测方法等诸方面的培训),如果缺乏资格、缺乏经验、缺乏培训,则可以认为所做的验证是无效的。
手工清洁难以验证,但可以检查其熟练程度,可以检查其是否受过良好的培训(通过检查人员的清洁培训记录)
人员的清洁培训记录应该存档,验证报告中应该反映人员的培训情况以便查阅。
2.取样方法
通常的取样方法是擦拭法和淋洗液取样法,也有使用空白批法的
应检查企业是否将擦拭法和淋洗液取样法结合使用。
擦拭取样法:是直接取样法
优点:可对已经干燥的或不溶的残留物取样
缺点:一般来说最难清洁的地方也是最难擦到的地方,而设备通常总是有些地方无法擦到。而且只能假定污染物是在表面均匀分布(实际上不是这样)。另外就是必须用取样面积推算整个面积。
淋洗取样法:是间接取样法
优点:可对大面积、难达到的系统(如管路)或不能拆卸的部分进行取样。
缺点:可能会有残留物或污染物不溶解,或者虽然溶解了但残留在设备内(不能彻底排出)。
3.取样程序和取样位置
简单询问取样程序,了解企业是怎样确定最难清洁位置的。询问和检查取样位置(验证方案应该明确确定取样的具体位置)。
4.分析方法
检查分析方法是否能经过验证,或者有证据说明本方法是恰当适用的。
应检查方法的重现性或者回收率的一致性。
5.限度(即“可接受”标准)的设定
应检查企业限度的设定依据,企业设备的限度必须能够达到和能证实,必须符合逻辑基础
逻辑基础
1.产品的属性
2.成分的多样性
3.成分的剂量
4.成分的生物活性(或效力)
5.成分的毒性
6.成分的溶解度
应检查企业是否是选择难溶解的、低剂量、高活性、强毒性、难检测的成分设定限度的。 对高致敏性、高活性的物料,可能被要求使用最灵敏的方法也不能被要检出。 限度的通常三个标准:
1.目测清洁
2.在另一产品中含量小于10mg/kg
3.小于治疗剂量的0.1%
目测清洁总是第一标准
10mg/kg是药典中对重金属的限度标准
采用这个标准,是假定:残留物与重金属一样对人(畜)有害。但对有高活性的物料可能标准太宽。
企业要自己研究最差状况,确定清洁限度。
国家不会为具体产品设定限度标准。
-
万能粉碎机清洁验证报告
20B万能粉碎机清洁验证报告验证报告编号VRH00500广东和本堂科技制药有限公司1目录一验证报告1概述2验证目的3清洗程序4消毒…
-
清洁验证报告
一引言1概述贝诺酯合成车间生产设备均为专用型设备专门用于单一品种同一规格原料药的生产各类型设备均制定有详细完善的设备清洁规程和清洁…
-
02提取罐清洁验证报告
3TQ36M提取罐清洁验证报告TQ36M3提取罐清洁验证报告目录41验证小组成员与职责42验证结果评定与结论43验证周期44最终批…
-
直接接触药品容器具清洁验证报告
TECQJL008203液体车间直接接触药品容器具清洁再验证报告报告制定人日期年月报告审核人日期年月报告批准人日期年月日日日目录1…
-
清洁验证的风险评估报告
本报告属原创同发SFDA研修学院论坛药智论坛和中国GMP论坛以下为在做本报告中的体会1风险评估不在于形式如本评估报告可以不用单独成…
-
清洁验证的风险评估报告
本报告属原创同发SFDA研修学院论坛药智论坛和中国GMP论坛以下为在做本报告中的体会1风险评估不在于形式如本评估报告可以不用单独成…
-
清洁验证报告
一引言1概述贝诺酯合成车间生产设备均为专用型设备专门用于单一品种同一规格原料药的生产各类型设备均制定有详细完善的设备清洁规程和清洁…
-
GFG-500高效沸腾干燥机清洗验证方案及报告
清洗验证方案制药厂1验证方案的起草与审批234GFG500型高效沸腾干燥机用于多个产品颗粒的干燥生产为了防止交叉污染须对设备的清洗…
-
039-SYH-600型三维运动混合机清洗验证方案及报告
清洗验证方案制药厂目录1验证方案的起草与审批11验证方案的起草12验证方案的审批2验证小组成员名单3时间进度表4概述5验证目的6清…
-
清洁验证方案报告
1验证目的通过验证证明在正常生产结束后按CR600型冲击式粉碎机清洁标准操作规程进行清洁始终能清洁干净不会对下批产品造成污染从而确…