直接接触药品容器具清洁验证报告
TEC-QJ-L008(2)-03
液体车间直接接触药品容器具清洁再验证报告
报告制定人: 日期: 年 月 报告审核人: 日期: 年 月 报告批准人: 日期: 年 月
日 日 日

目录
1 概述???????????????????????????????????????2 2 范围???????????????????????????????????????2 3 验证目的?????????????????????????????????????2 4 计划及进度????????????????????????????????????2 5 验证组织及职责??????????????????????????????????2
5.1 验证委员会???????????????????????????????????2
5.2 工程设备部???????????????????????????????????2
5.3 质量管理部???????????????????????????????????2
5.4 生产技术部???????????????????????????????????3 6 文件确认 ?????????????????????????????????????3 7 验证结果及评价??????????????????????????????????3 8 验证结果评定与结论????????????????????????????????4 9 变更记载?????????????????????????????????????5 10 附录一 ?????????????????????????????????????5

1 概述
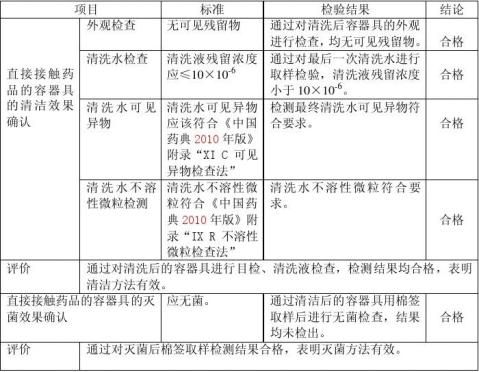
直接接触药品的容器具是否清洗、灭菌彻底对下一批产品的质量起到关键作用,为保证直接接触药品的容器具不对下一批产品产生交叉污染和微生物的污染,即使用清洗、灭菌后的容器具生产产品时没有来自上批次产品及清洁过程所带来污染的风险和微生物的污染的风险,我们对已按照清洁操作规程进行清洗、灭菌后的容器具的不同部位取样进行检验,检验结果表明清洁方法保证生产中不产生交叉污染和微生物的污染。 2 范围
此方案针对洁净区工器具清洁操作规程进行的验证。本清洁操作规程规定了液体车间洁净区工器具的清洗灭菌要求。
3 验证目的
通过此次验证活动,证明本公司洁净区工器具清洁操作规程能够保证洁净区工器具的清洁,防止发生污染与交叉污染。
4 计划及进度
根据验证的工作量,企业成立了验证委员会和验证小组。清洁验证小组组长由生产技术部主任担任,验证小组组长制定完整的验证方案,经验证委员会主任审核批准后实施。
5 验证组织及职责
5.1 验证委员会
负责验证方案的审批;
负责验证的协调工作,以保证本验证方案规定项目的顺利实施;
负责验证数据及结果的审核;
负责验证报告的审批;
5.2 工程设备部
负责组织试验所需的仪器、设备的验证;
负责仪器、仪表、量具等的校正。
5.3 质量管理部
负责各种理化检验、微生物检验的准备、取样及测试工作;
负责根据检验结果出具检验报告单;

负责验证工作的现场监督;
5.4 生产技术部
负责指定与药品直接接触容器具的清洁人员;
负责按照相关的标准清洁操作规程对清洁验证对象进行清洗、灭菌。
6文件确认
经确认本次验证所用仪表、计量器具均已校验合格且在有效期内,相应操作规程均为现行版操作规程。
统计人: 复核人: 统计时间:

8 验证结果评定与结论
8.1通过对清洁后的容器具进行外观、清洗液检查,对灭菌后容器具棉签取样进行无菌检验,结果都符合要求,证明直接接触药品的容器具的清洁方法是切实可行的。 8.2通过对直接接触药品容器具清洁再验证,清洁效果符合标准,确定再验证周期为二年。


10附录一
人员培训情况
第二篇:清洁验证报告
一 引言
1 概述
贝诺酯合成车间生产设备均为专用型设备,专门用于单一品种、同一规格原料药的生产,各类型设备均制定有详细、完善的设备清洁规程和清洁记录,在生产工艺过程中与成品质量关系密切的清洗过程包括:氯化反应罐、酯化反应罐、离心机、板框压滤机、脱碳过滤系统、精制结晶罐、洁净区离心机、干燥箱、粉碎机、二维混合机等设备的清洗。同时,对洁净区的清洁进行验证,确认洁净厂房的清洁效果。本验证即针对以上关键环节的清洁规程和清洁效果进行清洁验证。
2 目的
通过对反应罐、离心机、脱碳过滤系统、精制结晶罐、洁净区离心机、气流干燥、气流粉碎等设备清洗过程的检查和监测,证明已经制定的设备清洁规程切实可行,能够达到保证药品质量的目标,文件资料符合GMP的管理要求,并为设备清洁规程的进一步修改和完善提供资料和依据。
3 验证类别
本次验证为同步验证。
二 参考资料
本文件参考了以下标准和指南:
1.中华人民共和国药典(2010版)
2.GMP(20xx年修订版)
3.药品GMP指南
4.药品生产验证指南(2003版)
三 验证准备
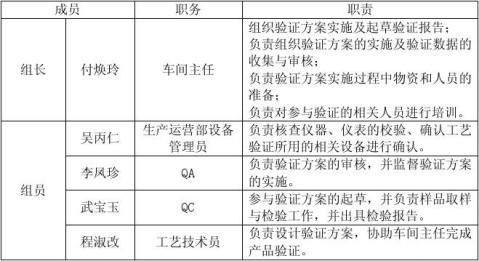
1 验证人员及职责
1.1 各部门的验证职责
质量负责人:
批准验证方案、验证报告。
生产负责人:
审核验证方案、验证报告。
生产运营部职责:
审核验证方案、验证报告。
提供公用系统保证。
提供设备维修保证。
针对不一致项界定解决办法。
负责测量仪器的校验,并提供校验证书。
生产车间职责:
起草、审核验证方案、验证报告。
组织实施验证方案。
收集相关数据,编写相关的验证报告。
对参与验证的人员完成必需的的培训。
指定操作人员,对生产设备进行操作,清洁和维护保养。
确定最终的SOP。
质量管理部职责:
负责审核验证方案。
负责监督严格按照验证方案及所依据文件规定方法和标准实施验证。
负责对验证过程中户县的偏差和变更评价和处理。
维护全部受控的文件符合法规。
负责制定相关的质量标准、检验规程和取样程序。
负责相关的取样及校验,并依据检验结果出具检验报告单。
审核验证结果、最终验证报告确保全部验收标准均得到满足。
验证完成合格后发放验证合格证。
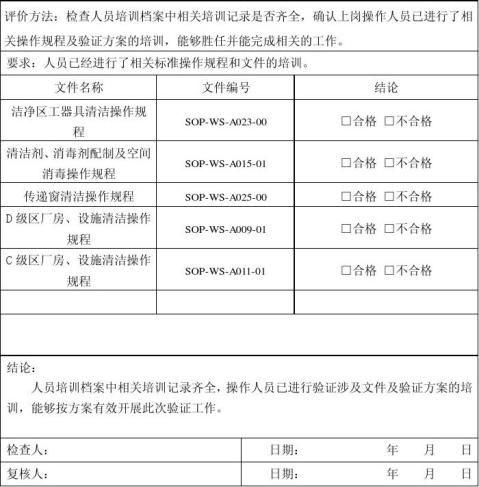
目的:确认所有参加验证的人员的都经过培训,确保验证顺利实施。
程序:在验证开始实施前,由验证方案起草人对所有参加验证的人员进行培训。 接受标准:参加验证的人员都接受了验证方案的培训。
确认记录:填写《培训确认》附表1,培训签到表附于验证报告后。
3 验证引用文件的确认
目的:确保用于支持本方案的所有文件为现行有效的文件。
程序:在验证开始实施前,由验证小组成员检查验证过程中所用到的文件,检查文件是否有资格的人起草、审核和批准且在执行期内。
接受标准:验证过程中所用文件均为有资格的人起草、审核和批准且在执行期内。 确认记录:填写《文件确认》附表2.
四 验证范围
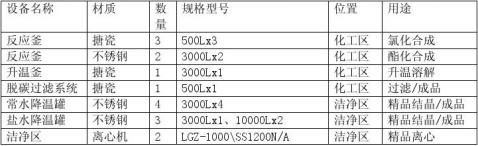
脱碳过滤系统、精制结晶罐、洁净区离心机、气流干燥、气流粉碎等设备的清洗过程。相同名称数量不为一个的设备其规格、型号、材质均相同,清洗方法相同,因此分别取一个进行清洁验证。

3.1验证小组
(1)起草验证方案;
(2)起草验证报告、确定再验证周期,对验证结果进行评价,报质量管理部审核。
3.2质量管理部
(1)根据验证对象成立验证小组;
(2)质量管理部负责验证方案的审核批准;
(3)质量管理部负责验证报告的审核批准;
(4)负责发放验证合格证书;
(5)负责再验证周期的确认;
(6)质量管理部QC化验室负责工艺过程中的取样及化验,并根据结果出具检验报告单。
3.3生产车间
(1)配合验证小组准备验证方案和总结报告;
(2)配合验证小组完成确认,检查验证项目是否完成;
(3)负责设备清洗工作。
4 清洁用品
清洗剂:甲苯、5%酸水溶液、5%碱水溶液、饮用水、纯化水、回收乙醇、75%乙醇。 洗涤工具:清洁布、不脱落纤维的清洁布、清洁盆、蛇皮管、不锈钢铲、长柄尼龙刷。
5 培训
验证方案实施人员应有相应岗位的上岗证明,参加过相关的SOP以及生产工艺、设备操作等必要的培训并考核通过。本方案审核批准实施后,首先组织相关人员进行培训。由清洁验证方案起草人对主要实施人员进行培训,各班组长对参与验证的本班组操作人员进行培训。(附贝诺酯设备清洁验证培训记录)
6清洗验证的风险分析:
6.1根据产品生产阶段及生产工艺的特点,分三个阶段对设备进行清洁验证:
①氯化反应为第一个阶段;
②酯化反应为第二个阶段;
③物料由进入洁净区开始到成品为第三阶段。
6.2 验证要求
由于合成车间设备是专用设备,因此:
①根据FDA的清洁验证指南,最基本的要求是目视清洁无可见物料、无可见残留。化工合成阶段设备目视清洁。
②需要评估清洗剂和清洗条件是否会导致残留物分解。如果分解的话,是否构成杂质。如果构成杂质,是否会对下一批次造成影响。
③需要评估清洁有效期。
④虽然是专用设备,但是为了保证批次的完整性,上一批成品到下一批成品的残留不应大于0.1%(对于中间体,没有这个要求)。

6.3 各个阶段设备的清洁程序描述及风险分析,具体的设备风险分析见清洁验证的第一部分:清洁验证前的风险分析报告。
第一阶段设备清洁:第一阶段设备包括一般生产区反应罐,第一阶段清洁剂为甲苯,甲苯清洗液(可回收)放出后,给罐升温,将罐烤干备用。因甲苯易挥发,没有残留可能。日常清洁后,清洁效果有效性的可接受标准为目视无残留,因此:
①对第一阶段设备日常清洁完成后,进行目视清洁检查。
②计划定义的清洁有效期为7天,反应中使用大量的强酸,因此微生物对工艺并不构成污染风险。所以,此次清洁验证无需检测微生物水平。
第二阶段设备清洁:第二阶段设备包括酯化反应罐、离心机、板框压滤机设备均为贝诺酯生产工艺合成的最后一步合成反应,因第二步为强碱反应,所以第二阶段设备一般清洁使用的清洁剂5%酸水,饮用水及纯化水。
① 对第二阶段设备日常清洁完成后,进行目视清洁检查。
②对于一般区离心机、板框压滤机,由于一般生产区离心机板框压滤机是专用于中间体的离心、压滤过程,根据FDA清洁验证指南要求,对于中间体,没有要求批次的完整性,所以目视清洁即可。
离心机滤袋及板框压滤机滤布无法进行微生物取样,且不存在微生物的污染,所以不对离心机滤袋及板框压滤机滤布进行微生物水平检测。
③计划定义的清洁有效期为7天。反应中使用大量的强碱,因此微生物对工艺并不构成污染风险,所以此次清洁验证无需监测微生物。
④由于彻底清洁前需执行一般清洁,所以,如果一般清洁的验证结果符合要求,那么,无需再对彻底清洁进行验证。
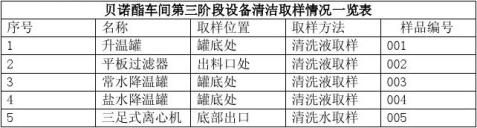
第三阶段设备清洁:第三阶段设备为洁净区内设备,包括精制结晶罐、洁净区离心机、洁净区干燥箱、洁净区粉碎机、洁净区二维混合机。设备均用于贝诺酯生产工艺中的精制、离心、干燥、粉碎、混合岗位。因贝诺酯不溶于水,精制用溶剂为乙醇,所以清洁剂为回收乙醇。溶剂乙醇为三级溶剂,而且贝诺酯产品从未出现过残留溶剂超标情况。清洁效果有效的可接受标准为目视无残留,贝诺酯的残留量不得超过下批批量的0.1%。因此, ① 对第三阶段设备日常清洁完成后,进行目视清洁检查。
② 第三阶段清洁从升温溶解脱色开始,具体操作见清洁操作规程。
③ 设备精制结晶罐上最难清洁的部分为罐盖处及搅拌上部;所以精制结晶罐监测点应包
括罐盖和搅拌上部,重复3次。
④ 洁净区离心机只需考察残留在滤袋上的物料重量是否超过允许量。(残留限度定义为残
留在滤袋上的物料重量不超过下批批量的0.1%)。根据生产经验,水分按照60%折算。 ⑤ 计划定义的清洁有效期为7天,洁净区的消毒频次为每半月对设备进行消毒,因此微
生物对工艺并不构成污染风险。由于无法对离心机滤袋进行取样,且从来没有观察到滤袋出现长霉现象。因此不对离心机清洁的有效期进行验证。
对干燥箱清洁过程进行擦拭取样。残留限度应符合标准要求;
对微粉碎机进行尘埃粒子监测,达到D及洁净要求即为合格;
二维混合机用乙醇清洁后取清洗液测试,符合规定。
7.清洗验证程序
7.1 需验证的关键部位
7.1.1 反应釜:
反应釜是车间关键的生产设备,反应釜主要由搅拌器、反应锅体及减速机三部分组成,难于清洗的部位见图示:
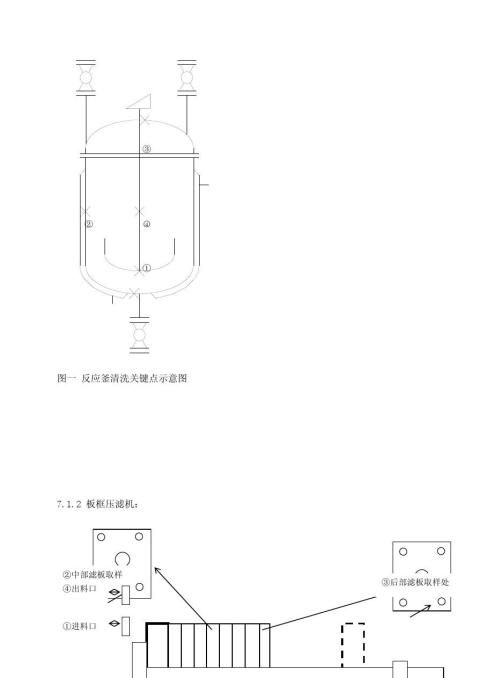
图二 板框压滤机清洗关键点示意图
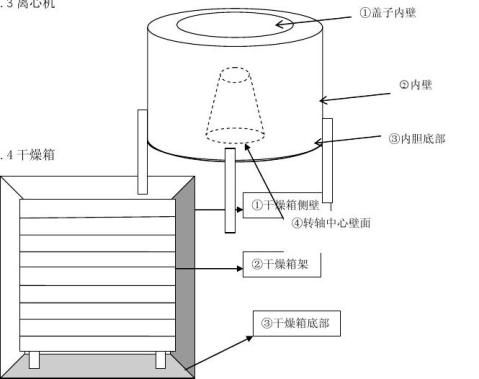
图四、干燥箱清洗关键点示意图
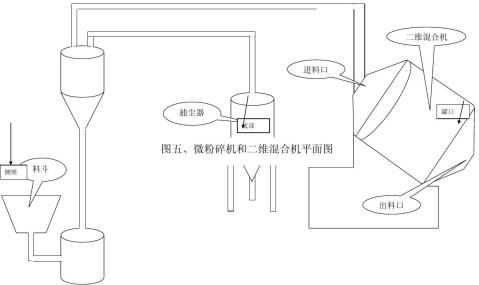
7.1.5微粉碎机与二维混合机见下图:图五
7.2 可接受标准
7.2.1 目视无残留
7.2.2 化学残留可接受限度:0.1%(对第一阶段化工区设备没有此要求) 生产的最小批量为158kg,最大允许残留量为:1/1000 ×158kg = 0.158g
7.2.2.1 擦拭法取样残留限度:
根据计算结果,最大允许残留量为0.158g,各个产品的内表面积一定,按产品平均分配到各个设备表面,其残留限量为:
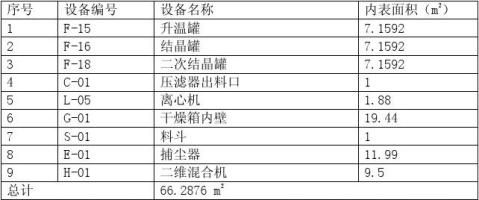
为158g,生产中物料接触设备的总面积为66.2876m2,按158g残留产品平均分配到各个设备表面,其残留限量为:
擦拭测试:擦拭面积以10㎝×10㎝的区域计
158g×1000
残留限量A=―――――――――×100㎝2×10%(保险系数)×70%(取样回收率) 66.2876m2×10000
=1.69㎎/㎝2
残留限度定为:1.69㎎/㎝2/25ml=0.0676mg/ml
对棉签溶出液照HPLC进行检测,计算残留浓度。
6.2.2.2 清洗液测试:清洁结束后,向结晶罐中加入约1500L的乙醇,升温搅拌至回流10分钟,将升温釜内乙醇压入常水降温罐,搅拌10分钟压入盐水降温罐,搅拌10分钟压入离心机冲洗离心机,最后乙醇流入地下槽;这样连续冲洗两遍,最后用75%乙醇冲洗一遍。在设备的出口处取样检测限度,其残留限量为:
158×1000
浓度限量B=―――――――×10%(保险系数)=0.0105㎎/ml
1500L×1000
对于清洗液取样,照HPLC检测方法计算残留浓度。对缩合罐、脱碳过滤系统的残留限量与结晶罐相同。
7.3 清洗剂的选择
清洁规程中规定使用的清洁溶剂为饮用水。精制过程中所用的材质为不锈钢,因此,擦拭法回收率验证使用的模具为10 cm×10cm的不锈钢片。取样工具为普通取样瓶500ml,普通药签15cm、具塞试管25 ml。取样方法包括药签擦拭法、清洗水取样。
7.4 清洁程序
7.4.1 第一阶段和第二阶段设备清洗验证程序。
7.4.1.1 根据第一阶段和第二阶段设备的清洗规程对第一阶和第二阶段内的设备进行清洗,包括氯化反应罐、酯化反应釜、离心机、板框压滤机、二次中和罐。填写相应的设备清洁验证记录。
7.4.1.2检查 清洗结束后由岗位操作人员填写设备清洁记录,由经培训的人员对设备进行目检,并填写《目检与取样记录》,由QA人员进行检查,检查内容包括:
a. 清洗是否严格按照规定的清洁规程进行清洁,并检查其清洁记录。
b. 设备清洗后是否有“已清洁”的状态标志。
c. 目测检查设备内外表面是否目视无残留,尤其应检查难清洗的部位。 检查完成后,由QA人员在目检与取样记录上签名认可。
重复进行三次验证。同种类型的设备随机取其中一个进行验证,但第二次及第三次验证时要取与第一次相同的设备。
第一阶段设备目视清洁即可可接受标准为设备清洁、无可见残留。
7.4.2 第三阶段设备清洗验证程序。
7.4.2.1 根据第三阶段设备清洁规程进行设备清洁,包括缩合罐及脱碳过滤系统。
7.4.2.2清洁效果评价:
(1)目视无残留。
(2)棉签所取样品最后的测试浓度≤0.0676mg/ml。
(3)清洗水的浓度≤0.0105mg/ml
7.4.2.3检查
清洗结束后由操作人员填写设备清洁记录,然后由经过培训的人员进行检查清洁是否符合要求,并填写《目检与取样记录》,由专职质量管理人员负责检查,内容包括:
①清洗是否严格按照清洗程序进行清洁,检查清洗记录。
②清洗后设备是否有“已清洁”的状态标志。
③检查设备内外表面是否目视无残留,尤其对清洁关键点进行检查。
④检查完成后由QA人员签字认可。
⑤由接受过培训的车间操作人员依照取样规则表进行取样,做好标识。
7.4.2.4取样位置:
平板过滤器出料口、一级结晶罐罐底、二级结晶罐罐底、离心机、二维混合机出料口采用乙醇清洗,取淋洗液方法进行取样,重复三次。同种设备选取其中一个进行验证,第二次和第三次验证的设备与第一次设备为同一设备。连续验证三个批次。
8.1取样方法
8.1.1取样工具:普通取样瓶500ml,普通药签15cm、具塞试管25 ml。
8.1.2 取样方法包括药签擦拭法、淋洗法取样。
药签擦拭法:取样面积:10cm×10cm(用不锈钢片制作一个内径为10cm×10cm的取样模具)。将模具贴于设备(三足离心机、不锈钢料盘、捕尘器、二维混合机)中上述图示的清洁关键点的内表面,生产结束清洁完成后,在其内壁上用蘸有溶液的棉签平稳而缓慢的擦拭,在向前移动的同时,将其从一边移动到另一边。翻转药签,让药签的另一面也进行擦拭,与前次擦拭移动方向垂直,擦拭过程应覆盖整个表面(擦拭示意图见下图)。4个棉签共擦拭100cm2。擦拭完后,用溶液将4个棉签上的样品溶出25ml溶出液,并及时贴上标签,标明取样日期。 擦拭法取样示意图
淋洗法取样:根据设备本身的特点及取样方法的特性,对反应釜等不易于采用擦拭法的设备采用淋洗法取样,待设备清洁结束后,取500L的溶液淋洗设备内部,重点淋洗上述关键的验证部位。于设备下端,接淋洗水样,置于样品瓶中。及时贴上标签,标明取样人和取样日期。取样结束,用纯化水将设备内部冲洗干净。
8.2.检测方法
8.2.1 目测检查:按照清洁规程进行清洁后,立即进行目测检视,设备内、外表面应无可见残留物。
8.2.2化学残留量检测,
淋洗法检测:取洗淋水置于比色皿中,做为供试品溶液,精确取淋洗液100ml,过滤,取10μl注入高效液相色谱仪,按HPLC法检测。
用擦拭法检测:取药签溶出液置比色皿中,精确取洗淋液100ml,过滤,取10μl注入高效液相色谱仪,按HPLC法检测。
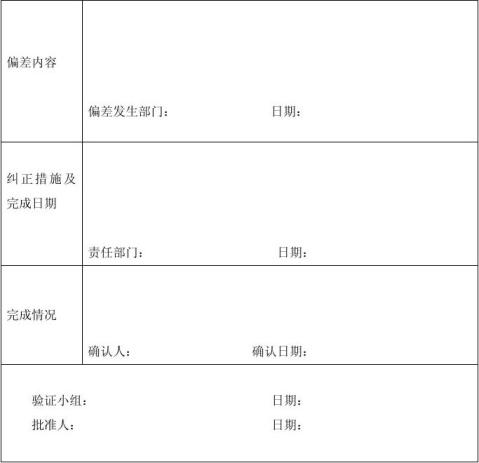
9.验证结论和偏差记录
验证完成之后,分析验证数据并得到验证结论。
9.1再验证:发生以下情况需进行再验证
1.设备发生重大变更,其清洁方法发生了改变进行。
2. 生产其它产品,进行换品种清洁验证。
10.备注
清洁有效期的验证
根据生产的实际情况,贝诺酯原料药生产线为连续生产,清洁前设备存放的时间不超过24小时,正常情况下,清洁后存放的时间不长于1天,清洁的标准操作规程中一般定义清洁有效期为7天, 由于清洁有效期的验证所需时间较长,且实际生产中没有出现过微生物滋生的情况,所以本次不对清洁有效期进行验证,将于20xx年大修期间进行清洁有效期的验证。
监测结果见附表:

附件2
分析结果
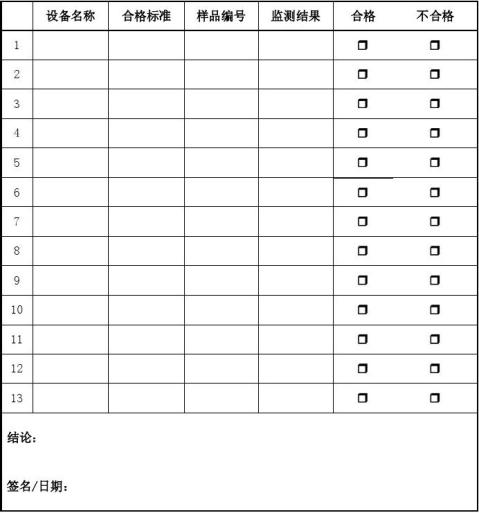
附表3
偏 差 表
-
万能粉碎机清洁验证报告
20B万能粉碎机清洁验证报告验证报告编号VRH00500广东和本堂科技制药有限公司1目录一验证报告1概述2验证目的3清洗程序4消毒…
-
02提取罐清洁验证报告
3TQ36M提取罐清洁验证报告TQ36M3提取罐清洁验证报告目录41验证小组成员与职责42验证结果评定与结论43验证周期44最终批…
-
直接接触药品容器具清洁验证报告
TECQJL008203液体车间直接接触药品容器具清洁再验证报告报告制定人日期年月报告审核人日期年月报告批准人日期年月日日日目录1…
-
清洁验证的风险评估报告
本报告属原创同发SFDA研修学院论坛药智论坛和中国GMP论坛以下为在做本报告中的体会1风险评估不在于形式如本评估报告可以不用单独成…
- CIP清洁验证报告
-
清洁验证的风险评估报告
本报告属原创同发SFDA研修学院论坛药智论坛和中国GMP论坛以下为在做本报告中的体会1风险评估不在于形式如本评估报告可以不用单独成…
-
清洁验证报告
一引言1概述贝诺酯合成车间生产设备均为专用型设备专门用于单一品种同一规格原料药的生产各类型设备均制定有详细完善的设备清洁规程和清洁…
-
GFG-500高效沸腾干燥机清洗验证方案及报告
清洗验证方案制药厂1验证方案的起草与审批234GFG500型高效沸腾干燥机用于多个产品颗粒的干燥生产为了防止交叉污染须对设备的清洗…
-
039-SYH-600型三维运动混合机清洗验证方案及报告
清洗验证方案制药厂目录1验证方案的起草与审批11验证方案的起草12验证方案的审批2验证小组成员名单3时间进度表4概述5验证目的6清…
-
清洁验证方案报告
1验证目的通过验证证明在正常生产结束后按CR600型冲击式粉碎机清洁标准操作规程进行清洁始终能清洁干净不会对下批产品造成污染从而确…