物理化学实验燃烧热的测定数据处理
南昌大学物理化学实验燃烧热的测定实验报告数据处理 已知苯甲酸的燃烧热为-26460J/g,
实验测得:苯甲酸0.9738g
萘 0.8914 g
仪器热容量:10416.32J/K
弹筒发热量:40071.40J/g
由-W(样品)Qv-qb=K(t2-t1)得
对苯甲酸:-0.9738x(-26460)-qb=10416.32Δt 对 萘:-0.8914Qv萘-qb=10416.32Δt
解得:Qv萘=-28905.9J/g=-28905.9 J/gx128g/mol
=-3699955.2J/mol
C10H8(s)+12O2(g)=10CO2(g)+4H2O(l),所以Δn=10-12=-2 Qp=Qv+ΔnRT
=-3699955.2J/mol+(-2)x8.314x(273.15+25) =-3704.9KJ/mol
萘的恒压燃烧热标准值为-5153.8kJ/mol
然后计算相对误差。
第二篇:实验一、燃烧热的测定实验数据处理示例
实验一、燃烧热的测定(氧弹法)
实验数据处理示例
实验数据处理示例1
(一)量热计热容(水当量)的测定
实验数据如下:
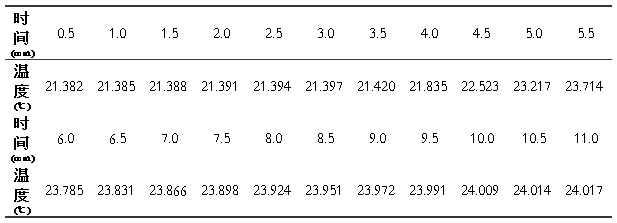
 样品(苯甲酸)质量m=0.8562g;
样品(苯甲酸)质量m=0.8562g;
其燃烧值为:
-26460 J/g×0.8562g=-22655.05J
作图如下:
由图可得:
DT=23.714-21.430 =2.284,
∵ l Ql≈0, ∴ -nQV-l Ql = c ΔT
C =-n QV /ΔT
计算得:量热计热容为c=(22655.05 J)/2.284 = 9919.02 J/K。
(二)蔗糖燃烧热的测定
实验数据如下:

萘的质量为:m = 1.1302 g
 图如下:
图如下:
测得:DT=1.886 K; c = 9919.02 J/K 蔗糖M=342 g/mol
计算得萘的燃烧热为:
-(W样/M样)QV = C量×ΔT
QV =-(C量×ΔT)×(M样/ W样)= -5660844.9 J/mol = -5660.8 kJ/mol
(三)结果讨论与分析
实验结果偏大,可能是忽略了铁丝的燃烧值引起的。
实验数据处理示例2
实验数据:


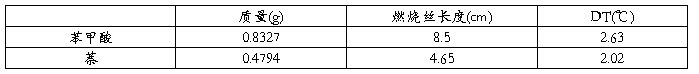
由苯甲酸燃烧计算出热量计的水的总当量:8386.78
再由图2可以计算出萘的恒容燃烧热为:35310.42J/g,
-
导热系数的测量实验报告
导热系数的测量实验目的用稳态法测定出不良导热体的导热系数并与理论值进行比较实验仪器导热系数测定仪铜康导热电偶游标卡尺数字毫伏表台秤…
-
导热系数的测定(完整版+空白打印版+真实实验数据)
深圳大学实验报告课程名称大学物理实验一实验名称实验14导热系数的测定学院专业课程编号组号指导教师报告人学号实验地点实验时间201年…
-
导热系数的测定实验报告模板
深圳大学实验报告课程名称大学物理实验一实验名称导热系数的测定学院专业组号报告人学号实验地点科技楼908实验时间年月日星期实验报告提…
-
导热系数的测定实验报告模板
深圳大学实验报告课程名称大学物理实验一实验名称学院专业组号指导教师报告人学号实验地点实验时间年月星期实验报告提交时间201年月日
-
固体导热系数的测定实验报告
学生物理实验报告实验名称固体导热系数的测定学院专业班级报告人学号同组人学号理论课任课教师实验课指导教师实验日期报告日期实验成绩批改…
-
大学物理化学实验报告-燃烧热的测定
物理化学实验报告院系化学化工学院班级化学061学号13姓名实验名称燃烧热的测定日期20##.5.20同组者姓名室温气压成绩一、目的…
-
物化实验报告燃烧热的测定
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目燃烧热的测定实验类型验证设计综合实验时间20xx年…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
华师物化实验报告 燃烧热的测定
华南师范大学实验报告学生姓名学号专业年级班级课程名称实验项目燃烧热的测定实验类型验证设计综合实验时间年月日实验指导老师实验评分一实…
-
燃烧热的测定实验报告
浙江万里学院生物与环境学院化学工程实验技术实验报告实验名称燃烧热的测定1一实验预习30分1实验装置预习10分年月日指导教师签字成绩…
-
物化实验报告4-燃烧焓的测定
一实验目的1用氧弹量热计测定萘的摩尔燃烧焓2了解热量计中主要部分的作用掌握氧弹量热计的实验技术二实验原理燃烧反应系统中的气体可视为…