初三化学第二单元总结
《我们周围的空气》知识点梳理
一. 空气
1. 空气是由什么组成的
① 法国化学家拉瓦锡通过实验得出结论:
空气主要是由氮气和氧气组成的结论,其中氧气约占1/5。
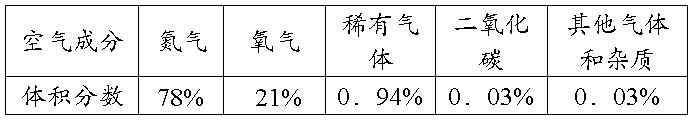
②空气的主要成分和组成:

2.混合物和纯净物
(1)纯净物:只由一种物质组成。如氮气、氧气、二氧化碳等是纯净物。
(2)混合物:由两种或多种物质混合而成的物质。如空气、海水是混合物。
【注意】组成混合物的各种成分之间没有发生化学反应,它们各自保持着原来的性质
纯净物可以用专门的化学符号表示。
(3)常考的纯净物与混合物
①纯净物:冰水混合物、干冰、蒸馏水、五氧化二磷等具体的物质······
②混合物:空气、自来水、矿泉水、海水、石灰石、石灰水、所有的溶液····
3. 空气是一种宝贵的资源

4.保护空气
(1) 空气中的有害物质
① 有害气体:二氧化硫、一氧化碳、二氧化氮
② 烟尘(可吸入颗粒物)
(2)空气污染的危害:损害人体健康,影响作物生长,破坏生态平衡,导致全球气候变暖、臭氧层破坏和酸雨等。
(3)保护空气的措施:加强大气质量监测,改善环境状况,使用清洁能源,
工厂的废气经处理过后才能排放,积极植树造林、种草等。
(4)空气质量日报、预报:根据我国空气污染的特点和污染防治重点,目前计入空气污染指数的项目暂定为:二氧化硫、一氧化碳、二氧化氮、可吸入颗粒物和臭氧等。(注意:二氧化碳没有在该项目内)
5.测定空气中氧气的含量

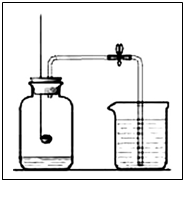
(1)实验原理:利用过量的红磷在盛有空气的集气瓶中燃烧,(使集气瓶中气体体积减小,压强减小),观察集气瓶中进水的多少,来测定空气中氧气的体积分数。
(2)实验现象:①红磷燃烧时产生大量白烟;
②烧杯中的水沿导管进入集气瓶里,集气瓶内水面上升了约1/5体积。
(3)实验结论: O2约占空气体积的1/5
(4)实验注意事项:①装置不能漏气; ②红磷要过量;③待装置冷却到室温后,再打开弹簧夹。
(5)实验探究:①液面上升小于1/5原因:
A. 红磷量不足,使瓶内氧气未耗尽;
B. 瓶塞未塞紧,使外界空气进入瓶内;
C. 未冷却至室温就打开瓶塞,使进入瓶内水的体积减少。
② 能否用铁、铝代替红磷?不能 原因:铁、铝不能在空气中燃烧
能否用碳、硫代替红磷?不能 原因:产物是气体,不能产生压强差
二. 氧气
1.物理性质:通常状况下是无色、无味的气体,不易溶于水,密度比空气略大。
在压强为101kpa时,氧气在-183℃时变为淡蓝色液体,在-218℃时变为淡蓝色雪花状固体。
2. 化学性质:氧气是一种化学性质较活泼的气体,
在一定条件下可与许多物质发生化学反应,同时放出热量。
(1)氧气的助燃性
带火星的木条在氧气中能够复燃,说明氧气能支持燃烧。常用这种方法检验氧气。
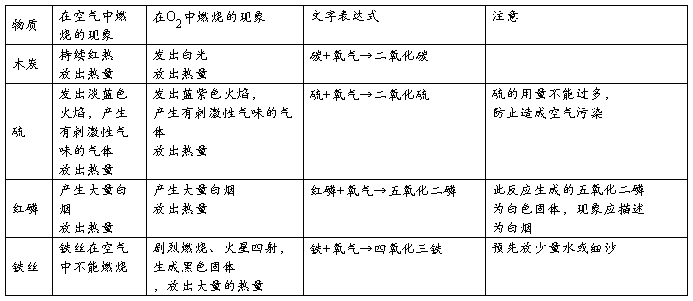
(2)物质在空气和氧气中的燃烧现象的比较
三. 制取氧气
1. 实验室制取氧气

(1)催化剂:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都不发生变化的物质。
催化作用:催化剂在化学反应中所起的作用。
(2)化合反应、氧化反应、缓慢氧化、分解反应
①化合反应:由两种或两种以上物质生成另一种物质物质的反应。
②分解反应:由一种反应物生成两种或两种以上其他物质的反应。
③氧化反应:物质与氧发生的反应。
④缓慢氧化:有些氧化反应进行的很慢,甚至不容易被察觉,这种氧化反应叫做缓慢氧化。
注意:化合反应与氧化反应的关系:化合反应不一定是氧化反应,氧化反应也不一定是化合反应。有氧气参加的化合反应,同时也一定是一个氧化反应。氧化反应不一定是要物质与氧气发生反应。
2. 高锰酸钾制取氧气的步骤及注意事项

3. 检验所收集的气体的方法:
把带火星的木条伸入集气瓶内,如果木条复燃,说明瓶内的气体是氧气。
4. 验满方法:
①用向上排空气法收集时:用带火星的木条放在集气瓶口,如果木条复燃,说明瓶内的氧气已满;
②用排水法收集时:当气泡从瓶口冒出时,说明瓶内的氧气已满。
5. 氧气的工业制法
分离液态空气(物理变化)
第二篇:初三化学第二单元总结
《我们周围的空气》知识点梳理
一. 空气
1. 空气是由什么组成的
① 法国化学家拉瓦锡通过实验得出结论:
空气主要是由氮气和氧气组成的结论,其中氧气约占1/5。
②空气的主要成分和组成:
2.混合物和纯净物
(1)纯净物:只由一种物质组成。如氮气、氧气、二氧化碳等是纯净物。
(2)混合物:由两种或多种物质混合而成的物质。如空气、海水是混合物。
【注意】组成混合物的各种成分之间没有发生化学反应,它们各自保持着原来的性质
纯净物可以用专门的化学符号表示。
(3)常考的纯净物与混合物
①纯净物:冰水混合物、干冰、蒸馏水、五氧化二磷等具体的物质······
②混合物:空气、自来水、矿泉水、海水、石灰石、石灰水、所有的溶液····
3. 空气是一种宝贵的资源

4.保护空气
(1) 空气中的有害物质
① 有害气体:二氧化硫、一氧化碳、二氧化氮
② 烟尘(可吸入颗粒物)
(2)空气污染的危害:损害人体健康,影响作物生长,破坏生态平衡,导致全球气候变暖、臭氧层破坏和酸雨等。
(3)保护空气的措施:加强大气质量监测,改善环境状况,使用清洁能源 工厂的废气经处理过后才能排放,积极植树造林、种草等。
 (4)空气质量日报、预报:根据我国空气污染的特点和污染防治重点,目前计入空气污染指数的项目暂定为:二氧化硫、一氧化碳、二氧化氮、可吸入颗粒物和臭氧等。(注意:二氧化碳没有在该项目内)
(4)空气质量日报、预报:根据我国空气污染的特点和污染防治重点,目前计入空气污染指数的项目暂定为:二氧化硫、一氧化碳、二氧化氮、可吸入颗粒物和臭氧等。(注意:二氧化碳没有在该项目内)
5.测定空气中氧气的含量
(1)实验原理:利用过量的红磷在盛有空气的集气瓶中燃烧,(使集气瓶中气体体积减小,压强减小),观察集气瓶中进水的多少,来测定空气中氧气的体积分数。
(2)实验现象:①红磷燃烧时产生大量白烟;
②烧杯中的水沿导管进入集气瓶里,集气瓶内水面上升了约1/5体积。
(3)实验结论: O2约占空气体积的1/5
(4)实验注意事项:①装置不能漏气; ②红磷要过量;③待装置冷却到室温后,再打开弹簧夹。
(5)实验探究:①液面上升小于1/5原因:
A. 红磷量不足,使瓶内氧气未耗尽;
B. 瓶塞未塞紧,使外界空气进入瓶内;
C. 未冷却至室温就打开瓶塞,使进入瓶内水的体积减少。
② 能否用铁、铝代替红磷?不能 原因:铁、铝不能在空气中燃烧
能否用碳、硫代替红磷?不能 原因:产物是气体,不能产生压强差
二. 氧气
1.物理性质:通常状况下是无色、无味的气体,不易溶于水,密度比空气略大。
在压强为101kpa时,氧气在-183℃时变为淡蓝色液体,在-218℃时变为淡蓝色雪花状固体。
2. 化学性质:氧气是一种化学性质较活泼的气体,
在一定条件下可与许多物质发生化学反应,同时放出热量。
(1)氧气的助燃性
带火星的木条在氧气中能够复燃,说明氧气能支持燃烧。常用这种方法检验氧气。
(2)物质在空气和氧气中的燃烧现象的比较

三. 制取氧气
1. 实验室制取氧气

(1)催化剂:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都不发生变化的物质。
催化作用:催化剂在化学反应中所起的作用。
(2)化合反应、氧化反应、缓慢氧化、分解反应
①化合反应:由两种或两种以上物质生成另一种物质物质的反应。
②分解反应:由一种反应物生成两种或两种以上其他物质的反应。
③氧化反应:物质与氧发生的反应。
④缓慢氧化:有些氧化反应进行的很慢,甚至不容易被察觉,这种氧化反应叫做缓慢氧化。
注意:化合反应与氧化反应的关系:化合反应不一定是氧化反应,氧化反应也不一定是化合反应。有氧气参加的化合反应,同时也一定是一个氧化反应。氧化反应不一定是要物质与氧气发生反应。
2. 高锰酸钾制取氧气的步骤及注意事项

3. 检验所收集的气体的方法:
把带火星的木条伸入集气瓶内,如果木条复燃,说明瓶内的气体是氧气。
4. 验满方法:
①用向上排空气法收集时:用带火星的木条放在集气瓶口,如果木条复燃,说明瓶内的氧气已满;
②用排水法收集时:当气泡从瓶口冒出时,说明瓶内的氧气已满。
5. 氧气的工业制法
分离液态空气(物理变化)
化学实验现象描述的常见错误
一、实验现象描述中夹带生成物名称
生成物的名称是通过实验、经过分析,推断得出的。在描述实验现象时,不要夹带生成物名称。实验现象是描述人通过感觉器官(如:眼、耳、鼻等)所感知的现象。如:锌与稀硫酸反应的现象不能描述成“生成了氢气”,而应描述成“产生气泡,锌粒逐渐消失”。再如:碱式碳酸铜受热分解的反应现象描述,不能叙述成“生成黑色氧化铜,同时生成水和二氧化碳”,而应叙述成“绿色粉末逐渐变黑,试管内壁出现无色液珠,同时生成一种能使澄清石灰水变浑浊的气体”。物质的颜色、状态、气味等人可以感知,而物质的结构、组成却是不能被感知的。
二、“烟”、“雾”不分在化学中,“烟”是固体小颗粒,“雾”是液体微滴。例如,磷在氧气中燃烧生成五氧化二磷时,其实验现象不能称为“产生白雾”,而应该说“产生大量浓白烟”。再如,打开装浓盐酸的瓶塞,实验现象应描述为“白雾”,而不能说“白烟”,因为看到的是盐酸中挥发出的氯化氢气体与空气中水蒸气结合形成了盐酸小液滴。
三、“发光”与“火焰”混用
物质燃烧时,一般都产生火焰或发光,但要注意正确区分二者,不要张冠李戴。
“发光”是指固体微粒被灼热的结果,说白了就是没有产生火苗。如下面实验现象描述:点燃镁带称为“耀眼的白光”,铁丝在氧气中燃烧称为“火星四射”。
“火焰”是气体燃烧时伴生的现象,即平常所说的“火苗”。如:硫在氧气中燃烧,硫先汽化再燃烧,现象描述为“明亮的蓝紫色火焰”,氢气在氧气中燃烧称为“淡蓝色火焰”。
四、顾此失彼,现象描述不全面
化学反应现象十分复杂,有些现象易被忽视,因此描述实验现象,要仔细全面,不要顾此失彼。例如:描述物质燃烧现象,要唱好“三部曲”。即先描述发光(或火焰)的颜色,再描述放出热量,最后再描述生成物颜色、状态、气味等。
五、用词不当描述化学实验现象时,如用词不当,也不能准确描述实验现象。例如:向澄清石灰水中通入二氧化碳后“出现白色沉淀”,这样描述就不妥当,因为看到的只是“澄清石灰水变浑浊”,而不是“出现白色沉淀”。
-
人教版初三化学第二单元总结
第二单元我们周围的空气课题一空气一拉瓦锡用定量的方法研究空气的成分1原理汞Hg氧气O2氧化汞HgO氧化汞汞氧气2实验现象银白色的液…
-
初三化学上册第二单元知识点总结
第二单元我们周围的空气课题1空气一法国科学家拉瓦锡用定量的方法研究了空气的成分通过实验得出空气是由氧气和氮气组成的其中氧气约占空气…
-
初三化学第二单元总结
我们周围的空气知识点梳理一空气1空气是由什么组成的法国化学家拉瓦锡通过实验得出结论空气主要是由氮气和氧气组成的结论其中氧气约占15…
-
初三化学第二单元总结
第二单元总结空气的研究两百多年前法国化学家拉瓦锡用定量的方法研究了空气的成分拉瓦锡经实验得出的结论空气由氧气和氮气组成其中氧气约占…
-
人教版初三化学第二章知识点总结
第二单元我们周围的空气课题1空气一空气成分的研究史118世纪70年代瑞典科学家舍勒和英国的科学家化学家普利斯特里分别发现并制得了氧…
-
人教版九年级初三化学知识点总结第一二章
绪言化学使世界变得更加绚丽多彩1原子论道尔顿和分子学说阿伏加德罗的创立奠定了近代化学的基础物质是由原子和分子构成的分子的破裂和原子…
-
人教版初三化学第二章知识点总结
第二单元我们周围的空气课题1空气一空气成分的研究史法国科学家拉瓦锡最早运用天平作为研究化学的工具用定量的方法研究了空气的成分第一次…
-
初中化学第一二单元知识点总结
第一单元走进化学世界基础知识回顾1化学是研究物质的的科学学习化学的一个重要途径是是科学探究的重要手段2物质是由和构成的分子的和的重…
-
初三化学上册第二单元知识点总结
第二单元我们周围的空气课题1空气一法国科学家拉瓦锡用定量的方法研究了空气的成分通过实验得出空气是由氧气和氮气组成的其中氧气约占空气…
-
新课标九年级上册化学第二单元知识点总结
第二单元我们周围的空气课题1空气考试要求知道空气的主要成分认识空气对人类生活的重要作用了解大气污染的原因及其危害能从组成上区分纯净…