纸层析法分离氨基酸
纸层析法分离氨基酸
姓名:敖礼贤 学号:5602212013 班级:生物工程121
一、前言
1、研究意义与前景
层析法是利用混合物中各组分物理化学性质的差异(如吸附力、分子形状及大小、分子亲和力、分配系数等),使各组分在两相(一相为固定的,称为固定相;另一相流过固定相,称为流动相)中的分布程度不同,从而使各组分以不同的速度移动而达到分离的目的。【1】
纸层析法(paper chromatography)是生物化学上分离、鉴定氨基酸混合物的常用技术,可用于蛋白质的氨基酸成分的定性鉴定和定量测定;也是定性或定量测定多肽、核酸碱基、糖、有机酸、维生素、抗菌素等物质的一种分离分析工具。纸层析法是用滤纸作为惰性支持物的分配层析法,其中滤纸纤维素上吸附的水是固定相,展层用的有机溶溶剂是流动相。【2】
分配层析法 分配色谱系色谱法之一种,利用固定相与流动相之间对待分离组分溶解度的差异来实现分离。分配色谱的固定相一般为液相的溶剂,依靠图布、键合、吸附等手段分布于色谱柱或者担体表面。分配色谱过程本质上是组分分子在固定相和流动相之间不断达到溶解平衡的过程。【3】
2、实验目的
(1)掌握分配层析的原理,学习氨基酸纸层析法的操作技术(包括点样、平衡、展层、显色、鉴定及定量)
(2)学习未知样品的氨基酸成分(水解、层析及鉴定)分析的方法。
3、实验原理
层析法也称色谱法,是1906年俄国植物学家Michael Tswett发现并命名的。他将植物叶子的色素通过装填有吸附剂的柱子,各种色素以不同的速率流动后形成不同的色带而被分开,由此得名为“色谱法”(Chromatography) 。 后来无色物质也可利用吸附柱层析分离。 1944年出现纸层析。以后层析法不断发展,相继出现气相层析、高压液相层析、薄层层析、亲和层析、凝胶层析等。 层析法是利用混合物中各组分物理化学性质的差异(如吸附力、分子形状及大小、分子亲和力、分配系数等),使各组分在两相(一相为固定的,称为固定相;另一相流过固定相,称为流动相)中的分布程度不同,从而使各组分以不同的速度移动而达到分离的目的。
按层析过程的机理分类:
吸附层析:利用吸附剂表面对不同组分吸附性能的差异,达到分离鉴定的目的。
分配层析:利用不同组分在流动相和固定相之间的分配系数不同,使之分离。
离子交换层析:利用不同组分对离子交换剂亲和力的不同。
凝胶层析:利用某些凝胶对于不同分子大小的组分阻滞作用的不同
纸层析法是用滤纸作为惰性支持物的分配层析法,它是利用不同的氨基酸在展层溶剂中的分配系数不同而得以分离的一种方法。惰性支持物是新华一号滤纸,其上含有很多的羟基,与水有较强的亲和力因此把它看成是含有静止水相的惰性支持物。水相因此称为静止相(固定相),有机溶剂称为流动相。展层溶剂由两个互不相溶的有机溶剂和水组成,它们互相混合时便分成两相:一相是以水饱和了的有机相,另一相是以有机溶剂饱和了的水相。
分配系数(α)=溶质在固定相的浓度(CS)/溶质在流动相的浓度(CL)
当用滤纸进行分配层析时,流动相流经支持物时与固定相之间连续抽提,使氨基酸在两相之间不断分配而得以分离。分配层析的原理可用一个模式解释(英国Martin等):把滤纸看成是一个层析柱,可以分成若干层板,设层板的物质为A、B;且A和B的分配系数(α)分别为1和1/3;又设固定相为S,流动相为L,两相互相接触但不相混溶。当第一层流动相中加入一定量的A、B两项物质后,溶质根据各自的分配系数在第一层的两相中分配,流动相继续在流动,此时第一层固定相与新流到的流动相之间以及原来第一层流动相与第二层固
定相之间进行第二次分配,以此类推三次分配即可看出A与B最浓部分以分开,A在第二层最浓,B在第三层最浓,如果继续抽提下去,经过若干此后,A、两物质便可完全分开。显然,分配系数越大的,则越易分开。
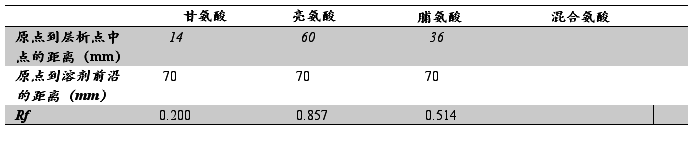
物质被分离后在纸层析图谱上的位置是用Rf值(比移值)来表示的:
Rf=原点到层析点中心的距离/原点到溶剂前沿的距离
在一定的条件下某种物质的Rf值是常数。Rf值的大小与物质的结构、性质、溶剂系统;层析滤纸的质量和层析温度等因素有关。本实验利用纸层析法分离氨基酸。
无色物质的层析图谱可用光谱法或显色法鉴定。本实验采用茚三酮为显色剂。茚三酮显色反应受温度、 ph、时间影响较大。如果要使结果重复,必须严格控制上述条件。
二、实验材料与方法
1、实验试剂
1. 氨基酸标准液(1mg/ml)
四种氨基酸是甘氨酸、亮氨酸、脯氨酸、混合氨酸分别配置成一定浓度的溶液
2. 80%甲酸
3. 0.5%茚三酮溶液
4. 氨基酸混合液
5. 正丁醇
2、实验器材
1. 新华滤纸
2. 培养皿
3. 电热鼓风干燥箱
4. 点样管及点样架
5. 针、线、尺
6. 烧杯
7. 钟罩
3、实验操作
(一)标准氨基酸纸上层析
1、单向上行层析
(1)氨基酸Rf值的测定
A、 滤纸:选用国产新华1号滤纸,28cmX28cm,在距纸边2cm处,用铅笔轻轻划一条线,于线上每隔3cm处画一小圆圈作为点样处,圈直径不超过0.5cm。
B、 点样:点样要合适,样品点的太浓,斑点易扩散或拉长,以致分离不清,氨基酸的点样量以每种氨基酸含5—20ug为宜,将准备好的滤纸悬挂在点样架上,滤纸垂直桌面,用点样管吸取氨基酸样品10ug,在滤纸垂直方向轻轻碰触点样中心,这时样品就自动流出。点样的扩散直径控制在0.5cm之内,点样过程中必须在第一滴样品干后再点第二滴。
C、 将点好的样品的滤纸俩侧比齐,用线缝好,揉成筒状。注意缝线处的纸的俩边不要接触,避免由于毛细管现象使溶剂沿俩边移动特别快而造成溶剂前沿不齐,影响Rf值。
D、 酸溶剂系统:正丁醇:80%甲酸:水=15:3:2,茚三酮2ml,温度25*C,时间1h。注意:使用的溶剂系统需新鲜配制,并要摇匀。展层溶剂每张约需25ml。
E、 显色:待展层基本结束后,置65.C鼓风箱中10—20min, 鼓风保温,滤纸上即显出紫红色\黄色斑点。
F、 Rf值的计算:用尺测量显色斑点的中点与原点之间的距离和原点到溶剂前沿的距离,求出此值,即得氨基酸的Rf值,计算出4种氨基酸在酸系统中的Rf值。
三、实验数据与分析
四、讨论
1、注意事项
⑴.点样时要避免手指或唾液等污染滤纸有效面(即展层时样品可能达到的部分)。
⑵.点样斑点不能太大,防止层析后氨基酸斑点过度扩散和重叠,且点样后吹风温度不宜过高,以免样品变性(斑点发黄)。
⑶.展层开始时切勿使样品点浸入溶剂中。
⑷.展层剂要临用前配制,以免发生酯化,影响层析结果。
2、思考题
(1)、纸层析法分离氨基酸为什么在展层时使用一种溶剂系统,有时使用俩种溶剂系统?
这是根据Nernst在1891年提出的分配定律:一种溶质在两种给定的互不相溶的溶剂中分配时,在一定温度下达到平衡后,溶质在两相中的浓度比为一常数,即分配系数(Kd)。
Kd=Ca/Cb
Ca和Cb是互不相溶的两相,即A相和B相的浓度。这里的两相可以使固相、液相和气相。
意思就是溶质在A和B两种溶剂组成的混合溶剂里分配时,分配比是恒定的。
(2)、酸性溶剂系统对氨基酸极性基团的解离有何影响?
酸性溶液中,有利于氨基酸的碱式电离,氨基结合质子,整个分子带正电荷;反之,碱性溶液中有利于羧基的酸式电离,氨基酸分子整体带负电荷。
(3)、展层剂酸性溶剂系统对酸性氨基酸的Rf值有什么影响?
溶剂系统pH影响氨基酸电离情况,如果用有机溶剂做展层剂,那么氨基酸
电越多,溶解度越小,Rf也就越小。
五、参考文献
感谢老师的指导和辛勤劳动!
【1】
第二篇:纸层析法
纸层析法
植物叶绿体中色素的提取与分离
用具:剪刀一把、干燥的定性滤纸、50ml的烧杯及100ml的烧杯各3个、白纸3张、试管架一个、研钵一个、玻璃漏斗一个、尼龙布或纱布、毛细血管一只、药勺一个、10ml量筒一只,天平一只,试管3支、纸板一块、棉塞3个、培养皿3个、刻度尺、注射器一只、盖玻片
试剂:无水乙醇(或丙酮)、层析液(20份石油醚、2份丙酮、1份苯配置而成)、二氧化硅、碳酸钙(或碳酸钠)
材料:新鲜的菠菜叶、青菜叶、大叶黄杨叶片
背景资料:
1、 叶绿素等是脂溶性的有机分子,根据相似相溶的原理,叶绿素等色素分子溶于有机溶剂而不溶于有极性的水。故在研磨和收集叶绿色素时要用丙酮或乙醇等有机溶剂而不用水。
2、 叶绿素分布于基粒的片层薄膜上,加入少许二氧化硅是为了磨碎细胞壁、质膜、叶绿体被膜和光合片层,使色素溶解于无水乙醇等溶剂中。即,加入少许二氧化硅(石英砂)是为了使磨碎充分,释放出色素。
3、 破碎的细胞中含有草酸等有机酸,叶绿素分子中含有的Mg元素处于不稳定化合态,镁离子与有机酸结合将导致叶绿素分子破坏。加入少许碳酸钙使得钙离子与有机酸结合,减少镁离子的转移,防止研磨时叶绿体色素的破坏。所以在研磨时加入适量的碳酸钙保护色素(叶绿素),同时加入碳酸钠的道理亦如此。
4、 在过滤时选用脱脂棉或纱布,而不用滤纸。原因主要有下:(1)色素分子比较大,不容易透过滤纸; (2)滤纸有较强的吸附性而使色素吸附在滤纸上,从而降低色素浓度,影响实验效果;(3)叶绿素是脂溶性,根据相似相容的原理,脱脂棉可以减少实验过程中色素的流失,增强实验效果。
5、 根据物理学中的毛细现象,画滤液细线前,滤纸必须经过干燥处理,是为了阻止水分子堵塞滤纸中的毛细管而影响层析液的扩散。但如果用火烤的话,会使滤纸纤维变形同时破坏啦毛细管,而影响层析液的扩散。要自然阴干。为了使滤液细线处的色素足够,画滤液细线要重复多次,以积累足够的色素。否则,色素带颜色浅。
6、 由于液面的不同位置表面张力不同,纸条接近液面时,纸条边缘的表面的张力较大,层析液沿滤纸边缘扩散过快,而导致色素带分离不整齐的现象。故而,插入层析液的滤纸条一端要剪去两个角。
7、 为了防止滤纸条倒入层析液中而使层析实验失败,层析液要低于滤液细线。同时,防止因液体表面张力引起层析液沿滤纸条向上的“壁流”而导致色素溶解。
8、 色素分离的原理:纸层析是用滤纸作为载体的一种色层分析法,其原理主要是利用混合物中各组分在;流动相和固定相的分配比(溶解度)的不同而使之分离。滤纸上吸附的水为固定相(滤纸纤维常能吸20%左右的水),有机溶剂如乙醇等为流动相,色素提取液为层析试样。把试样点在滤纸的滤液细线位置上,当流动相溶剂在滤纸的毛细管的作用下,连续不断地沿着滤纸前进通过滤液细线时,试样中各组份便随着流动相溶剂向前移动,并在流动相和固定相溶剂之间连续一次就有一次的分配。结果分配比(溶解度)比较大的物质移动速度较快,移动距离较远;分配比较小的物质移动较慢,移动距离较近,这样,试样中各组分就分别聚集在滤纸的不同位置,从而达到分离的目的。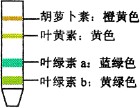
纸层析法 相关链接:
概念
纸层析法又称纸色谱法。以纸为载体的色谱法。固定相一般为纸纤维上吸附的水分,流动相为不与水相溶的有机溶剂;也可使纸吸留其他物质作为固定相,如缓冲液,甲酰胺等。将试样点在纸条的一端,然后在密闭的槽中用适宜溶剂进行展开。当组分移动一定距离后,各组分移动距离不同,最后形成互相分离的斑点。将纸取出,待溶剂挥发后,用显色剂或其他适宜方法确定斑点位置。根据组分移动距离(Rf值)与已知样比较,进行定性。用斑点扫描仪或将组分点取下,以溶剂溶出组分,用适宜方法定量(如光度法、比色法等)。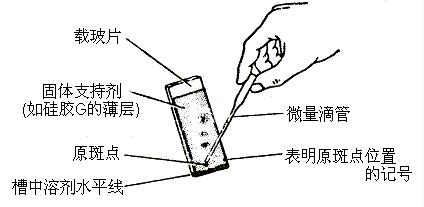
用途
通常可用于叶绿素的色素成分检验,氨基酸的鉴定及测定,橘皮精油成分检验及一些特定细胞筛查等实验。
原理
纸层析法依据极性相似相溶原理,是以滤纸纤维的结合水为固定相,而以有机溶剂作为流动相。由于样品中各物质分配系数不同,因而扩散速度不同,从而达到分离的目的。
试样经层析后可用比移值(Rf)表示各组成成分的位置(比移值=原点中心至色谱斑点中心的距离与原点中心至流动相前沿的距离之比),由于影响比移值的因素较多,因此一般采用在相同实验条件下对照物质对比以确定其异同。作为单体鉴别时,试样所显主色谱斑点的颜色(或荧光)与供置,应与对照(标准)样所显主色的谱斑点或供试品-对照品(1∶1)混合所显的主色谱斑点相同。作为质量指标(纯度)检查时,可取一定量的试样,经展开后,按各单体的规定,检视其所显杂质色谱斑点的个数或呈色(或荧光)的强度。作为含量测定时,可将色谱斑点剪下洗脱后,再用适宜的方法测定,也可用色谱扫描仪测定。
应用
应用及实例介绍
在环境分析测试中,有时用纸层析法分离试样组分,它用于一些精度不高的分析,如3,4-苯并芘。但不如GC、HPLC应用普遍。在做叶绿体色素分离时用到,将叶片碾碎,浸出绿色液体,将液体与层析液(石油醚)混合,将滤纸一段进入混合液体,四种色素在层析液中的溶解度不同,在滤纸上留下4条色素带。由此观查出各种色素的相对含量和种类。
纸层析法一般用于叶绿体中色素的分离,叶绿体中色素主要包括胡萝卜素、叶黄素、叶绿素a、叶绿素b,它们在层析液中的溶解度不同,溶解度大的随层析液在滤纸上扩散地快,反之则慢;含量较多者色素带也较宽。最后在滤纸上留下4条色素带,所以利用纸层析法能清楚地将叶绿体中的色素分离。
注意事项
纸层析法中所用的有机溶剂如丙酮等,一般有挥发性、并有一定毒性,使用时要注意密封层析,避免吸入过多有害挥发物。
实验
仪器药品
大试管 台天平研钵(配带孔纸板,防止丙酮挥发) 量筒 烧杯 漏斗 软木塞 滤纸 丙酮(可用无水乙醇替代) 四氯化碳 无水硫酸钠 碳酸钙 石英砂
操作步骤
1.称取新鲜叶子2g,放入研钵中加丙酮5ml,少许碳酸钙(防止叶绿素被破坏)和石英砂(帮助研磨),研磨成匀浆,再加丙酮5ml,然后以漏斗过滤之,即为色素提取液。
2.取准备好的滤纸条(2×20cm),将其一端剪去两侧,中间留一长约1.5cm,宽约0.5cm的窄条,并在滤纸剪口上方折叠出一条直线,作为画滤液细线的基准线。
3.用毛细吸管沾少许滤液在折线上描绘4~5次,注意要画得匀、直、细,每次画完细线要等其自然变干后再画第二根线。 4.在大试管中加入四氯化碳3梍5ml及少许无水硫酸钠(即层析液)。然后将滤纸条固定于软木塞上,插入试管内,使窄端浸入溶剂中(色素点要略高于液面,滤纸条边缘不可碰到试管壁),盖紧软木塞,直立于阴暗处进行层析。
经过0.5—1小时后,观察分离后色素带的分布。最上端橙黄色为胡萝卜素,其次黄色为叶黄素,再下面蓝绿色为叶绿素a,最后的黄绿色为叶绿素b。
-
实验六 氨基酸的纸层析法
氨基酸的纸层析法一.目的了解并掌握氨基酸纸层析的原理和方法。二、原理以滤纸为支持物的层析法,称为纸层析法。纸层析所用展层剂大多由水…
-
氨基酸的分离鉴定—纸层析法
化学与生物工程学院生物工程系生物化学实验报告课程名称生物化学实验项目氨基酸的分离鉴定纸层析法实验室名生物化学实验室实验时间20xx…
-
纸层析法分离氨基酸
纸层析法分离氨基酸姓名敖礼贤学号56022120xx班级生物工程121一前言1研究意义与前景层析法是利用混合物中各组分物理化学性质…
-
生物化学实验二 ——纸层析法分离氨基酸
生命学院生物化学实验实验二氨基酸的分离鉴定纸层析法一实验目的1掌握氨基酸纸层析的方法和原理学会分析待测样品的氨基酸成分2学习用纸层…
-
纸层析法分离氨基酸
纸层析法分离氨基酸目的和要求掌握分配层析的原理学习氨基酸纸层析法的操作技术包括点样平衡展层显色鉴定及定量学习未知样品的氨基酸成分水…
-
氨基酸的薄层层析实验报告
生物化学实验报告姓名:学号:专业年级:组别:第X实验室生物化学与分子生物学实验教学中心实验名称:氨基酸的薄层层析实验日期:XXXX…
-
生物化学实验-氨基酸分析实验报告
实验报告第一部分预习报告内容实验原理实验材料包括实验样品主要试剂主要仪器与器材实验步骤包括实验流程操作步骤和注意事项评分满分30分…
-
实验六 氨基酸的纸层析法
氨基酸的纸层析法一.目的了解并掌握氨基酸纸层析的原理和方法。二、原理以滤纸为支持物的层析法,称为纸层析法。纸层析所用展层剂大多由水…
-
氨基酸的分离鉴定—纸层析法
化学与生物工程学院生物工程系生物化学实验报告课程名称生物化学实验项目氨基酸的分离鉴定纸层析法实验室名生物化学实验室实验时间20xx…
-
生物化学实验二 ——纸层析法分离氨基酸
生命学院生物化学实验实验二氨基酸的分离鉴定纸层析法一实验目的1掌握氨基酸纸层析的方法和原理学会分析待测样品的氨基酸成分2学习用纸层…