电极的制备及电池电动势的测定与应用数据处理
物理化学实验数据处理
实验一 电极的制备及电池电动势的测定与应用
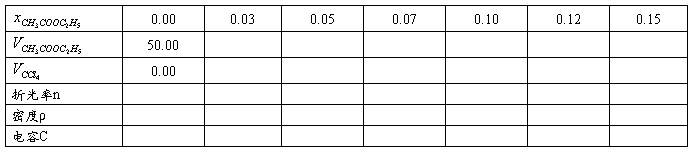
一、实验数据记录

二、数据处理
1饱和甘汞电极电动势的温度校正


 组成饱和甘汞电极的KCl溶液的温度,℃。
组成饱和甘汞电极的KCl溶液的温度,℃。
2测定温度下锌、铜电极电动势的计算
1) 测定温度下锌电极电势的计算
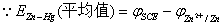

2) 测定温度下铜电极电势的计算


3) 测定温度下标准锌电极电极电势的计算

 (
(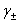 参见附录五表V-5-30,
参见附录五表V-5-30, )
)
4) 测定温度下标准铜电极电极电势的计算

 (
(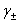 参见附录五表V-5-30,
参见附录五表V-5-30, )
)
2 298K时锌、铜电极标准电极电势的计算
1)锌电极标准电极电势的计算


1)铜电极标准电极电势的计算



 组成相应电极的电解质溶液的温度,℃。
组成相应电极的电解质溶液的温度,℃。
参考数值: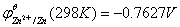 ,
,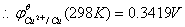 。
。
3 铜-锌原电池理论电动势的计算
铜电极的理论电极电势计算:


锌电极的理论电极电势计算:


铜-锌原电池理论电动势的计算:
误差计算: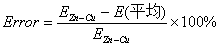
实验二 溶液法测定极性分子偶极矩
4.作图分别由斜率求算 。
。
 ,
, ,
,
5. 由课本166页II-31-7式及II-31-11计算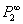 ,
,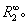 由II-31-13计算
由II-31-13计算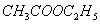 的分子偶极矩。理论值为:
的分子偶极矩。理论值为:  一、实验数据记录
一、实验数据记录
实验温度 ℃ CCl4分子量 CH3COOC2H5分子量
二、实验数据处理
1. 首先算出实验温度时两种纯液体的密度。(实验温度用温度计直接测出,密度可由软件计算)或采用下式计算:


 ℃,密度单位:g/ml
℃,密度单位:g/ml
2. 计算测量温度下CCl4介电常数εCCl4、真空电容C0和仪器分布电容Cd。

 ,
,
3. 计算每个溶液的电容值及介电常数
 ,
,
第二篇:电池电动势的测定及应用
电池电动势的测定及应用
化学物理系PB09206060彭星星摘要:次实验利用对消法测量自制电池的电动势,并根据电动势的值我们可以计算得到某些物质的活度积(实验中测得了Agcl的活度积)。通过测量不同温度时电池的电动势,得到电动势随温度变化曲线,通过曲线的斜率我们可以得到反应的热力学函数ΔrGm,ΔrSm,Δr,Hm。
关键词:对消法电动势热力学常数
Abstract:Theexperimentsusethecancellationmethodtomeasuretheelectromotiveforceofhome-madebattery,dependingonthevalueoftheelectromotiveforce,wecancalculatetheactivityproductofcertainsubstances(measuredintheexperimentgotAgclactivityproduct).Batteryofelectromotiveforcemeasurementatdifferenttemperatures,theemfwiththetemperaturecurve,theslopeofthecurve,wecangetcharacteristicfunctionsΔrGm,ΔrSm,ΔrHm.
一、实验简介
化学电池是由两个“半电池”即正负电极放在相应的电解质溶液中组成的。由不同的这样的电极可以组成若干个原电池。在电池反应过程中正极上起还原反应,负极上起氧化反应,而电池反应是这两个电极反应的总和。其电动势为组成该电池的两个半电池的电极电位的代数和。若知道了一个半电池的电极电位,通过测量这个电池电动势就可算出另外一个半电池的电极电位。所谓电极电位,它的真实含义是金属电极与接触溶液之间的电位差。它的绝对
值至今也无法从实验上进行测定。19xx年,IUPAC对电极电位的定义做出如下规定:“一个电极(半电池)的电极电势是用一个电池的电动势来定义的,在此电池中,左边的电极是标准氢电极(SHE),右边是待测电极。”i
从19世纪开始,各国科学家就开始了对电解质溶液体系热力学性质的研究ii,由于当时实验条件的限制所得结果的精度一直难以提高。而且溶液体系的热力学量难以精确测量又进一步给体系热力学函数的求解带来了困难。直到电化学的发展,利用反应的电极电势求解出体系的Gibbs自由能,再通过热力学函数之间的关系求解出其他热力学函数。借助Nernst方程还可以求解出已知体系中难溶物的Ksp及各离子的活度。电动势的测试精度可以精确到10-3mv,所得到的热力学函数测量值也相对比过去的方法更为精确。但是在测量热力学函数?H,?S,?G以及电解质的平均活度系数,难溶盐的活度积和溶液的pH等物理化学参数时原电池必须是可逆电池,即闭合回路内的点流必须无限小,因此必须使用对消法测量电池的电动势。
二、实验部分
1、银电极个铜电极的制备
取两根铜导线用砂纸打磨掉表面的氧化层,蒸馏水洗净后用滤纸吸干表面的水,将导线插入0.1mol·dm-3Cu(NO3)2溶液中,按照图1所示连接电路,调节可变电阻,使电流在3mA、直流稳压源电压控制在6V镀20分钟。取出电极,金属光泽较明显的一根导线用于本次实验。将铂丝电极放在浓HNO3中浸泡15分钟,取出用蒸馏水冲洗,用砂纸打磨直至表面光洁平整为止,再用蒸馏水冲洗干净插入盛0.1mol·dm-3AgNO3(实验室提供,纯度未知)溶液的小烧杯中,重复铜电极的制备方式,但是注意要将银电极接在直流电源的阴极上。将铜电极和银电极取出用蒸馏水冲洗干净,用滤纸吸干,并迅速放入盛有0.1000mAgNO3+0.1mHNO3溶液的半电池管中(如图2所示)。
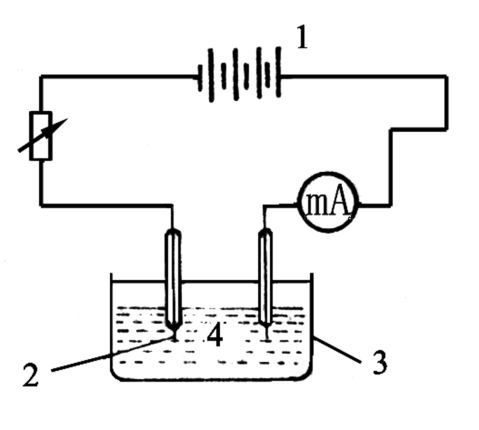
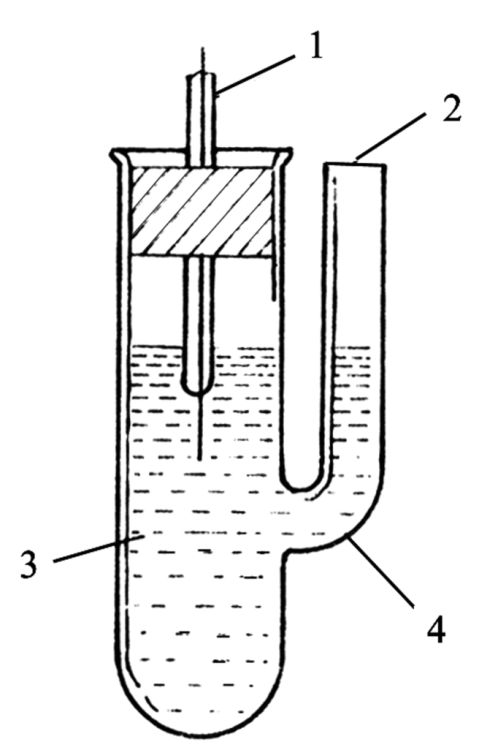
图1电极制备装置图
1—电池
3—被镀电极2—辅助电极4—镀银溶液图2半电池管1—电极2—盐桥插孔?4—玻璃管3—电解质溶液
2、制备盐桥
为了消除液接电位,必须使用盐桥。量取约100ml的饱和KNO3溶液,放入三角锥型瓶中;再往三角锥型瓶中加入少量的KNO3(AR试剂,国药集团)晶体使之处于饱和状态,在天平上称取约3g琼脂粉,倒入三角锥型瓶中,水浴加热。当琼脂粉被加热溶解至形成均匀的胶状物时,用滴管将琼脂—KNO3饱和溶液缓慢注入洗净的U形管(须预热)中,琼脂中不能有气泡存在。3、Cu-Ag电池电动势的测量
Cu-Ag电池:Cu|Cu(NO3)2(0.1000M)?AgNO3(0.1000M)|Ag
要满足可逆电池回路中电流无限小的条件,不能使用伏特计直接测量电池的电动势。因为这样电路内会有微小电流通过,导致溶液的浓度下降,体系就不是可逆电池。因此必须利用对消法测量


电池的电动势,这时回路中电流无限小。
EM-3C型电动势测量装置HK-1D型恒温水槽
电极置于半电池管中后,将半电池管放入恒温槽(南大万和HK-1D)中,设定温度为恒定25oC,温度稳定5分钟后准备开始测量电动势。本实验中并不自行连接电路,而是使用商品化的电动势测定装置(南大万和EM-3C),将两支电极分别接入仪器上“测量”的两接口中,开关开至测量档,调节旋钮只至电流计指示回路电流为0,此时显示的电压为电池的电动势平行测量三组电势值并记录。
测量Cu-Ag电池的电动势:数据见下表格
E1(mV)
一440.469平均值E(mV)
458.567
二441.722计算值E(mV)
441.404
三442.022
Ksp,AgCl
1.589×10
?10
4、Ag-218参比电极电池电动势测量
Ag-AgCl|KCl(饱和)?AgNO3(0.1000M)|Ag
断开Cu电极的连线,将连接线接至218参比电极上,更换一支KNO3盐桥。重复2.3的过程进行测量,25oC下的电动势测量完成后,将恒温仪的温度设定为30oC,稳定后测试该温度下电池的电势,每隔5oC测一个点,测到40oC,每个温度平行测量3组数据。数据记录如下表温度25℃30℃35℃40℃
电动势测量值/mV499.520496.046492.957489.792
499.357496.046492.957489.792
499.231496.046492.957489.792
平均值/mV499.369496.046492.957489.792
三、数据处理
1、25oC条件下Cu&Ag电极电势及Ag+、Cu2+活度的计算
查阅相关数据可得到218参比电极在25oC下的电极电势为0.1981V,即198.100mV,实验中测得的电池电动势为449.369mV,由于Ag|AgNO3(0.1000M)电极作为电池的正极。
查阅有关资料有:
ψAg|Ag+=0.7996V
E=?右-?左=[?Ag+/Ag+?RTRT1?lnaAg+]?[?Ag/AgCl+ln]FFaCl?
=E°?RT1lnFaAg+aCl?
1
Ksp?G°=-nFE°=?RTln
对于1-1型电解质溶液平均离子活度
1
2a±=(aAg+aCl?)
aAg+aCl?=(cAg+cCl?)×a±2
又由E=RT1RTln+lnaAg+?aCl?FKspF
所以只要测得该电池的电动势就可根据上式求得AgCl的Ksp。其中γ±Ag+为AgNO3溶液的平均
活度系数,为KCl溶液的平均活度系数。当CAgNO3=0.1000m时,γ±=0.734,CKCl=1.000m时,γ±=0.606。
代
入相关数据求得AgCl的KSP
0.499369=8.314×29818.314×298ln+ln(0.1000×0.734×1.000×0.606)96500Ksp96500
解得25oC时该电解质溶液中AgCl的活度积为
Ksp=1.589×10?10
查阅手册可得,在25oC条件下AgCl的溶度积为
θKsp=1.77×10?10
可以看到这两个值是有着不小的差距的。这可能是由于手册中的溶度积是对浓度足够低的电解质溶液体系,即活度因子约等于1。但是在本实验中溶液浓度没有足够小,离子之间有着不可忽视的相互作用,活度因子并不接近1,所以造成了
在实验中测得电池Kspθ与Ksp的不同。不过在基础分析化学中一般忽略这样的区别。
Cu|Cu(NO3)2(0.1000M)?AgNO3(0.1000M)|Ag
该电池反应为:
负极反应:Cu→Cu
+2++2e正极反应:Ag+e→Ag
o电池电动势:E=?右-?左=?Ag+/Ag+RTolnaAg+—[?Cu2F2++/CuRTlnaCu2+]2F
2+aRTAg+=Eo+ln2FaCu2+
以平均活度代替离子活度,CAgNO3=0.1000m时,γ±=0.734,CCuCl2=0.1000m时,γ±=0.15。差得,?Ag+,Ag=0.7996V,?Cu2+,Cu=0.3460V
ooEo=?Ag??Cu=0.4536V2+2+,Ag,Cuoo
8.314×298.15(0.734×0.1)2
带入数据得:E=0.4536+ln=0.4404V2×965000.15×0.1
测得电动势E的平均值为:0.458567V相对误差为:d=
+0.458467?0.4404×100%=4.1%0.4404-2.化学反应Ag(m2)+Cl(m1)→AgCl(s)热力学函数的计算
根据公式
可得下表?rGm=-nFE
温度/0C
电动势(mv)25499.369496.0463035492.95740489.792
实验中可以准确测量不同温度的E值,便可计算不同温度下该电池反应的rGm。以E对T作图求出某任一温度的(?E)?TP
用Origin软件进行线性拟合可以得到电池常数E-T的曲线
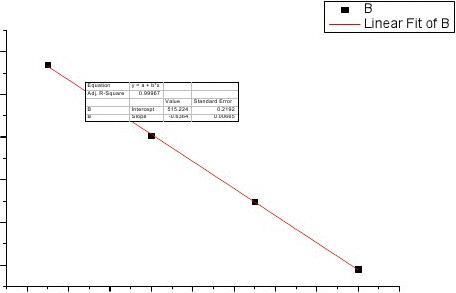
500
498496
E
494
492
490
T
图3
斜率即为电池常数可得
这里仅计算250C条件下的E-T线性拟合图(?E)p=?0.6364mV/KV/K?T
?rGm=?nFE=96500×(?0.499369×10?3)J/mol=?48.19KJ/mol
?rSm=?(??rGm?EP=nF()P?T?T=?1×96500×0.6364×10?3=-61.41J/(mol?K)
?E?rHm=?nFE+nFT(P?T=?48.19?61.41×298×10?3=?66.49KJ/mol
30°C,35°C,40°C的热力函数列于下表:
T/0C
?rGm(KJ/mol)
?rSm(J?mol?1?K?1?rHm(KJ/mol)30354047.86844-61.4147.55424-61.4147.26493-61.4166.1686265.8544265.56511
4.实验总结
本实验利用对消法较为精确的测量了可逆电池的电动势,并测得了电动势随温度的变化曲线。另一方面,本实验也有着一定的缺陷和改进空间:
(1)控温仪的精度不高,可以很明显的看到在同一温度点平读取三个数值时电势值逐渐下降。
(2)测量的温度点太少,导致线性拟合时的优度比较差;
(3)实验中电极打磨得不够好;
(4)变阻器示数不准,按钮多处有问题。
参考文献:
物理化学(科学出版社第五版);物理化学手册;物理化学实验讲义。
-
物理化学实验报告-电池电动势的测定及其应用
电池电动势的测定及其应用摘要在本实验中我们利用对消法测量电池电动势并计算相关热力学常数首先我们通过测量电池AgsAgClsKClm…
-
电动势的测定及其应用实验报告思考题
电动势的测定及其应用实验报告思考题1电位差计标准电池检流计及工作电池各有什么作用如何保护及正确使用答电位差计对消法补偿法测定电池电…
-
大学物理化学实验报告-原电池电动势的测定
物理化学实验报告院系化学化工学院班级学号姓名实验名称原电池电动势的测定日期同组者姓名史黄亮室温1684气压1017kPa成绩一目的…
-
物化实验报告7-电动势的测定及应用
一实验目的1通过实验加深对可逆电池可逆电极盐桥等概念的理解2掌握对消法测定电池电动势的原理及电位差计的使用方法3通过电池AgAgN…
-
原电池电动势的测定及其应用实验报告
原电池电动势的测定及其应用实验报告林传信高分子1011017051012一实验目的1理解电极电极电势电池电动势可逆电池电动势的意义…
-
物化实验报告7-电动势的测定及应用
一实验目的1通过实验加深对可逆电池可逆电极盐桥等概念的理解2掌握对消法测定电池电动势的原理及电位差计的使用方法3通过电池AgAgN…
-
大学物理化学实验报告-原电池电动势的测定
物理化学实验报告院系化学化工学院班级学号姓名实验名称原电池电动势的测定日期同组者姓名史黄亮室温1684气压1017kPa成绩一目的…
-
原电池电动势的测定实验报告 浙江大学
实验报告课程名称:大学化学实验p实验类型:中级化学实验实验项目名称:原电池电动势的测定同组学生姓名:无指导老师##一、实验目的和要…
-
原电池电动势的测定与应用物化实验报告
原电池电动势的测定及热力学函数的测定一实验目的1掌握电位差计的测量原理和测量电池电动势的方法2掌握电动势法测定化学反应热力学函数变…
-
原电池电动势的测定实验报告
实验九原电池电动势的测定及应用一实验目的1测定CuZn电池的电动势和CuZn电极的电极电势2学会几种电极的制备和处理方法3掌握数字…