葡萄糖注射液中葡萄糖含量的测定 实验报告
设计性实验报告
题 目:葡萄糖注射液中葡萄糖含量的测定
课程名称:
姓 名:
学 号:
系 别:
专 业:
班 级:
指导教师(职称):
实验学期: 至 学年第学期
葡萄糖注射液中葡萄糖含量的测定
(,,班,学号)
摘要 运用氧化还原滴定的原理设计葡萄糖注射液中葡萄糖含量的测定方案并具体实施。从而进一步掌握 及
及 标准溶液的配制和标定方法,巩固氧化还原滴定的操作技能。学会间接碘量法测定葡萄糖含量的方法和原理,进一步掌握返滴定法技能。其中,葡萄糖分子中含有醛基,能被IO-定量地氧化为羧基。故可将一定量过量的
标准溶液的配制和标定方法,巩固氧化还原滴定的操作技能。学会间接碘量法测定葡萄糖含量的方法和原理,进一步掌握返滴定法技能。其中,葡萄糖分子中含有醛基,能被IO-定量地氧化为羧基。故可将一定量过量的 在碱性条件下加入葡萄糖溶液中,使醛基完全转化为羧基。再将其酸化,用
在碱性条件下加入葡萄糖溶液中,使醛基完全转化为羧基。再将其酸化,用 标准溶液滴定析出的
标准溶液滴定析出的 。所用指示剂为淀粉。根据所加
。所用指示剂为淀粉。根据所加 标准溶液的量及滴定所耗
标准溶液的量及滴定所耗 标准溶液的量结合反应式中各物质之间的计量关系,便可计算葡萄糖的含量。该方法简便易行且准确度高,基本符合实验要求。
标准溶液的量结合反应式中各物质之间的计量关系,便可计算葡萄糖的含量。该方法简便易行且准确度高,基本符合实验要求。
关键词 葡萄糖注射液样品(5%) (0.05mol/L)标液
(0.05mol/L)标液  (0.1mol/L) 标液 间接碘量法 返滴定法
(0.1mol/L) 标液 间接碘量法 返滴定法
1 引言
目前已知测定葡萄糖注射液中葡萄糖含量的方法有两种:
第一种方案:间接碘量法:移取一份稀释10倍后的葡萄糖溶液25.00mL,再加入25.00mL 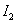 标准溶液。一边摇动,一边缓慢加入1mol/LNaOH溶液,直至溶液呈浅黄色。将碘量瓶加塞放置10~15min后,用少量水冲洗瓶盖及碘量瓶内壁,然后加入2mL、6mol/LHCl使溶液成酸性,立即用
标准溶液。一边摇动,一边缓慢加入1mol/LNaOH溶液,直至溶液呈浅黄色。将碘量瓶加塞放置10~15min后,用少量水冲洗瓶盖及碘量瓶内壁,然后加入2mL、6mol/LHCl使溶液成酸性,立即用 标准溶液滴定至溶液呈淡黄色时,加入3mL、5g/L淀粉指示剂,继续滴定蓝色恰好消失且半分钟内不褪色即为终点[1]。根据滴定消耗
标准溶液滴定至溶液呈淡黄色时,加入3mL、5g/L淀粉指示剂,继续滴定蓝色恰好消失且半分钟内不褪色即为终点[1]。根据滴定消耗 溶液的体积计算试样中葡萄糖的含量。这种方法简便易行,且准确度较高。
溶液的体积计算试样中葡萄糖的含量。这种方法简便易行,且准确度较高。
第二种方案:旋光法:由于葡萄糖分子结构中的五个碳都是手性碳原子,具有旋光性,可采用旋光法测定含量。操作方法:取出旋光计的测定管,先用蒸馏水为空白对仪器进行校正。用供试液(5%葡萄糖注射液)冲洗数次,缓缓注入供试液适量(注意勿使发生气泡)。置于旋光计内,读取旋光度,连续测定3次,取平均值。在一定温度下,根据[2]计算试样中葡萄糖的含量。这种方法简便易行,实验误差小。
本实验采用第一种方案进行葡萄糖注射液中葡萄糖含量的测定。﹙本方法的相对误差约为0.1%,在误差要求范围之内﹚。
2 实验原理
2.1 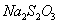 (0.1mol/L)的标定
(0.1mol/L)的标定
因为在酸性溶液中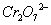 会将
会将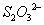 氧化为
氧化为 及
及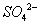 等混合物,使得反应无定量关系。所以不能用
等混合物,使得反应无定量关系。所以不能用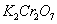 直接标定标准溶液。通常采用
直接标定标准溶液。通常采用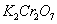 作为基准物,以淀粉为指示剂,用间接碘量法标定溶液。有关反应如下:
作为基准物,以淀粉为指示剂,用间接碘量法标定溶液。有关反应如下:
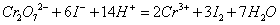
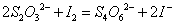
∴相关计算式: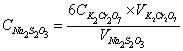
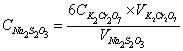
2.2 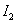 (0.05mol/L)的标定
(0.05mol/L)的标定
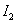 溶液可用
溶液可用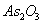 为基准物进行标定,但
为基准物进行标定,但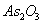 有剧毒,故采用标准溶液进行标定。反应如下:
有剧毒,故采用标准溶液进行标定。反应如下: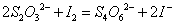
∴相关计算式:
2.3 葡萄糖注射液中葡萄糖含量的测定
将一定量过量的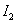 在碱性条件下加入葡萄糖溶液中,
在碱性条件下加入葡萄糖溶液中,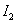 与OH-作用可生成IO-,而葡萄糖分子中的醛基能够定量地被IO-氧化为羧基。反应如下:
与OH-作用可生成IO-,而葡萄糖分子中的醛基能够定量地被IO-氧化为羧基。反应如下:
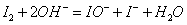

总反应式: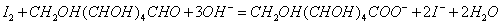
过量的未与葡萄糖作用的IO-在碱性溶液中歧化成I-和IO3-,它们在酸性条件下,又反应生成。反应如下:
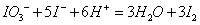
总反应式:
再用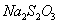 标准溶液滴定析出的
标准溶液滴定析出的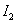 :
: 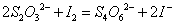
∴相关计算式: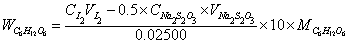
2.4 样品的检测:
本实验所用样品为葡萄糖注射液(5%);
石药银湖制药有限公司生产,规格:250mL,12.5g;
国标:葡萄糖含量应为标示量的95.0%~105.0%
产品批号:20612091006
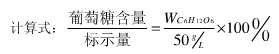
3 实验用品
3.1 实验仪器:全自动电光分析天平,称量瓶,电子秤,移液管(25mL),3个碘量瓶(250mL),酸式滴定管﹙50mL﹚,烧杯﹙50mL、100 mL各一个﹚,容量瓶(250mL),胶头滴管,玻璃棒,铁架台(带滴定管夹),吸耳球
实验试剂: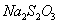 (0.1mol/L)、
(0.1mol/L)、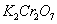 (s)、
(s)、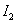 (0.05mol/L)、淀粉(5g/L)、KI(100g/L)、HCl(6mol/L)、NaOH(1mol/L)、葡萄糖注射液样品(5%)、蒸馏水
(0.05mol/L)、淀粉(5g/L)、KI(100g/L)、HCl(6mol/L)、NaOH(1mol/L)、葡萄糖注射液样品(5%)、蒸馏水
4 实验步骤
4.1 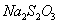 (0.1mol/L)的标定
(0.1mol/L)的标定
4.1.1 配制 标准溶液
标准溶液
在分析天平上准确称取1.2~1.3g  于干净的100mL的烧杯中,加适量蒸馏水溶解,将溶液定量地转移到250mL容量瓶中,洗涤玻璃棒和烧杯2到3次,定容,摇匀。计算
于干净的100mL的烧杯中,加适量蒸馏水溶解,将溶液定量地转移到250mL容量瓶中,洗涤玻璃棒和烧杯2到3次,定容,摇匀。计算 标液的浓度。
标液的浓度。
4.1.2 标准溶液的标定
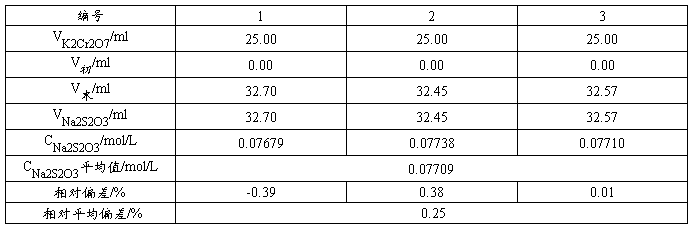
用移液管移取25.00mL的 标准溶液于250mL的碘量瓶中,加入5mL、6mol/L的HCl再加入10mL、100g/LKI溶液,摇匀;在暗处放置5min后(让与I-反应充分),用蒸馏水冲洗瓶口,加入50mL蒸馏水,用待标定的溶液滴定至浅黄色,然后加入3mL、5g/L的淀粉指示剂,继续滴定至溶液蓝色完全退去呈亮绿色即为终点。记录消耗溶液的体积。平行滴定三次,计算的浓度和相对平均偏差(≤0.2%)。
标准溶液于250mL的碘量瓶中,加入5mL、6mol/L的HCl再加入10mL、100g/LKI溶液,摇匀;在暗处放置5min后(让与I-反应充分),用蒸馏水冲洗瓶口,加入50mL蒸馏水,用待标定的溶液滴定至浅黄色,然后加入3mL、5g/L的淀粉指示剂,继续滴定至溶液蓝色完全退去呈亮绿色即为终点。记录消耗溶液的体积。平行滴定三次,计算的浓度和相对平均偏差(≤0.2%)。
4.2 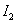 (0.05mol/L)的标定
(0.05mol/L)的标定
用移液管移取25.00mL 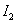 溶液于250mL的碘量瓶中,加入50mL蒸馏水,用标准溶液滴定至浅黄色,然后加入3mL、5g/L的淀粉指示剂,继续滴定至溶液蓝色完全褪去即为终点。记录消耗溶液的体积。平行滴定三次,计算
溶液于250mL的碘量瓶中,加入50mL蒸馏水,用标准溶液滴定至浅黄色,然后加入3mL、5g/L的淀粉指示剂,继续滴定至溶液蓝色完全褪去即为终点。记录消耗溶液的体积。平行滴定三次,计算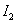 的浓度和相对平均偏差(≤0.2%)。
的浓度和相对平均偏差(≤0.2%)。
4.3 葡萄糖注射液中葡萄糖含量的测定
用移液管移取25.00mL葡萄糖注射液于250mL容量瓶中,定容,摇匀。
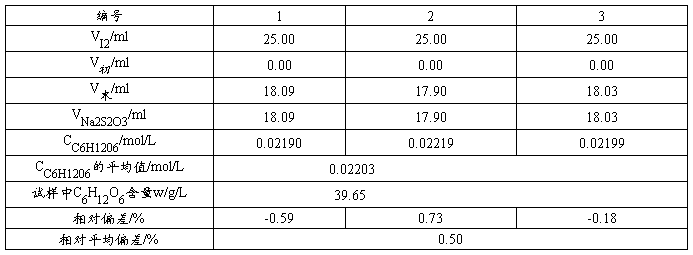
用移液管移取25.00mL稀释后的葡萄糖溶液于250mL的碘量瓶中,用移液管准确加入25.00mL 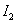 标准溶液。一边摇动,一边缓慢加入1mol/LNaOH溶液,直至溶液呈浅黄色。将碘量瓶加塞放置10~15min,使之完全反应。用少量水冲洗瓶盖及碘量瓶内壁,然后加入2mL、6mol/LHCl使溶液成酸性,立即用标准溶液滴定至溶液呈淡黄色时,加入3mL、5g/L淀粉指示剂,继续滴定蓝色恰好消失即为终点。记录消耗溶液的体积,平行滴定三次,计算试样中葡萄糖的含量(以g/L表示)及相对平均偏差(≤0.2%)。
标准溶液。一边摇动,一边缓慢加入1mol/LNaOH溶液,直至溶液呈浅黄色。将碘量瓶加塞放置10~15min,使之完全反应。用少量水冲洗瓶盖及碘量瓶内壁,然后加入2mL、6mol/LHCl使溶液成酸性,立即用标准溶液滴定至溶液呈淡黄色时,加入3mL、5g/L淀粉指示剂,继续滴定蓝色恰好消失即为终点。记录消耗溶液的体积,平行滴定三次,计算试样中葡萄糖的含量(以g/L表示)及相对平均偏差(≤0.2%)。
实验完毕后,将仪器洗涤干净,废液回收到废液桶中,整理好实验台,并登记数据.
5 实验记录及数据处理
5.1  (0.1mol/L)的标定
(0.1mol/L)的标定

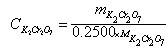
5.2 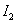 (0.05mol/L)的标定
(0.05mol/L)的标定
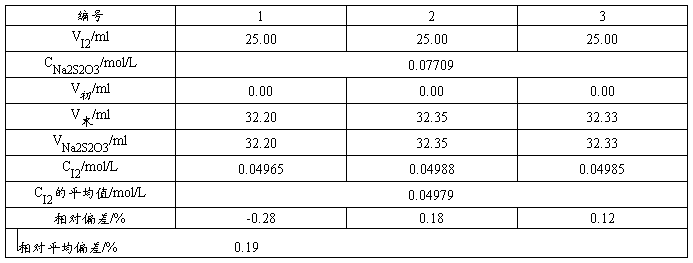
5.3 葡萄糖注射液中葡萄糖含量
5.4 样品的检测
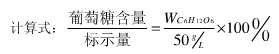
国标:葡萄糖含量应为标示量的95.0%-105.0%,而本实验所测葡萄糖含量低于下线15.7%,说明该葡萄糖注射液样品(5%)中的葡萄糖过少,也可能是含有另外一种含醛基的有机物或能与I2发生反应的物质。总之,该葡萄糖注射液样品(5%)不合规格。
6 实验结果与讨论
6.1 测定结果
本实验采用间接碘量法测定葡萄糖注射液中葡萄糖的含量,其中所标定Na2S2O3标准溶液的浓度为0.07709mol/L ;标定I2标准溶液的浓度为 0.04979mol/L ,葡萄糖注射液中葡萄糖的含量为 39.65g/L ;经检验,此试样不合规格。实验所得结果的准确度较高,说明此实验方法较好。
6.2 误差分析
6.2.1 仪器误差:仪器本身不够精确。可能的情况有:分析天平灵敏度不够高,读数时存在±0.0002g 的绝对误差;酸式滴定管刻度不准,读数时存在±0.02mL的绝对误差。
6.2.2 主观误差:由于人眼辨别颜色的敏锐度不高,导致滴定终点判断不够准确;在读数时也有人为因素干扰。
6.2.3 试剂误差:试剂纯度可能不够高和蒸馏水中可能含有微量杂质使分析结果系统的偏高或偏低。
6.2.4 误差具有传递性,由于所测c本身存在一定误差,从而使CI2和葡萄糖的含量的测定值也出现一定的误差。
6.2.5 I2容易挥发,在滴定过程中有微量I2挥发,且还有一些残留在碘量瓶盖上,导致滴定消耗溶液的体积偏低,使测量结果出现偏差。
6.3 注意事项
6.3.1 滴定时的正确操作:见滴成线,逐滴加入,悬而不落(半滴滴入)。
6.3.2 确定滴定终点时,要注意在规定时间(一般为半分钟)内不褪色再读数。
6.3.3 处理数据时有效数字位数的保留应严格按有效数字的修约规则(四舍六入五成双)和运算规则保留。
6.3.4 氧化葡萄糖时滴加NaOH的速度不能过快。否则过量IO-还来不及氧化葡萄糖就歧化成IO3-和I-,可能导致葡萄糖不能完全被氧化,使测定结果偏低。
6.3.5 碘易受有机物的影响,不可使用软木塞、橡皮塞,并应贮存于棕色瓶内避光保存。配制和装液时应戴上手套。I2溶液不能装在碱式滴定管中。
6.3.6 标定葡萄糖时,用HCl酸化后,应立即用标准溶液进行滴定。因为在碱性溶液中生成的IO3-和I-在酸化时生成I2,I2易挥发。
6.3.7 滴定时使用碘量瓶,不要剧烈摇动,以减少I2的挥发;淀粉指示剂在接近终点时才加入,预先加入它会包围部分I2而影响滴定终点的判断。
6.4 收获体会
分析化学实验本身就是一门严谨而细密的课程。每一步操作我们都应认真做好。每一次数据的处理我们都应严格地按照有效数字修约规则、运算规则认真准确地计算并对其进行分析。 然而滴定分析又是这门课程的重要部分,因而我们需要好好掌握滴定方法,滴定终点的判断以及指示剂的使用等。通过这次实验,我再一次熟练掌握了使用分析天平、移液管、滴定管的操作技能,掌握了氧化还原滴定法的基本原理,学会了间接碘量法和返滴定法测定葡萄糖注射液中葡萄糖的含量的方法。我相信,通过这次实验,我运用已学知识解决问题的综合能力也将得到提高。
参考文献
[1] 华中师范大学,东北师范大学,陕西师范大学,北京师范大学. 分析化学实验(第三版). 北京:高等教育出版社,2011,87
[2] 胡宏纹. 有机化学,北京:高等教育出版社,2011,61
[3] 武汉大学,吉林大学,中山大学,中国科技大学. 分析化学(第五版). 北京:高等教育出版社,2011,247-248,406
(附英文题目、摘要、关键词)
Assay of glucose in the glucose injection
(Chemistry department, Applied chemistry,class, Learning numbers )
Abstract Determination of glucose in the redox titration of the principles of design glucose injection programs and the specific implementation. To further understand the preparation and calibration of the standard solution of and I2, to consolidate the skills of the redox titration. The methods and principles of the Society of indirect iodometric method for determination of glucose content, to further understand the back titration skills. Among them, the glucose molecules containing aldehyde groups, can be the IO-quantitatively oxidized to carboxyl. It can be a certain amount of excess I2 under alkaline conditions by adding glucose solution, the aldehyde completely converted into carboxyl. Then acidified precipitation I2, with standard solution titration. Indicator for starch. According to the amount of added I2 standard solution and titration of the consumption amount of Standard Solution combined with the measurement of the relationship between the various substances in the reaction, calculate the amount of glucose. The method is simple, highly accurate, in line with the experimental requirements.
Keywords glucose injection samples (5%) I2 (0.05 mol / L) standard solution (0.1 mol / L) indirect iodometric method .
第二篇:葡萄糖杂质检查及葡萄糖注射液分析实验报告 20xx
实验报告 葡萄糖的杂志检验 名字: 学号: 1145039 20##年3月28日
检品名称: 葡萄糖 批号: 规格:__
一、目的要求
1. 掌握药物的一般杂质检查原理与实验方法。
2. 掌握杂质限度试验的概念及计算方法。
3. 熟悉一般杂质检查项目与意义。
二、主要仪器与药品
50mL纳氏比色管、坩埚、鼓风干燥箱、马弗炉、药物天平、葡萄糖、氯化钠原料药等。
三、原理:
葡萄糖是用淀粉以无机酸水解或在酶催化下经过水解得稀葡萄糖液,再经脱色、浓结晶制得。
1.国内生产方法有以下几种:
⑴酸水解法:以无机酸将淀粉水解为葡萄糖。
⑵双酶水解法:以生物酶为催化剂将淀粉水解为葡萄糖。
⑶酸酶水解法:以盐酸为液化剂,糖化酶为催化剂,将淀粉水解为葡萄糖。
根据葡萄糖生产工艺特点,应进行氯化物、重金属、砷盐等一般杂质检查,进行蛋白质、可溶性淀粉等特殊杂质检查。
四、实验方法
1. 酸度 取本品2.0g,加水20mL溶解后,加酚酞指示液3滴与氢氧化钠滴定液(0.02mol/L)0.20mL,应显粉红色。
2. 氯化物 取本品0.6g,加水溶解使成25mL,再加稀硝酸10mL;溶液如不澄清,应滤过;置50mL纳氏比色管中,加水使成约40mL,摇匀,即得供试溶液。另取标准氯化钠溶液6.0mL,置50mL纳氏比色管中,加稀硝酸10mL,加水使成40mL,摇匀,即得对照溶液。于供试溶液与对照溶液中,分别加入硝酸银试液1.0mL,用水稀释,使成50mL,摇匀,在暗处放置5分钟,同置黑色背景上,从比色管上方向下观察、比较(附录A)。供试溶液所显浑浊度不得较对照液更浓(0.01%)。
3. 硫酸盐 取本品2.0g,加水溶解使成约40mL;溶液如不澄清,应滤过;置50mL纳氏比色管中,加稀盐酸2mL,摇匀,即得供试溶液。另取标准硫酸钾溶液2.0mL,置50mL纳氏比色管中,加水使成约40mL,加稀盐酸2mL,摇匀,即得对照溶液。于供试溶液与对照溶液中,分别加入25%氯化钡溶液5mL,用水稀释至50mL,充分摇匀,放置10分钟,同置黑色背景上,从比色管上方向下观察、比较(附录B)。供试溶液所显浑浊度不得较对照液更浓(0.01%)。
4. 亚硫酸盐与可溶性淀粉 取本品1.0g,加水10mL溶解后,加碘试液1滴,应即显黄色。
5. 干燥失重 取本品,在105℃干燥至恒重,减失重量不得过9.5%(附录C)。
6. 炽灼残渣 不得过0.1%(附录D)。
7. 蛋白质 取本品1.0g,加水10mL溶解后,加磺基水杨酸溶液(1→5)3mL,不得发生沉淀。
8. 铁盐 取本品2.0g,加水20mL溶解后,加硝酸3滴,缓缓煮沸5分钟,放冷,加水稀释使成45mL,加硫氰酸铵溶液(30→100)3mL,摇匀,如显色,与标准铁溶液2.0mL用同一方法制成的对照液比较,不得更深(0.001%)。
9. 重金属 取25mL纳氏比色管两支,甲管中加标准铅溶液一定量与醋酸盐缓冲液(pH3.5)2mL后,加水稀释成25mL。取本品4.0g,置乙管中,加水适量溶解后,加醋酸盐缓冲液(pH3.5)2mL,加水使成25mL;若供试液带颜色,可在甲管中滴加少量的稀焦糖溶液或其他无干扰的有色溶液,使之与乙管颜色一致。再在甲乙两管中分别加硫代乙酰胺试液各2mL,摇匀,放置2分钟,同置白纸上,自上向下透视,乙管中显出的颜色与甲管比较,不得更深(附录E),含重金属不得过百万分之五。
五、实验结果
1. 酸度
原理:检品中酸性杂质被碱中和,过量的碱使酚酞显粉红色。
实验现象:显粉红色。 见图一。
结论:符合规定。
2. 氯化物检查
 原理:Cl-+Ag+ HNO3 AgCl↓(白色)
原理:Cl-+Ag+ HNO3 AgCl↓(白色)
实验现象:样品管浑浊度浅于标准管。 见图二。
结论:符合规定(﹤0.01%)。
3. 硫酸盐
原理:SO4 2- 十Ba2+ —→ BaS04↓
实验现象:样品管浑浊度浅于标准管。见图三。
结论:符合规定(﹤0.01%)。
4. 亚硫酸盐与可溶性淀粉
原理:黄色为碘试液本身的颜色,证明无亚硫酸盐与可溶性淀粉存在。当有亚硫酸盐与可溶性淀粉存在时,淀粉遇碘遍蓝色,亚硫酸盐与碘发生氧化还原反应生成碘离子,变为无色。
实验现象:溶液显黄色。见图四。
结论:符合规定。
5. 干燥失重
原理:干燥失重是指药物在规定条件下经干燥后所减失的重量,根据所减失的重量和取样量计算供试品干燥失重的百分率。
实验现象:干燥失重8.0%
结论:符合规定(﹤9.5%)。
6. 炽灼残渣
实验现象:m0=20.0014g m1=22.7435g m2=22.7410g
残渣重=(m1-m2)/(m1-m0)*100% =0.09%
结论:符合规定(﹤0.1%)
7. 蛋白质
实验现象:没有发生沉淀。见图五。
结论:符合规定。
8. 铁盐
原理:Fe3++6SCN- —→ [Fe(SCN)6]3- 红色
实验现象:样品管颜色浅于标准管。见图六。
结论:符合规定。
9. 重金属
原理:硫代乙酰胺在弱酸性(pH约3.5)溶液中水解,产生硫化氢,可与重金属离子结合生成有色硫化物的均匀沉淀,可与对照标准液同法处理比较。
实验现象:样品管颜色浅于标准管。见图七。
结论:符合规定。
六、结果分析


图一 葡萄糖酸度 图二 葡萄糖氯化物
注:葡萄糖中酸性杂质被碱中和, 注:左为供试管,右为标准管
碱使酚酞显粉红色 左管浊度浅于右管


图三 葡萄糖硫酸盐 图四 亚硫酸盐与可溶性淀粉
注:左管为标准管,右管为供试管 注:溶液显黄色
左管浊度深于右管

图五 葡萄糖蛋白质实验 图六 葡萄糖铁盐实验
注:葡糖糖水溶液与磺基水杨酸 注:上管为标准管,下管为供试管
溶液不产生沉淀 上管溶液颜色深于下管

图七 葡萄糖重金属实验
注:左管为标准管,右管为供试管
左管颜色深于右管
七、讨论
1.观察实验结果时,比色方法一般是将两管同置于白色背景上,从侧面观察;比浊方法是将两管同置于黑色或白色背景上,自上而下地观察。
2.精密称定,选用的是精确度为千分之一的称量天平。
3.铁盐试验中,由于缓缓煮沸叫麻烦,可在温度80。C水中水浴约五分钟,实验结果也十分明显。
4.酸度实验中,氢氧化钠溶液可添加至0.4mL,若还不显粉色,可再滴加氢氧化钠溶液。
实验报告 葡萄糖注射液分析 名字:开德美 学号:1145039 20##年3月28日
检品名称:葡萄糖注射液 批号: 规格:
一、目的要求
1. 掌握pH值测定原理和pH计的正确操作。
2. 掌握比旋度的概念、求算方法和旋光法测定旋光性物质含量的原理与计算。
3. 熟悉紫外法检查杂质的原理与方法。
4. 了解注射液杂质检查的一般项目。
二、主要仪器与药品
WZZ-1自动指示旋光仪、pH酸度计、PH试纸、纳氏比色管、紫外分光光度仪、10%葡萄糖注射液。
三、原理

本品为无水葡萄糖的灭菌水溶液。含葡萄糖(C6H12O6·H2O)应为标示量的95.0%~105.0%。
[鉴别]取本品,缓缓滴入温热的碱性酒石酸铜试液中,即生成氧化亚铜的红色沉淀。
原理:
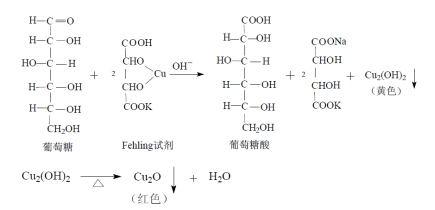
5-羟甲基糠醛
原理:葡萄糖注射液在高温加热灭菌时,易分解产生5-羟甲基糠醛: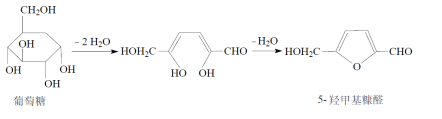
利用5-羟甲基糠醛在284nm的波长处有吸收,而葡萄糖无吸收,将样品配制成一定浓度的溶液,在284nm的波长处测定,规定吸收度不得大于0.32来控制5-羟甲基糠醛的量。
[含量测定]
旋光法(原理: 葡萄糖分子中含不对称碳原子,具有旋光性,在一定条件下,其水溶液的比旋度[α]tD为+52.5°~+53.0°,根据旋光度α与浓度C的比例关系可进行含量测定:

式中L为液层厚度(dm),C为溶液的百分浓度(g/mL,按干燥品或无水物计算)。所以:

四、实验方法
1.鉴别 取本品,缓缓滴入温热的碱性酒石酸铜试液中,即生成氧化亚铜的红色沉淀。
[检查] pH值 应为3.2~5.5。
2.精密量取本品适量(约相当于葡萄糖1.0g),置100mL量瓶中,加水稀释至刻度,摇匀,在284nm的波长处测定,吸收度不得大于0.32。
3.重金属 取本品30ml(约相当于葡萄糖3g),必要时,蒸发至约20mL,放冷,加醋酸盐缓冲液(pH3.5)2mL与水适量使成25mL,置25mL纳氏比色管中。另取标准铅溶液1ml与醋酸盐缓冲液(pH3.5)2mL后,加水稀释成25mL,置另一25mL纳氏比色管中。若供试液带颜色,可在标准管中滴加少量的稀焦糖溶液或其他无干扰的有色溶液,使之与样品管颜色一致;再在两管中分别加硫代乙酰胺试液各2mL,摇匀,放置2分钟,同置白纸上,自上向下透视,样品管所显颜色与标准管比较,不得更深)。按葡萄糖含量计算,含重金属不得过百万分之五。
4.含量测定 精密量取本品100ml(约相当于葡萄糖10g),置100mL量瓶中,加氨试液0.2mL
(10%或10%以下规格的本品可直接取样测定),用水稀释至刻度,摇匀,静置10分钟,测定旋光度。用读数至0.01°并经过检定的旋光计,将测定管(长度为1dm)用供试液体冲洗数次,缓缓注入供试液体适量(注意勿使发生气泡),置于旋光计内检测读数,记录旋光度,同法读取旋光度3次,取3次的平均值作为样品的旋光度。与2.0852相乘,即得100mL供试液中含有C6H12O6·H2O的重量(g)。
测定前用水校正零点,测定后再用水核对零点,若零点变动,应重测。
五、实验结果
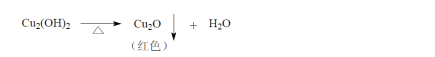 1. 鉴别
1. 鉴别
原理:
实验现象:生成红色沉淀。 见图一。
结论:符合规定。
2. 检查
实验现象:pH为
结论:符合规定。(3.2~5.5)
3. 吸光度
实验现象:吸光度为0.142
结论:符合规定(<0.32)
4. 重金属
实验现象:样品管颜色浅于标准管。见图二。
结论:符合规定。
4. 含量测定
实验现象:旋光度为5.35,100mL供试液中含有C6H12O6·H2O的重量(g)为11.16g。
结论:符合规定。
六、结果分析


图一 鉴别实验 图二 葡萄糖注射液重金属实验
注:葡萄糖注射液与碱性酒石酸铜溶液反应 注:左为样品管,右为标准管,
成红色,pH约为4.8。 左管颜色浅于右管。
七、讨论
1. pH值测定时,每次更换标准缓冲液或供试液前,应用纯化水充分洗涤电极,然后将水吸尽,也可用所换的标准缓冲液或供试液洗涤。配制标准缓冲液与溶解供试品的水,应是新沸过的冷蒸馏水,其pH值应为5.5~7.0。
2. 旋光仪接通电源后需预热5~20分钟。每次测定前后应用溶剂作空白校正。配制溶液及测定时,均应调节温度至20℃±0.5℃(除另有规定外)。供试溶液应澄清,如显浑浊或含有混悬的小粒,应预先滤过,并弃去初滤液。旋光管装样时应注意光路中不应有气泡,使用后应立即用水洗净晾干,切勿用刷子刷,也不能用高温烘烤。
3、用旋光度法测定葡萄糖的含量时,要加氨试液,是加速变旋作用,促进达到平衡,否则测得的旋光度数据不准。
-
葡萄糖注射液中葡萄糖含量的测定 实验报告
设计性实验报告题目葡萄糖注射液中葡萄糖含量的测定课程名称姓名学号系别专业班级指导教师职称实验学期至学年第学期葡萄糖注射液中葡萄糖含…
-
植物组织中可溶性糖含量的测定实验报告
植物组织中可溶性糖含量的测定实验报告10科四谭晓东20xx2501024一实验目的掌握蒽酮比色法测定可溶性糖含量的提取和方法原理掌…
-
生物化学实验报告示范-3,5-二硝基水杨酸法测定葡萄糖标准曲线
生物化学实验示范报告35二硝基水杨酸比色定糖法定制葡萄糖标准曲线马铃薯总糖含量测定实验二35二硝基水杨酸比色定糖法定制葡萄糖标准曲…
-
葡萄糖注射液中葡萄糖含量的测定3
太原师范学院设计性实验报告题目葡萄糖注射液中葡萄糖含量的测定课程名称分析化学实验姓名xx学号xx系别化学专业化学专业班级xx指导教…
-
生物化学实验报告-3,5-二硝基水杨酸法测定葡萄糖标准曲线
生物化学实验示范报告35二硝基水杨酸比色定糖法定制葡萄糖标准曲线马铃薯总糖含量测定实验二35二硝基水杨酸比色定糖法定制葡萄糖标准曲…
-
分析化学实验 钙片中钙含量的测定 实验报告
实验报告姓名班级同组人项目钙片中钙含量的测定课程分析化学学号一实验目的1掌握标定EDTA方法22掌握EDTA法测定水中Ca含量的原…
-
沉淀滴定测定酱油中氯化钠含量实验报告
沉淀滴定法测定酱油中的氯化钠含量一实验目的1熟悉沉淀滴定法的基本操作2了解实验原理过程及注意事项3掌握沉淀滴定法对实际样品酱油的分…
-
钻井液中固相含量的测定实验报告
中国石油大学油田化学实验报告实验日期成绩班级学号姓名教师同组者实验四钻井液中固相含量的测定一实验目的1掌握固相含量测定仪的操作方法…
-
乳制品中三聚氰胺的含量的测定(高效液相色谱法)实验报告
20xx级化学教育仪器化学综合性与设计性实验指导老师曹20xx年5月30号一实验目的1通过分析化学综合性实验设计性实验培养学生初步…
-
熏肉制品中亚硝酸盐含量的测定实验报告
熏肉制品中亚硝酸盐含量的测定华南师范大学09化一摘要肉制品是一类深受人民群众喜爱的食品在其生产过程中多采用亚硝酸盐作为发色剂它不仅…
-
实验二 Folin-Wu法定量测定血糖的含量附图和计算
实验二FolinWu法定量测定血糖的含量一实验目的1掌握FolinWu法测定血糖含量的原理和方法2学会制备无蛋白血滤液3掌握720…