极化曲线实验报告
腐蚀金属电极稳态极化曲线测量和数据处理
一、实验目的:
1、掌握恒电位测定极化曲线的原理和方法
2、巩固金属极化理论,确定金属实施阳极保护的可能性。初步了解阳极保护参数及其确
定方法。
3、了解恒电位仪器及相关电化学仪器的使用。
4、测定铁在酸性介质中的极化曲线, 求算自腐蚀电位、自腐蚀电流、掌握线性扫描伏安法
和TAFEL方法测定极化曲线。
实验原理
铁在酸溶液中,将不断被溶解,同时产生H2,即:
Fe + 2H+ = Fe2+ + H2 (a)
Fe/HCl体系是-个二重电极,即在Fe/H+界面上同时进行两个电极反应: FeFe2+ + 2e (b)
2H+ + 2eH2 (c)
反应(b)、(c)称为共轭反应。正是由于反应(c)存在,反应(b)才能不断进行,
这就是铁在酸性介质中腐蚀的主要原因。
当电极不与外电路接通时,其净电流I总为零。在稳定状态下,铁溶解的阳极电
流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:
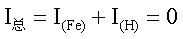
(1)
IFe的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势
称为Fe/H+体系的自腐蚀电势εcor。
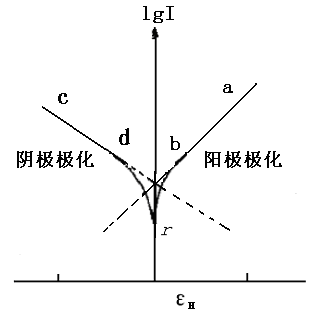
图12-1 Fe的极化曲线
图12-1是Fe在H+中的阳极极化和阴极极化曲线图。当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。此时,电化学过程以Fe的溶解为主要倾向。通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。。由于反应(c)是由迁越步骤所控制,所以符合塔菲尔(Tafel)半对数关系,即:
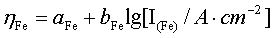
(2)
直线的斜率为bFe。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。同理,可获得阴极极化曲线rdc。由于H+在Fe电极上还原出H2的过程也是由迁越步骤所控制,故阴极极化曲线也符合塔菲尔关系,即:
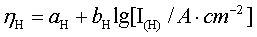
(3)
当把阳极极化曲线abr的直线部分ab和阴极极化曲线cdr的直线部分cd外延,理论上应交于一点(z),z点的纵坐标就是 ,腐蚀电流Icor的对数,而z点的横坐标则表示自腐蚀电势εcor的大小。
恒电势方法和恒电流方法的简单线路如图12-3所示:
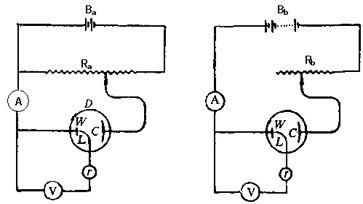
(a)恒电势法 (b)恒电流法
图12-3 恒电势和恒电流测量原理
Ba--低压稳压电源;Bb--稳压电源; Ra--低电阻; Rb--高电阻 A--精密电流表 V--高阻抗毫伏计; L--鲁金毛细管;W--工作电极;C--辅助电极; r --参考电极;
三、仪器药品
仪器:电化学分析仪,电解池、辅助电极.铂电极、带盐桥的饱和甘汞电极、工作电极碳钢
药品:粒度为400、600号砂纸。
实验溶液:(1)1mol/L的HCl溶液,中性水溶液;蒸馏水;
四、实验步骤
1.仪器装置及电极处理
采用三室电解池。辅助电极室和工作电极室之间采用玻璃砂隔板。工作电极为铁电极,与铂电极相对,工作电极的结构见5所示。
工作电极先后用400/600粒度的砂纸抛光,水冲洗干净,将电极固定在电极杆上,擦拭干净后待用。
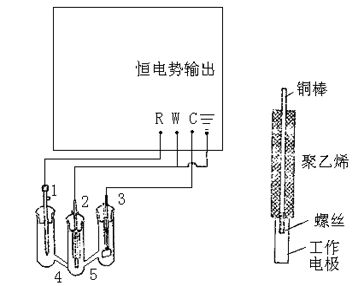
图12-4 恒电势法测定极化曲线装置图 图12-5 工作电极
1. 饱和甘汞电极;2. Fe工作电极 3. 铂片辅助电极;4&5. 玻璃沙隔板
2. 线性扫描伏安法测量铁的极化曲线
在工作站中选择线性扫描伏安法(Linear Sweep Voltammetry),设置电位范围为-0.5V ~ +0.8V ,扫描速率为3mV/s,,可由仪器自动获得整个的极化曲线。所采用的扫描速率(即电势变化的速率)需要根据研究体系的性质选定。一般来讲,电极表面建立稳态的速率越慢,扫描速率就应越慢。
按顺序依次测定第(1)、(2)组溶液体系下的极化曲线。
测完之后,应使仪器复原,清洗电极,记录室温。
五、数据处理
1. 由ORIGIN画图,由二条切线的交点z求εco、Icor、jcor (mA/cm2)。并分别求出斜率bH和bFe。
注:自腐蚀电流密度jcor与自腐蚀速率的换算关系如下
,
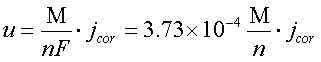
式中u为腐蚀速率(g/m2·h),jcor为自腐蚀电流密度,M为金属的摩尔质量(g/mol),n为金属的原子价
2. 由极化曲线求钝化电势εp、钝化电流Ip和钝化电流密度ip。
-1
-2
logi
-3-4-5
-0.8
-0.6
-0.4
-0.2
0.0
Potential/V
A-B
Linear Regression for Data1_B: Y = A + B * X
Parameter Value Error
------------------------------------------------------------ A B
-4.72304 -- -4.01949 --
[C-D
Linear Regression for Data1_B: Y = A + B * X
Parameter Value Error
------------------------------------------------------------ A B
0.21759 -- 6.30474 --
------------------------------------------------------------
R SD N P
------------------------------------------------------------
-1 0 2 <0.0001
------------------------------------------------------------
交点(-0.476708464,-2.80900673)
缓蚀剂浓度(mg/L) 腐蚀电流icorr (A/cm2)
塔菲尔斜率ba (V) 塔菲尔斜率bc (V) 自然电位Eocp (V)
------------------------------------------------------------
R SD N P
------------------------------------------------------------
1 0 2 <0.0001
------------------------------------------------------------
1mol/L 缓蚀
率
0.001552362
6.30474 -4.01949 -0.508
第二篇:铁的极化曲线物化实验报告
铁的极化曲线
实验结果的记录与处理:
1、 Fe在0.1mol/L的硫酸溶液中铁的极化钝化曲线
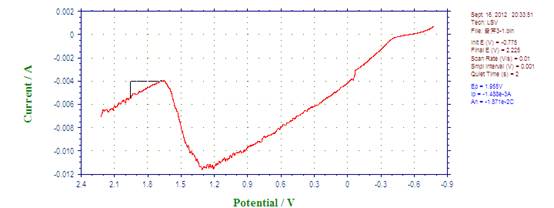
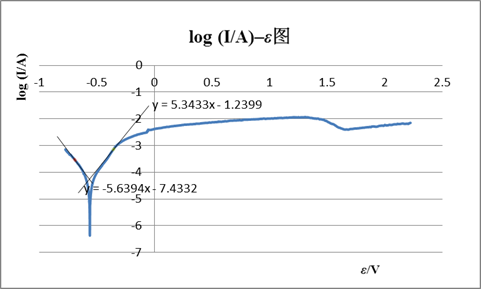
联立两直线方程得:log Icorr= ?4.25A , Icorr=5.58×10?5A ; Ecorr= ?0.56V。
因为实验所用电极直径为2mm,面积为Πmm2,
故自腐蚀电流密度=自腐蚀电流/电极面积=5.58×10?5 /(Π×0.0012)=17.8(A/ m2)
由图知,钝化电流Ip=1.14×10?2A,
钝化电流密度=1.14×10?2/(Π×0.0012)=3.63×103(A/ m2)
钝化电位范围:1.318?1.602V
2、 Fe在1.0mol/L的硫酸溶液中铁的极化钝化曲线
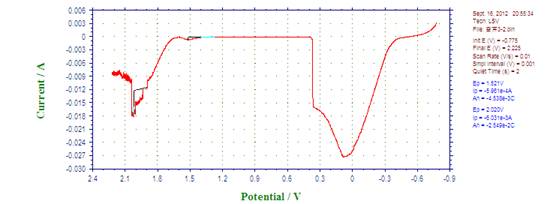

联立两直线方程得:log Icorr= ?4.25A , Icorr=5.58×10?5A ; Ecorr= ?0.56V。
因为实验所用电极直径为2mm,面积为Πmm2,
故自腐蚀电流密度=自腐蚀电流/电极面积=5.58×10?5 /(Π×0.0012)=17.8(A/ m2)
由图知,钝化电流Ip=1.14×10?2A,
钝化电流密度=1.14×10?2/(Π×0.0012)=3.63×103(A/ m2)
钝化电位范围:1.318?1.602V
3、 Fe在1.0mol/L的HCl溶液中铁的极化钝化曲线
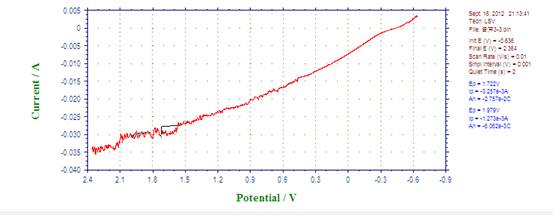

联立两直线方程得:log Icorr= ?4.25A , Icorr=5.58×10?5A ; Ecorr= ?0.56V。
因为实验所用电极直径为2mm,面积为Πmm2,
故自腐蚀电流密度=自腐蚀电流/电极面积=5.58×10?5 /(Π×0.0012)=17.8(A/ m2)
由图知,钝化电流Ip=1.14×10?2A,
钝化电流密度=1.14×10?2/(Π×0.0012)=3.63×103(A/ m2)
钝化电位范围:1.318?1.602V
4、 Fe在含1%的乌洛托品的1.0mol/L的HCl溶液中铁的极化钝化曲线
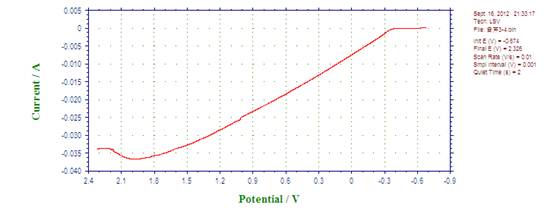
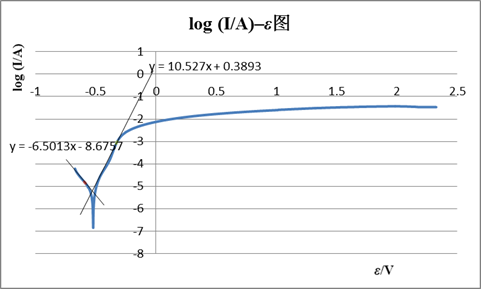
联立两直线方程得:log Icorr= ?4.25A , Icorr=5.58×10?5A ; Ecorr= ?0.56V。
因为实验所用电极直径为2mm,面积为Πmm2,
故自腐蚀电流密度=自腐蚀电流/电极面积=5.58×10?5 /(Π×0.0012)=17.8(A/ m2)
由图知,钝化电流Ip=1.14×10?2A,
钝化电流密度=1.14×10?2/(Π×0.0012)=3.63×103(A/ m2)
钝化电位范围:1.318?1.602V
-
极化曲线实验报告
腐蚀金属电极稳态极化曲线测量和数据处理一实验目的1掌握恒电位测定极化曲线的原理和方法2巩固金属极化理论确定金属实施阳极保护的可能性…
-
实验报告-极化曲线测量金属的腐蚀速度
湖南大学实验报告课程实验者名称页数专业年级班同组者姓名级别姓名实验日期年月日一目的和要求1掌握恒电位法测定电极极化曲线的原理和实验…
- 极化曲线-实验报告
-
Zn电极阳极极化曲线实验报告
一实验目的1掌握阳极极化曲线测试的基本原理和方法2测定Zn电极在1MKOH溶液和1MZnCl溶液中的阳极极化曲线23通过实验理解金…
- 第二个实验阳极极化曲线的测量
-
电磁场与电磁波实验报告-反射实验和极化波的产生与检测
内蒙古工业大学信息工程学院实验报告课程名称电磁场与电磁波实验名称反射实验和极化波的产生与检测实验类型验证性综合性设计性实验室名称电…
-
稀溶液法测定偶极矩实验报告(华南师范大学物化实验)
稀溶液法测定偶极矩一实验目的1掌握溶液法测定偶极矩的主要实验技术2了解偶极矩与分子电性质的关系3测定正丁醇的偶极矩二实验原理21偶…
-
水溶液电化学稳定窗口的测定实验报告
一实验目的1理解电位窗口的意义2掌握阴极极化曲线和阳极极化曲线的使用方法3测量玻碳电极在酸性中性和碱性溶液中的阳极和阴极极化曲线二…
-
实验报告-极化曲线测量金属的腐蚀速度
湖南大学实验报告课程实验者名称页数专业年级班同组者姓名级别姓名实验日期年月日一目的和要求1掌握恒电位法测定电极极化曲线的原理和实验…
- 极化曲线-实验报告