极化曲线-实验报告
第二篇:Zn电极阳极极化曲线实验报告
一、实验目的
1. 掌握阳极极化曲线测试的基本原理和方法;
2. 测定Zn电极在1M KOH溶液和1M ZnCl2溶液中的阳极极化曲线;
3. 通过实验理解金属电极钝化与活化过程。
二、实验原理
线性电位扫描法是指控制电极电位在一定的电位范围内,以一定的速度均匀连续的变化,同时记录下各电位下反应的电流密度,从而得到电位-电流密度曲线,即稳态电流密度与电位之间的函数关系:i= f(ψ)。
特别适用于测量电极表面状态有特殊变化的极化曲线。如下:如阳极钝化行为的阳极极化曲线。
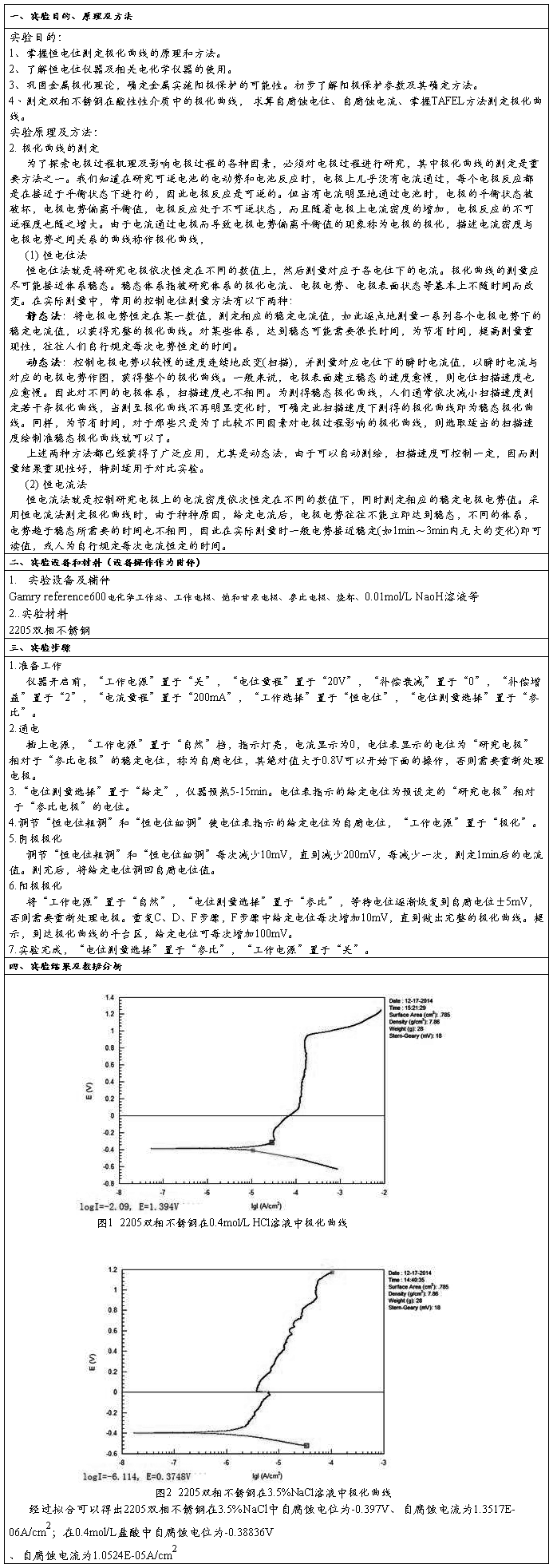
阳极极化:金属作为阳极时在一定的外电势下发生的阳极溶解过程叫做阳极极化,如下式所示:M = Mn+ + ne 【金属的钝化现象:阳极的溶解速度随电位变正而逐渐增大。这是正常的阳极溶出。但当阳极电位正到某一数值时,其溶解速度达到一最大值。此后阳极溶解速度随着电位变正,反而大幅度的降低,这种现象称为金属的钝化现象。】 线性电位扫描法不但可以测定阴极极化曲线,也可以测定阳极极化曲线,特别适用于测定电极表面状态有特殊变化的极化曲线,如测定具有阳极钝化行为的阳极极化曲线,用线性电位扫描法测得的阳极极化曲线,如下图所示
? AB段-----称为活性溶解区;此时金属进行正常的阳极溶解,阳极电流随电位改变服从Tafel公式的半对数关系。
? BC段-----称为钝化过渡区;此时是由于金属开始发生钝化,随着电极电位的正移,金属的溶解速度反而减小了。
? CD段-----称为钝化稳定区;在该区域中金属的溶解速度基本上不随电位二改变;
? DE段-----称为过度钝化区;此时金属溶解速度重新随电位的正移而增大,为氧的析出或者高价金属离子的生成。
从阳极极化曲线上可以得到下列参数:c点对应的电位---临界钝化电位;c点对应的电流—临界钝化电流密度;而这些参数恒电流法是测不出来的。
影响金属钝化的因素很多,包括溶液的组成、金属的组成和结构以及外界条件。
金属Zn是中性锌锰电池、碱性锌锰电池和锌-空气电池等的负极材料,其电化学行为受到广泛的研究。本实验应用线性电位扫描法测量金属Zn电极在1M KOH和1M ZnCl2 中阳极极化曲线。实验中控制电极电位以较慢的速度连续地改变(扫描),并测量对应电位下的瞬时电流值,并以瞬时电流与对应的电极电位作图,获得整个的极化曲线,故称为动电位法。
三、实验器材
CHI电化学工作站、锌电极、Hg/HgO电极、甘汞电极、铂电极、三口电解槽、1M KOH溶液250ml、1M ZnCl2溶液250ml。
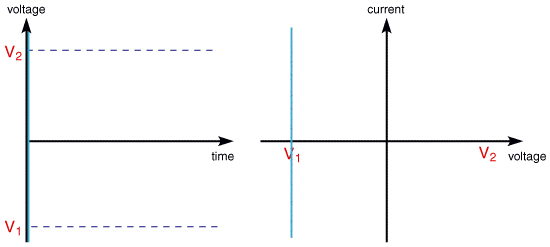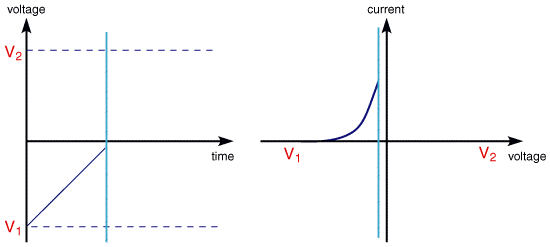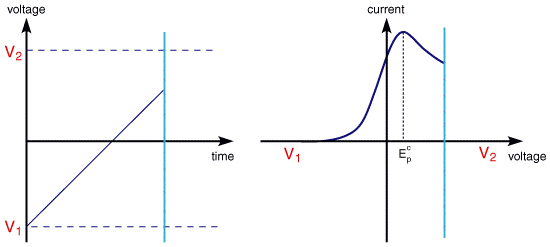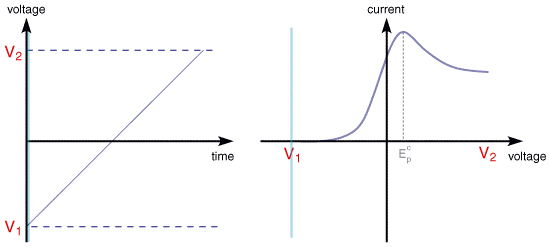
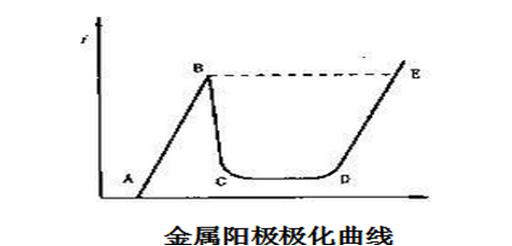
左:仪器施加的电压信号;
右:测量到的电流-电压关系曲线(极化曲线)

控制电压方法的测量回路和极化回路
四、实验步骤
(1)电极预处理
将锌电极在砂纸上轻轻打磨至光亮,除去氧化膜,用去离子水冲洗干净,铂电极用硫酸浸泡以除去表面杂质,并用去离子水冲洗。
(2)极化曲线测定
启动工作站,运行CHI测试软件,在Setup菜单中单击“Technique”选项,在弹出菜单中选择电化学工作站中的线性电位扫描技术(Linear Sweep Voltammetry)分别测量Zn电极在1M KOH溶液和1M ZnCl2溶液中常温和450C的阳极极化曲线(扫描速率5mV/s,从开路到截止电压分别为-1.0V和-0.5V) 。
(3)测试完成
关闭仪器,将电极清洗干净待用。
四、实验数据处理及分析
1.每种溶液中不同温度下的极化曲线叠加在同一张图中。

图1.Zn电极在KOH溶液中,不同温度下的阳极极化曲线
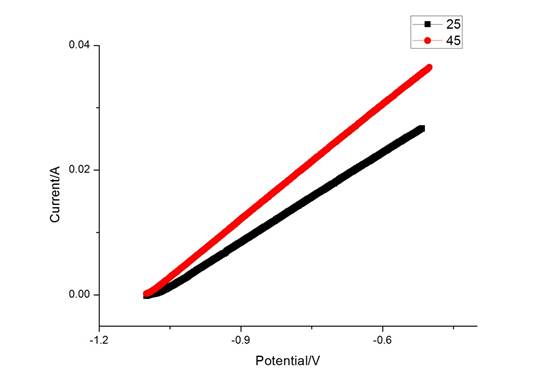
图2. Zn电极在ZnCl2溶液中,不同温度下的阳极极化曲线
2. 结合文献,指出图中的活性溶解区、过渡钝化区、稳定钝化区和过度钝化区。
以图一45℃为例,AB为活性溶解区,BC为过渡钝化区,CD为稳定钝化区,D之后有一段电流随电势的增加而上升的过度钝化区DE,本次实验结果并没看到。
3. 比较不同溶液中电极的阳极极化行为。尝试分析原因。
3.1 Zn电极在KOH溶液中,不同温度下的阳极极化分析(如图1)
3.1.1 25℃下,Zn电极在KOH溶液中的极化
25℃时,从开路电位正向扫描到第一个峰之间为活性溶解区。此时电极上的Zn被氧化成Zn2+离子,电极正常溶解,产生氧化电流,无钝化现象。峰对应的电流为氧化电流Ipa=0.00244,氧化峰对应的电位为氧化峰电位jpa= -1.2,也称为临界钝化电流、临界钝化电势。
此后,曲线出现三个峰,为过渡钝化区。电流随着电势增加,经过一番波动之后,迅速减至最少。这是因为在金属表面产生了一层电阻高,耐腐蚀的钝化膜(ZnO或Zn(OH)2)。而产生波动的原因是刚开始生成的Zn的氧化物不致密,容易脱落,电极表面在重复生成钝化膜和脱落的过程,最后,随着电势的增加,生成了致密的氧化膜,使电流迅速下降至最小。
电势继续增加,电流基本不变地保持在一个很小的数值上,该区为钝化稳定区,该电流称为钝化电流。
由于扫描的终止电压定得比较小,所以并没有看到过度钝化区。过度钝化区是随着电势的继续增大,电流再次随着电势上升而增大,表示阳极又发生了氧化过程,可能是高阶金属离子产生,也可能是水分解放出氧气。
3.1.2 45℃下,Zn电极在KOH溶液中的极化
在45℃下的曲线与25℃同理。但因为在温度高是氧化过程更容易进行,使电极表面一开始钝化时,就产生了致密的钝化膜,而在过渡钝化区看不到波动,只有一个峰。
3.2 Zn电极在ZnCl2溶液中,不同温度下的阳极极化分析(如图2)
3.2 Zn电极在ZnCl2溶液中,不同温度下的阳极极化分析
3.2.1 25℃下,Zn电极在ZnCl2溶液中的极化
随着电势的增加,电流一直在上升。此时电极上的Zn被氧化成Zn2+离子,电极正常溶解,产生氧化电流,无钝化现象。因为Zn电极在ZnCl2溶液中不会钝化,所以没有出现氧化峰,一直处于活性溶解区。
3.2.2 45℃下,Zn电极在ZnCl2溶液中的极化
与25℃下同理。
3.3对比25℃和45℃下,Zn电极在KOH溶液中的极化
对比45℃下和25℃下的氧化峰对应的电流,明显可以看出,两者都是高温下比低温下要大。因为温度越高,离子迁移速率越快,浓差极化越小;电化学反应速率加快,电化学极化变小,所以临界钝化电流增大。
4.根据不同温度下氧化峰面积的大小,比较温度对氧化电量的影响。
以图1为例,对图1的两条曲线的氧化峰积分得, S45℃= 6.5936285*10-4,S25℃= 4.6644505*10-4,S45℃> S25℃,由于S表示了U*I/v(扫描速度)=I*t=Q,所以对于相同电极,相同电解质而言,温度越高,氧化电量越大。
五、参考文献
覃奇贤,刘淑兰 . 电极的极化和极化曲线(Ⅰ).天津大学 化工学院,天津 300072
覃奇贤,刘淑兰 . 电极的极化和极化曲线(Ⅱ).天津大学 化工学院,天津 300072
-
极化曲线实验报告
腐蚀金属电极稳态极化曲线测量和数据处理一实验目的1掌握恒电位测定极化曲线的原理和方法2巩固金属极化理论确定金属实施阳极保护的可能性…
-
实验报告-极化曲线测量金属的腐蚀速度
湖南大学实验报告课程实验者名称页数专业年级班同组者姓名级别姓名实验日期年月日一目的和要求1掌握恒电位法测定电极极化曲线的原理和实验…
- 极化曲线-实验报告
- 第二个实验阳极极化曲线的测量
-
20xx年山东省大学生实验能竞赛 物理化学实验 极化曲线的测定
物理化学实验实验一1极化曲线的测定说明1本实验竞赛时间为120分钟以选手在实验报告首页确认编号和监考教师签名为准每超时10分钟扣5…
-
电磁场与电磁波实验报告-反射实验和极化波的产生与检测
内蒙古工业大学信息工程学院实验报告课程名称电磁场与电磁波实验名称反射实验和极化波的产生与检测实验类型验证性综合性设计性实验室名称电…
-
稀溶液法测定偶极矩实验报告(华南师范大学物化实验)
稀溶液法测定偶极矩一实验目的1掌握溶液法测定偶极矩的主要实验技术2了解偶极矩与分子电性质的关系3测定正丁醇的偶极矩二实验原理21偶…
-
水溶液电化学稳定窗口的测定实验报告
一实验目的1理解电位窗口的意义2掌握阴极极化曲线和阳极极化曲线的使用方法3测量玻碳电极在酸性中性和碱性溶液中的阳极和阴极极化曲线二…
-
极化曲线实验报告
腐蚀金属电极稳态极化曲线测量和数据处理一实验目的1掌握恒电位测定极化曲线的原理和方法2巩固金属极化理论确定金属实施阳极保护的可能性…
-
实验报告-极化曲线测量金属的腐蚀速度
湖南大学实验报告课程实验者名称页数专业年级班同组者姓名级别姓名实验日期年月日一目的和要求1掌握恒电位法测定电极极化曲线的原理和实验…