羧酸及其衍生物的性质
羧酸及其衍生物的性质
目的
验证羧酸及其衍生物的主要化学性质。
原理
羧酸最典型的化学性质是具有酸性,酸性比碳酸强,故羧酸不仅溶于氢氧化钠溶液,而且也溶于碳酸氢钠溶液。饱和一元羧酸中,以甲酸酸性最强,而低级饱和二元羧酸的酸性又比一元羧酸强。羧酸能与碱作用成盐,与醇作用成酯。甲酸和草酸还具有较强的还原性,甲酸能发生银镜反应,但不与裴林试剂反应。草酸能被高锰酸钾氧化,此反应用于定量分析。
羧酸衍生物都含有酰基 结构,具有相似的化学性质。在一定条件下,都能发生水解,醇解、氨解反应,其活泼性为:酰卤>酸酐>酯>酰胺。
药品
甲酸,乙酸,冰乙酸,草酸,苯甲酸,硫酸(3mol·L-1),盐酸(6mol·L-1),乙酰氧,乙酸酐,乙酸乙酯,乙酰胺,无水乙醇,饱和碳酸钠溶液,氢氧化钠溶液(5%,20%),硝酸银溶液(5%),三氯化铁(1%),苯胺(新蒸),刚果红试纸。
实 验 步 骤
[一] 羧酸的性质
1.酸性试验 在3支试管中,分别加入5滴甲酸、5滴乙酸,0.2g草酸,各加入lmL蒸馏水,振摇使其溶解。然后用玻璃棒分别蘸取少许酸液,在同一条刚果红试纸上划线。比较试纸颜色的变化和颜色的深浅,并比较三种酸的酸性强弱。
2. 成盐反应
[1] 苯甲酸钠的生成与分解。取0.2G苯甲酸晶体,加入lmL水,振摇后观察溶解情况。然后滴加几滴20%NaOH溶液,振摇后观察有什么变化。再滴加几滴6mol·L-1盐酸溶液,振摇后再观察现象。
[2] 乙酸铁的形成与分解。在试管中滴入3滴冰乙酸并加入2mL水,用5%NaOH溶液中和至中性(碱不要过量),然后加1滴1%FeCL3溶液,振摇后,观察溶液呈现的颜色。再加热煮沸1~2分钟,观察发生何种变化[2]。
3. 成酯反应 在干燥试管中,加入1mL无水乙醇和1mL冰乙酸,并滴加3滴浓H2SO4。摇匀后放入70~80℃水浴中,加热10分钟(也可在直接火上加热,微沸2~3分钟)。放置冷却后,再滴加约3mL饱和Na2CO3溶液,中和反应液至出现明显分层,并可闻到特殊香味。
4. 甲酸的还原性(银镜反应):准备3支洁净试管中加入1mL20%NaOH溶液[3],并滴[1]
加5~6滴甲酸溶液。
在第2支试管中,加入1mL(1∶1)氨水,并滴入5~6滴5%AgNO3溶液。再取第3支洁净试管,将上述两种溶液一并倒入其中,并摇匀。若产生沉淀,则补加几滴氨水,直至沉淀完全消失,形成无色透明溶液。然后,将试管放入90~95℃水浴中,加热10分钟,观察银镜的析出。
二 羧酸衍生物的性质
1.水解反应
(1)乙酰氯的水解。在试管中加入1mL蒸馏水,沿管壁慢慢滴加3滴乙酰氯,略微振摇试管,乙酰氯与水剧烈作用,并放出热(用手摸试管底部)。待试管冷却后,再滴加1~2滴2%AgNO3溶液,观察溶液有何变化。
(2)乙酸酐的水解。在试管中加入lmL水,并滴加3滴乙酸酐,由于它不溶于水,呈珠粒状沉于管底。再略微加热试管,这时乙酸酐的珠粒消失,并嗅到何种气味。说明乙酸酐受热发生水解,生成了何种物质。
(3)酯的水解。在三支试管中,分别加入1mL乙酸乙酯和1mL水。然后在第1支试管中,再加入0.5mL3mol·LH2SO4,在第2支试管中再加入0.5mL20%NaOH,将三支试管同时放入70~80℃的水浴中,一边振摇,一边观察并比较酯层消失的快慢。
(4)酰胺的水解
碱性水解。在试管中加入0.2g乙酰胺和2mL20%NaOH溶液,小火加热至沸,嗅氨的气味并可在试管口用润湿的试纸检验。
酸性水解。在试管中加入0.2g乙酰胺和2m13mol.LH2SO4小火加热至沸,闻一闻-1-1
有无乙酸的气味。冷却后加入10%NaOH溶液至碱性,再加热并嗅其气味(或用试纸检验)。
2.醇解反应
(1)乙酰氯的醇解。在干燥的试管中加入1mL无水乙醇,在冷却与振摇下沿试管壁慢慢滴入1mL乙酰氯。反应进行剧烈并放热,待试管冷却后,再慢慢加入约3mL饱和Na2CO3溶液中和至出现明显的分层,并可闻到特殊香味。
(2)乙酸酐的醇解。在干燥的试管中加入1mL无水乙醇和1mL乙酸酐,混匀后,再加3~4滴浓硫酸。振摇下在小火上微沸。放置冷却后,慢慢加入约3mL饱和Na2CO3溶液中和至析出酯层,并可闻到特殊香味。
3.胺解反应
(1)在干燥试管中加入0.5mL新蒸苯胺,再滴加0.5mL乙酰氯,振摇后,用手摸试管底部有无放热。然后,再加入2~3mL水,观察有无结晶析出。
(2)在干燥试管中加入0.5mL新蒸苯胺,再滴加0.5mL乙酸酐,振摇并用小火加热几分钟,冷却后,加入2~3mL水,观察有无结晶析出。
注释 [4]
[1]刚果红试纸与弱酸作用呈棕黑色,与中强酸作用呈蓝黑色,与强酸作用呈稳定的蓝色。
[2]3NaAc+FeCl3→FeAc3+3NaCl,生成的乙酸铁立即部分水解成碱式六乙酸铁络离子
[Fe3(OH)2Ac6]+1C1-1,使溶液呈淡红棕色。煮沸时进一步水解,生成不溶于水的碱式乙酸铁Fe(OH)Ac2呈红棕色絮状沉淀。
[3]甲酸的酸性较强,假使直接加到弱碱性的银氨溶液中,银氨络离于将被破坏,析不出银镜,故需用碱液中和甲酸。
[4]乙酰氯与醇反应十分剧烈,并有爆破声。滴加时要慢,一滴一滴加入,防止液体从试管内溅出。
思 考 题
1.在羧酸及其衍生物与乙醇反应中,为什么在加入饱和碳酸钠溶液后,乙酸乙酯才分层浮在液面上?
2.为什么酯化反应中要加浓硫酸?为什么碱性介质能加速酯的水解反应?
3.甲酸具有还原性,能发生银镜反应。其它羧酸是否也有此性质?为什么?
4.根据实验事实,比较各种羧酸衍生物的化学活泼性。
第二篇:羧酸及其衍生物的物理性质
目前位置:首页—>羧酸及其衍生物—>K2 羧酸及其衍生物的物理性质
羧酸及其衍生物的物理性质
教学目标:
1.了解羧酸一般物理性质及其影响因素。
2.掌握羧酸及其衍生物 IR 特征。
教学重点:IR特征
教学安排:B5, K1—>K2;10min
一、一般物理性质
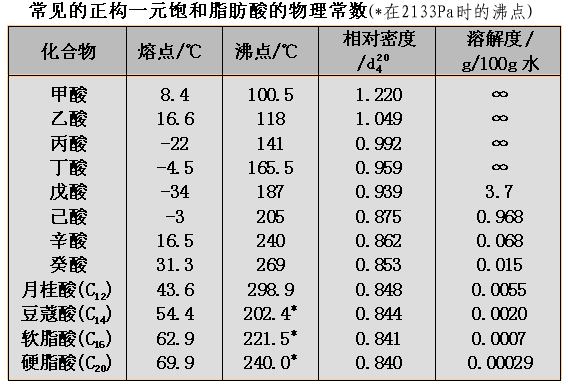
低级的一元羧酸(C1-C9)是液体,C1-C3的羧酸有一定挥发性,并且有较强的刺激性;C4-C9的羧酸不同程度地具有腐败气味,并且是具有一定粘度的油状液体。C10以上的羧酸则是石蜡状固体,气味很小。二元羧酸以及芳香族羧酸都是晶体。
羧酸的沸点较分子量相近的醇高,这是由于羧基的强极性和分子间的氢键所致。在气态时,甲酸、乙酸等是以双分子缔合形态出现。与烷烃相似,偶数碳原子的羧酸其熔点要比与之相邻的奇数碳原子羧酸的熔点高。
C1-C4 的正构羧酸由于分子的极性大,与水分子可很好地形成氢键,所以它们的溶解度很大;但正戊酸在水中的溶解度只有3.7g/100g水。高级的一元酸在水中的溶解度非常小,甚至不溶于水。常见的二元酸在水中都有很好的溶解度。
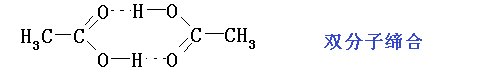
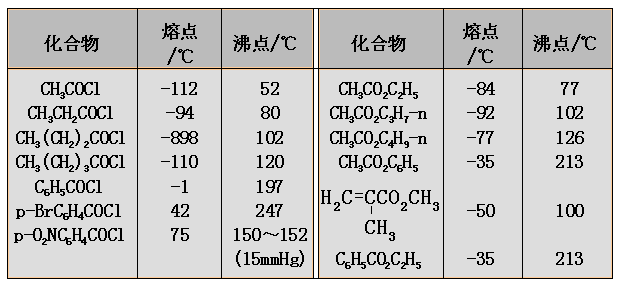
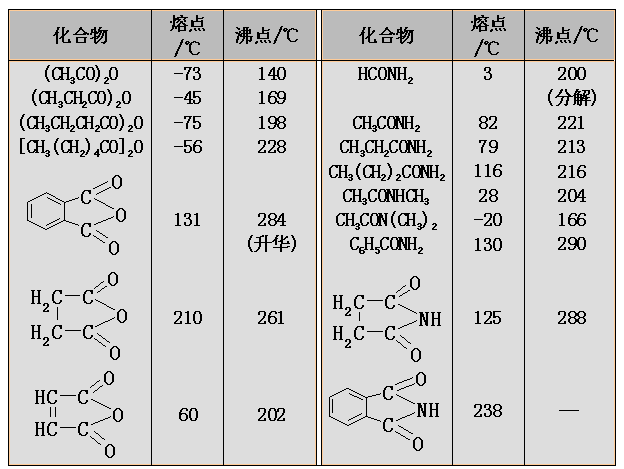
酰氯、酸酐和酯的沸点与分子量相近的醛酮大体相近,酰胺由于分子间可形成氢键,而具有很高的沸点。低级的酯和酰胺在水中有一定的溶解度;但低级的酰氯和酸酐在水中容易发生水解。一般情况下,酰氯和酯的熔点比较低,酰胺的熔点较高,不同的酸酐的熔点变化是较大的。
低级的酰氯和酸酐都有刺鼻气味,而低级的酯却有芳香气味并可用作香料;低级的酰胺是良好的非质子型极性溶剂。常见的羧酸及其衍生物在一般的有机溶剂中有良好的溶解性。
一些常见的羧酸衍生物的熔点和沸点如下表:
二、光波谱性质
由于羧酸分子的羟基之间可形成氢键,在 3300cm-1 处有非常强而宽的羟基的特征峰,并且该峰可含盖烃基中的 CH3 和 CH2 的 C-H 键伸缩振动吸收峰的区域;在 2500-2700cm-1 处,还有 O-H 键的伸缩振动。另外,OH 的弯曲摆动(面外摇摆)在 925cm-1 处有一个比较宽的特征吸收峰。脂肪族羧酸中的羰基在 1700-1725cm-1 处有中等强度的吸收,而芳香族羧酸的羰基在 1680-1700cm-1 处有吸收。在羧酸的各种衍生物中,羰基在红外光谱中出现吸收的位置是不同的,羰基越缺电子,吸收波数越高;羧酸根据负离子的红外吸收波数是最低的。 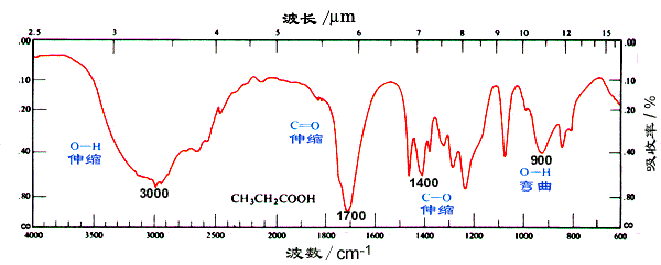
丙酸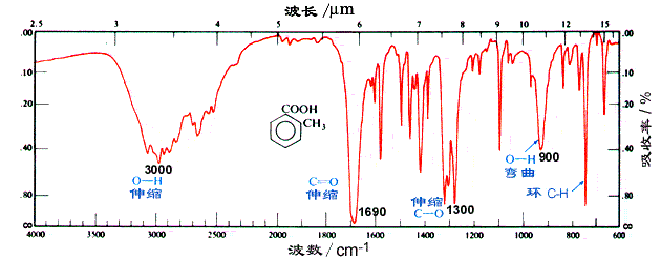
邻甲苯甲酸
邻甲苯甲酰氯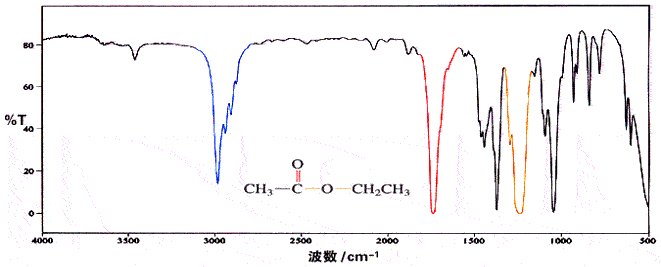
乙酸乙酯
邻甲苯甲酰氯
乙酸乙酯
x羰基的影响下,其化学位移多在δ=2.2-2.5。
三、关键词
羧酸的物理性质、羧酸的光波谱性质
-
实验四 醇、酚、醛、酮、羧酸以及衍生物的性质
实验报告学院第二临床医学院专业临床医学年级级班级班姓名学号日期20xx55实验课程有机化学实验实验名称实验四多元醇酚醛酮羧酸以及衍…
-
醛、酮、羧酸及其衍生物的性质和乙酸乙酯的制备
实验二醛、酮、羧酸及其衍生物的性质和乙酸乙酯的制备(一)醛、酮、羧酸及其衍生物的性质课时数:4学时教学目标:通过本项目的学习,使学…
-
羧酸及其衍生物的性质
实验四羧酸及其衍生物的性质一实验目的:1验证羧酸及其衍生物的性质.2了解肥皂的制备原理和性质二实验内容:1羧酸的性质2羧酸衍生物的…
-
苏州大学有机化学实验-羧酸及其衍生物的性质
苏州大学化学化工学院课程教案实验名称羧酸及其衍生物的性质教学目标知识与技能通过实验验证羧酸及其衍生物的性质进一步加深对羧酸及其衍生…
-
羧酸及其衍生物的物理性质
目前位置首页gt羧酸及其衍生物gtK2羧酸及其衍生物的物理性质羧酸及其衍生物的物理性质教学目标1了解羧酸一般物理性质及其影响因素2…