苏州大学有机化学实验-羧酸及其衍生物的性质
苏州大学化学化工学院课程教案
[实验名称] 羧酸及其衍生物的性质
[教学目标] 知识与技能: 通过实验验证羧酸及其衍生物的性质,进一步加深对羧酸及其衍
生物化学性质的认识;了解肥皂的制备原理及其性质。
[教学重点] 羧酸及其衍生物的化学性质。
[教学难点] 掌握羧酸及其衍生物的主要化学性质,归纳各类物质的相似性和不同点。
[教学方法] 比较法,归纳法
[教学过程]
[引言] 本次实验内容是:羧酸及其衍生物的性质。
[讲述] 1. 羧酸的性质
(1)酸性试验:
分别蘸取液体样品或固体样品的水溶液在同一条刚果红试纸上画线,比较各线条的颜色及深浅程度。
样品:甲酸,乙酸,草酸 [1]。用量减半。
(2)氧化作用:
取1支试管加入1 mL稀硫酸(1:5)和1 mLKMnO4,分成3份;分别加入样品,小火加热煮沸。观察现象并比较反应速率。
样品:甲酸,乙酸,草酸。用量减半。
[讲述] 2. 酰氯和酸酐的性质[3]
样品:乙酰氯,乙酸酐
(1)水解作用:先取适量去离子水,缓慢滴加乙酰氯[4]。水解结束后加入AgNO3
溶液。同时,做乙酸酐水解。
(2)醇解作用:干燥试管中加入1 mL无水乙醇,1 mL样品。反应结束后加水,
以20%的Na2CO3溶液中和至中性,有酯层浮起。同时,做乙酸酐醇解。
(3)氨解作用:干燥试管中加入5滴新蒸馏的苯胺,8滴样品。反应结束后加水并
搅拌。观察现象[6]。同时,做乙酸酐氨解。
[讲述] 3. 酰胺的水解:
样品:乙酰胺
(1)碱性水解:0.1 g样品和1 mL 20%的NaOH溶液,水浴加热至沸[7]。用湿润[5][2]
的红色石蕊试纸检测气体的性质。
(2)酸性水解:0.1 g样品和2 mL 10%的H2SO4溶液,混匀,沸水浴煮沸2 min。冷却,加入20% NaOH溶液至碱性,加热,用湿润的红色石蕊试纸检测气体的性质。
[讲述] 4. 油脂的皂化:
大试管中加入猪油小半匙,3 mL95%乙醇和3 mL 30-40%的NaOH溶液,沸
水中煮沸成一相[10],继续加热10 min。将粘稠液倒入温热的饱和NaCl溶液中[11]。
(1)脂肪酸的析出:取少量肥皂加适量水,加热。再加1:5 H2SO4 2 mL水解,可观
察到浅黄色脂肪酸浮起。
(2)钙离子与肥皂的作用:取少量肥皂加适量水,加2滴10%的CaCl2溶液,振荡
(3)肥皂的乳化作用:肥皂中加水得乳浊液。
[讲述] 【注释】
1. 刚果红试纸的变色范围是pH = 3-5,故而本实验也可以用精密pH试纸代替。酸性越强的样品,划线的颜色越亮。草酸酸性最强,划线为亮蓝色;甲酸其次,蓝色;乙酸酸性最弱,深兰色。
2. 甲酸的还原性最强,KMnO4溶液褪色最快,其次是草酸。若硫酸的量偏少或反应时间较短,则可能得到棕色MnO2沉淀,而不是无色溶液。乙酸不会使酸性KMnO4溶液褪色。
3. 为了比较反应速率,酰氯和酸酐的实验同时做。醇解和氨解需要用干燥的试管,因而安排先做。酸酐反应较酰氯难,需要较长时间地水浴加热。
4. 试管要洁净,用去离子水洗净。不能取用自来水,因为其中有Cl离子会干扰检测。乙酰氯的水解相当剧烈,请务必在通风橱中进行,而且滴加要慢。
5. 如果没有酯层浮起,可以加入少量粉状的NaCl至饱和。在饱和食盐水中酯的溶解度会减小。
6. 产物乙酰苯胺不溶于水,是白色沉淀。
7. 常温下,酰胺与碱液反应不会生成氨气,只有加热以后才能反应。这一特性可以用于鉴别酰胺和有机铵盐。
8. 酸性水解后,产生硫酸铵。再与NaOH反应,产生氨气。虽然乙酰胺酸性和碱性条件下都可以水解,经过各自的后处理能够检测到氨气的产生,但是实验原理是不同的。
9. 从节约出发,两人一组完成油脂的皂化。将猪油蘸取在玻棒一端,小心插入试管底部。 [12][9][8]。
10. 皂化完全是关键。皂化时加入乙醇的目的是使油脂和碱液能混为一相,加速皂化的进行。如果皂化太久,乙醇挥发尽,则得不到液态的皂化液,同时也会影响皂化的效果。可以补加乙醇。
检测皂化是否完全的方法:取几滴皂化液放入另一试管,加入2 mL蒸馏水,加热并振荡。若无油滴则已皂化完全。
11. 由于缺乏硬化油,盐析时可能得不到块状肥皂。
12. 这是模拟一个硬水的环境,生成不溶于水的脂肪酸钙。
第二篇:苏州大学有机化学实验-己二酸的制备
苏州大学材料与化学化工学部课程教案
[实验名称] 己二酸的制备
[教学目标] 知识与技能: 学习用硝酸氧化环己醇制备已二酸的原理和方法,掌握尾气吸收、过滤、等操作技术。
[教学重点] 已二酸的原理和方法,尾气吸收操作技术。
[教学难点] 控制好氧化反应速度,防止有毒的二氧化氮气体外逸。
[教学方法] 讨论法,归纳法。
[教学过程]
[讲述] 【实验目的】 通过本次实验,要求大家掌握己二酸的制备原理和方法,掌握尾气吸收、过滤等操作技术。
[提问] 【实验原理】
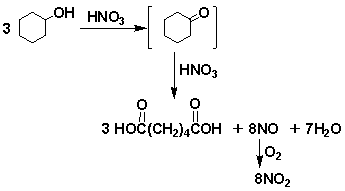
[复述] 硝酸和高锰酸钾都是强氧化剂,由于其氧化的选择性较差,故硝酸主要用于羧酸的制备,高锰酸钾氧化的应用范围较硝酸广些,它们都可以将环己醇直接氧化为己二酸。
本实验以50%硝酸为氧化剂,并以(偏)钒酸铵为催化剂,氧化环己醇至环己酮,后者再通过烯醇式被氧化开环而生成己二酸。在反应过程中产生的一氧化氮极易被空气中的氧气氧化成二氧化氮气体,用碱液吸收。
[演示] 【实验装置图】

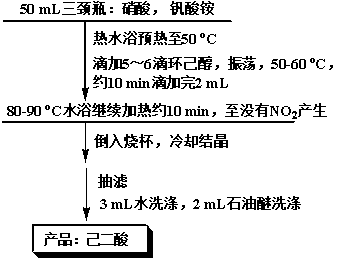
[讲述] 【实验步骤】反应瓶中加入6 mL 50%的硝酸[1]和少许钒酸铵[2],水浴加热至50 °C后移去水浴[3],缓慢滴加5~6滴环己醇[4],摇动至反应开始,即有红棕色二氧化氮气体放出,维持反应温度50~60 °C,将剩余的环己醇滴加完毕,总量为2 mL[5]。加完后继续振荡,并用80~90 °C水浴加热10 min。无红棕色气体逸出,反应即结束。将反应液倒入50 mL烧杯中[6],冷却,结晶,抽滤,3 mL水洗,2 mL石油醚分两次洗[7],干燥,称重。
纯己二酸为白色晶体,mp.153 °C。
【实验流程图】
[讲述] 【注释】
[1] 浓硝酸和环己醇切不可用同一个量筒取用,以防两者相遇剧烈反应发生爆炸。建议两位学生合用两个量筒。
[2] 钒酸铵不可多加,否则产品发黄。不加钒酸铵也可以。
[3] 实验中要同时监测水浴温度和反应液的温度。
[4] 为防止反应过快,环己醇要慢加,并注意控温,防止太多有毒的二氧化氮气体产生,来不及被碱液吸收而外逸到空气中。另外,环己醇的熔点为25.15 °C,通常为粘稠的液体。为了减少转移的损失,可用少量水冲洗量筒,并入滴液漏斗中,这样既降低了环己醇的凝固点,也可避免漏斗堵塞。
[5] 此反应为强放热反应,切不可大量加入,以免反应过于剧烈,引起爆炸。
[6] 反应结束后,装置中还有残留的二氧化氮气体,拆卸装置请至通风橱内。
[7] 利于样品快干。
[作业] P.120 第1,2题
附教师参考资料:偏钒酸铵(NH4VO3)简介
偏钒酸铵(ammonium metavanadate),又名钒酸铵(ammonium vanadate),无色至黄色结晶粉末。粉尘能刺激眼睛、皮肤和呼吸道。吸入和口服可致死亡,吸入引起咳嗽、胸痛、口中金属味和精神症状;对肝、肾有损害;皮肤接触可引起荨麻疹。对环境有危害,对水体可造成污染。本品不燃,有毒,具刺激性。
远离火种、热源;防止阳光直射;应与还原剂、易(可)燃物、食用化学品分开存放,切忌混储。空气中粉尘浓度超标时,必须佩戴自吸过滤式防尘口罩。紧急事态抢救或撤离时,应该佩戴空气呼吸器。戴化学安全防护眼镜;穿防毒物渗透工作服;戴橡胶手套。
-
实验四 醇、酚、醛、酮、羧酸以及衍生物的性质
实验报告学院第二临床医学院专业临床医学年级级班级班姓名学号日期20xx55实验课程有机化学实验实验名称实验四多元醇酚醛酮羧酸以及衍…
-
醛、酮、羧酸及其衍生物的性质和乙酸乙酯的制备
实验二醛、酮、羧酸及其衍生物的性质和乙酸乙酯的制备(一)醛、酮、羧酸及其衍生物的性质课时数:4学时教学目标:通过本项目的学习,使学…
-
羧酸及其衍生物的性质
实验四羧酸及其衍生物的性质一实验目的:1验证羧酸及其衍生物的性质.2了解肥皂的制备原理和性质二实验内容:1羧酸的性质2羧酸衍生物的…
-
羧酸及其衍生物的性质
羧酸及其衍生物的性质目的验证羧酸及其衍生物的主要化学性质原理羧酸最典型的化学性质是具有酸性酸性比碳酸强故羧酸不仅溶于氢氧化钠溶液而…
-
羧酸及其衍生物的物理性质
目前位置首页gt羧酸及其衍生物gtK2羧酸及其衍生物的物理性质羧酸及其衍生物的物理性质教学目标1了解羧酸一般物理性质及其影响因素2…