盐酸标准溶液的配制与标定
中宁职业教育培训中心化工专业化工分析技能考核试卷
班级__________姓名:___________ 成绩:__________
_______________________________________________________________________________
实验题目:盐酸标准溶液的配制与标定
一、目的要求
1. 练习溶液的配制和滴定的准备工作,训练滴定操作,进一步掌握滴定操作。
2. 学会用基准物质标定盐酸浓度的方法。
3. 了解强酸弱碱盐滴定过程中 pH 的变化。
4. 熟悉指示剂的变色观察,掌握终点的控制。
二、实验原理
市售盐酸为无色透明的HCl水溶液,HCl含量为36%~38%(W/W),相对密度约为1.18。由于浓盐酸易挥发出HCl气体,若直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。
标定盐酸的基准物质常用碳酸钠和硼砂等,本实验采用无水碳酸钠为基准物质,以甲基红-溴甲酚绿混合指示剂指示终点,无水碳酸钠作基准物质的优点是容易提纯,价格便宜。缺点是碳酸钠摩尔质量较小,具有吸湿性。因此Na2CO3固体需先在270℃~300℃高温炉中灼烧至恒重,然后置于干燥器中冷却后备用。
计量点时溶液的 pH为3.89,用待标定的盐酸溶液滴定至溶液由绿色变为暗红色后煮沸2 min,冷却后继续滴定至溶液再呈暗红色即为终点。根据Na2CO3的质量和所消耗的 HCl 体积,可以计算出HCl的准确浓度。
用Na2CO3标定时反应为:2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
反应本身由于产生H2CO3会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此,接近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。
三、实验用品
分析天平(感量0.01mg/分度),量筒,称量瓶,25mL酸式滴定管,250mL锥形瓶。
工作基准试剂无水Na2CO3:先置于270℃~300℃高温炉中灼烧至恒重后,保存于干燥器中。浓HCl(浓或0.1mol/L),
溴甲酚绿(3.8-5.4)一甲基红(4.4-6.2)指示液(变色点pH=5.1):溶液 Ⅰ: 称取0.1 g 溴甲酚绿,溶于乙醇(95%),用乙醇(95%)稀释至100m L;溶液 Ⅱ; 称取0.2 g 甲基红,溶于乙醇(95%),用乙醇(95% )稀释至100m L;取 30 m L溶液I, 10m L溶液Ⅱ,混匀。
四、实验步骤
(1)0.1mol.L-1盐酸溶液的配制: 用小量筒取浓盐酸3.6ml,加水稀释至400ml混匀即得.
(2) 盐酸标准滴定溶液的标定
取在270~300℃干燥至恒重的基准无水碳酸钠约0.12~0.14g,精密称定3份,分别置于250ml锥形瓶中,加50ml蒸馏水溶解后,加甲基红-溴甲酚绿混合指示剂10滴,用盐酸溶液(0.1mol·L-1)滴定至溶液又由绿变紫红色,煮沸约2min。冷却至室温(或旋摇2min)继续滴定至暗紫色,记下所消耗的标准溶液的体积, 同时做空白试验
五、实验结果
(1)数据记录

(2)结果计算
盐酸标准滴定溶液的浓度[c(HCl)].数值以摩尔每升(mol/L)表示,按下式计算:
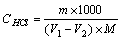
式中 : m — 无水碳酸钠的质量的准确数值,单位为克(g);
V1— 盐酸溶液的体积的数值,单位为毫升(mL);
V2 — 空白试验盐酸溶液的体积的数值,单位为毫升(mL)
M— 无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol),[(1/2Na2CO3)=52.994]。 CHCl =? MNCO3=105.99
计算步骤:
第二篇:盐酸标准溶液的配制和标定规范
原理
由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。
标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:
Na2CO3 + 2HCl 2NaCl + CO2 + H2O
滴定至反应完全时,溶液pH为3.89,通常选用溴甲酚绿-甲基红混合液作指示剂。
二、试剂
1.浓盐酸(密度1.19)
2.溴甲酚绿-甲基红混合液指示剂:量取30mL溴甲酚绿乙醇溶液(2g/L),加入20mL甲基红乙醇溶液(1g/L),混匀。
盐酸标准滴定液的浓度 C(NaOH) 1mol L工作基准试剂无水碳酸钠的质量1.9m/g
盐酸标准滴定液的浓度[ C(HCl)],数值以摩尔每升(mol/L)表示,按式(2)计算
C(HCl)=100m/[v1-v2]M
式中: m-----无水碳酸钠的质量的准确数值,单位为克(g);
V1---盐酸溶液的体积的数值,单位是毫升(mL);
V2---空白试验盐酸溶液的体积的数值,单位是毫升(mL);
M--- 水碳酸钠的摩尔质量的数值,单位为克没摩尔(g/mol)[M(1/2Na2C2O3)=52.994]。
四、注意事项
干燥至恒重的无水碳酸钠有吸湿性,因此在标定中精密称取基准无水碳酸钠时,宜采用“减量法”称取,并应迅速将称量瓶加盖密闭。
在滴定过程中产生的二氧化碳,使终点变色不够敏锐。因此,在溶液滴定进行至临近终点时,应将溶液加热煮沸,以除去二氧化碳,待冷至室温后,再继续滴定。
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
盐酸标准溶液的配制与标定
盐酸标准溶液的配制与标定一实验目的与要求1掌握用无水碳酸钠作基准物质标定盐酸溶液的原理和方法2正确判断甲基橙指示剂的滴定终点二实验…
-
盐酸标准溶液的配制与标定
一考核目的1学会直接法配制标准溶液的方法2学会盐酸溶液的标定方法3学会使用分析天平称取试样4练习容量瓶移液管滴定管的操作方法二实验…
-
盐酸和氢氧化钠标准溶液浓度的标定实验报告
盐酸和氢氧化钠标准溶液浓度的标定实验报告一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲酸氢钾的性质及应用3进一步…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
盐酸和氢氧化钠标准溶液浓度的标定实验报告
盐酸和氢氧化钠标准溶液浓度的标定实验报告一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲酸氢钾的性质及应用3进一步…
-
盐酸标准溶液的配制与标定
盐酸标准溶液的配制与标定一实验目的与要求1掌握用无水碳酸钠作基准物质标定盐酸溶液的原理和方法2正确判断甲基橙指示剂的滴定终点二实验…
-
化学实验报告——盐酸溶液的标定
化学实验报告无机及分析化学题目盐酸溶液的标定学院班级姓名学号指导老师年月日制时间盐酸浓度的标定一实验目的1练习酸碱标准溶液的标定方…