实验化学 实验六 苯甲醇和苯甲酸的合成
实验六 苯甲醇和苯甲酸的合成
一. 实验目的
1.掌握坎尼查罗反应的原理和方法
2.了解苯甲醇和苯甲酸的其他制备方法
3. 了解苯甲醇和苯甲酸的主要用途
4.掌握有机固体化合物和液体化合物的分离纯化方法及纯度的测定方法
二.实验原理

扩大反应:
——不含α-H 的醛,如呋喃甲醛,对甲基苯甲醛,甲醛(季戊四醇的制
备)
应用:
苯甲醇:香料
苯甲酸:防腐剂
主要试剂的理化性质

三. 主要仪器和药品
烧杯、锥形瓶、分液漏斗、蒸馏烧瓶、球形冷凝管、蒸馏头、直形冷凝管、尾接管、三口瓶,吸滤瓶、布氏漏斗、玻璃水泵、电热水浴锅、电子天平,折光仪
苯甲醛、氢氧化钾、乙醚、亚硫酸钠、碳酸钠、硫酸镁、
四. 实验内容


 (锥形瓶)KOH(18g,0.32mol),水 (18mL) 冷至室温 ,加新蒸苯甲醛(21g,20mL,0.2mol) 放置24h(橡皮塞)
(锥形瓶)KOH(18g,0.32mol),水 (18mL) 冷至室温 ,加新蒸苯甲醛(21g,20mL,0.2mol) 放置24h(橡皮塞)
 加水(60~70mL) (分液漏斗)乙醚(20mL)萃取3次
加水(60~70mL) (分液漏斗)乙醚(20mL)萃取3次



 乙醚层(苯甲醇):10mL饱和Na2SO3 10mL 10% Na2CO3 10mL 水(弃水层) 无水K2CO3 或无水MgSO4干燥 水浴蒸乙醚
乙醚层(苯甲醇):10mL饱和Na2SO3 10mL 10% Na2CO3 10mL 水(弃水层) 无水K2CO3 或无水MgSO4干燥 水浴蒸乙醚




 蒸馏 收集204~206℃馏分 称重 计算收率 测折光率
蒸馏 收集204~206℃馏分 称重 计算收率 测折光率



 水层(苯甲酸):酸化 冷却 沉淀析出 吸滤
水层(苯甲酸):酸化 冷却 沉淀析出 吸滤


 水重结晶 称重 计算收率 测熔点
水重结晶 称重 计算收率 测熔点
五. 注意事项
§ 固体化合物的分离纯化方法及纯度的测定方法:
——重结晶 吸滤 测熔点
§ 液体化合物的分离纯化方法及纯度的测定方法:
——萃取 蒸馏 测折光率
六. 思考题
1.苯甲醇和苯甲酸有哪些其他制备方法?
2.对于合成的固体有机固体化合物如何让进行分离和纯化?
3.对于合成的液体化合物如何让进行分离和纯化
第二篇:苯甲酸和苯甲醇
苯甲酸和苯甲醇的制备
一、目的
1、悉反应原理,掌握苯甲酸和苯甲醇的制备方法。
2、复习分液漏斗的使用及重结晶、抽滤等操作。

二、原理
副反应 Ph-CHO O2 Ph-COOH
分液漏斗的使用
(1)检查玻璃塞和旋塞芯是否与分液漏斗配套:分液漏斗中装少量水,检查旋塞芯处是否漏水。将漏斗倒转过来检查玻璃塞是否漏水,待确认不漏水后方可使用。
(2)在旋塞芯上薄薄地涂上一层润滑脂,将塞芯塞进旋塞内旋转数圈使润滑脂均匀分布后将旋塞关闭好,在再在塞芯的凹槽处套上一个直径合适的橡皮圈 ,以防旋塞芯在操作过程中松动。
(3)分液漏斗中全部液体的总体积不得超过其容量的3/4。盛有液体的分液漏斗应正确地放在支架上。如图10-1。
萃取操作方法
(1)如图10-1装置,在分液漏斗中加入溶液和一定量的萃取溶剂后,塞上玻璃塞(注意:玻璃上若有侧槽必须将其与漏半上端颈部上的小孔错开!)
(2)用左手握住漏斗上端颈部,将其从支架下取下,再按图10-2所示的特殊手势握住。对于惯用右手的操作者,常用左手食指末节顶住上玻璃塞再用大拇指和中指夹住漏斗上端颈部;右手的食指和中指蜷握地旋塞柄上,食指和拇指要握住旋塞柄并能将其自由地旋转。对于左撇子只需将方向转过来即可。
(3)将漏斗由外向里或由里向外旋转振摇3~5次,使两种不相混溶的液体,尽可能充分混合(也可将漏斗反复倒转进行缓和地振摇,如图2)。
(4)待两相液体分层明显,界面清晰,移开玻璃塞或旋转带侧槽的玻璃塞使侧槽对准上口径的小孔。开启活塞,放出下层液体,收集在适当的容器中。当液层接近放完时要放慢速度,一俟放完则要迅速关闭旋塞。(将漏斗倒置,使漏斗下颈导管向上,不要向着自己和别人的脸。慢慢开启旋塞,排放可能产生的气体以解除超压。如图10-3。待压力减少后,关闭旋塞,振摇和放气应重复几次。将漏斗如图10-1放置,静置分层。
(5) 取下漏斗,打开上玻璃塞,将上层液体由上端口径倒出,收集到指定容器中。(注意:一定不要倒洒了)。
(6)假如一次萃取不能满足分离的要求,这时可采取多次萃取的的方法(但最多不超过5次)。将每次的有机相都归并到一个容器中。
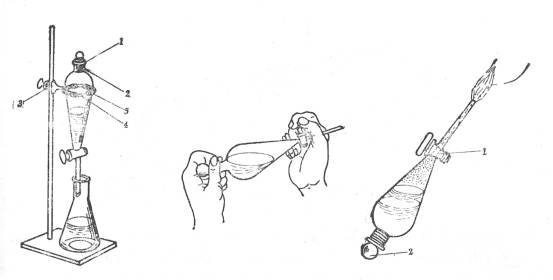
1、小孔,2、玻璃塞上侧槽,3持夹, 1、旋塞(用拇指和食指慢慢旋开),
4铁圈,5、缠扎物(布条或线绳) 2、玻璃塞(用食指顶住)
图1 分液漏斗的支架装置 图2 振荡萃娶取时持分液漏斗的操作手势 图3 解除漏斗内超压的操作示意图
三、试剂
Ph-CHO 10ml(0.118) KOH 9g(0.225mol)
乙醚 30ml NaHSO3 (饱和)
Na2CO3 10% HCl (浓) 无水MgSO4
四、实验装置


五、实验步骤
1、加料,歧化反应 :125ml锥形瓶中,加9gKOH ,9ml H2O和10ml Ph-CHO该反应是两相反应,不断振摇是关键。得白色糊状物。
2、萃取,分离:加水溶解,置于分液漏斗中。每次用10ml乙醚萃取,共萃取水层3次(萃取苯甲醇),水层保留。
3、洗涤醚层:依次用NaHSO3(饱和)、10%Na2CO3、H2O各5ml洗涤醚层。 除去Ph-CHO, 酸性NaHSO3, 盐
4、干燥,蒸馏: 用无水MgSO4干燥半小时。水浴回收乙醚。用空气冷凝管收集Ph-CH2OH 200-204 oC馏分。N201.5396,约4-5g.
5、酸化,重结晶:浓盐酸酸化使刚果红试纸变蓝,冷却析出Ph-COOH。必要时用水重结晶。约8-9g.mp.121-122oC
七、实验指导
1.原料苯甲醛易被空气氧化,所以保存时间较长的苯甲醛,使用前应重新蒸馏;
2.锥形瓶的塞子应选用软木塞或橡皮塞,不宜用玻璃塞;
3.振摇过程中,若瓶内温度过高,须适时把锥形瓶中冷却;
4.加水后,如不能溶解,可稍微加热;
5.用30ml乙醚分三次萃取,每次用10ml,第一次、第二次萃取后,上层(乙醚层)在烧杯中合并,下层(水层)继续用乙醚萃取;
6.合并的乙醚层用无水硫酸镁和无水碳酸钾干燥时,振荡后要静置片刻至澄清;
7.干燥后的乙醚层慢慢倒入干燥的蒸馏烧瓶中,注意不要将底部的干燥剂倒入;
8.蒸馏乙醚层时不能用明火加热;
9.乙醚蒸完后立刻回收,改用明火加热,放掉冷凝管夹层中的水,用空气冷凝苯甲醇;
10.水层酸化后,减压抽滤得到苯甲酸粗品,回收留作重结晶实验用。
八 注意事项
1.如果第一步反应不能充分振摇,会影响后续反应的产率。如混合充分,放置24小时后混合物通常在瓶内固化,苯甲醛气味消失;
2.用分液漏斗分液时,水层从下面分出,乙醚层要从上面倒出,否则会影响后面的操作;
3.用干燥剂干燥时,一定要澄清后才能倒在蒸馏瓶中蒸馏,否则蒸出的产物不纯;
4.水层如果酸化不完全,会使苯甲酸不能充分析出,导致产物损失。
九、教学法
1.请同学事先预习理论书上康尼扎罗反应的原理;
2.请同学查阅乙醚的沸点,课堂讲解蒸馏乙醚的注意事项;
3.组织学生讨论用饱和亚硫酸氢钠溶液洗涤什么杂质。
十、思考题
1.问:为什么要振摇?白色糊状物是什么?
2.问:各部洗涤分别除去什么?
3.问:萃取后的水溶液,酸化到中性是否最合适?为什么?不用试纸,怎样知道酸化已恰当?
-
苯甲醇和苯甲酸的制备
南昌大学有机化学实验报告学生姓名小田田学号专业班级实验类型验证综合设计创新实验日期20xx年4月24日实验地点同组学生姓名指导教师…
-
实验十苯甲醇和苯甲酸的制备
实验十苯甲醇和苯甲酸的制备一实验目的1学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法2进一步熟悉机械搅拌器的使用3进一步掌握萃取洗涤蒸…
-
苯甲醇和苯甲酸的制备
苯甲醇和苯甲酸的制备185本实验根据什么原理来分离纯化苯甲醇和苯甲酸这两种产物的答根据苯甲酸钠苯甲醇在水中和在乙醚中的溶解度不同苯…
-
苯甲醇和苯甲酸的制备预习报告及思考题
苯甲醇和苯甲酸的制备一实验目的1学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法2巩固机械搅拌器的使用3进一步掌握萃取洗涤蒸馏干燥和重结…
-
实验化学 实验六 苯甲醇和苯甲酸的合成
实验化学刘晓庚实验六苯甲醇和苯甲酸的合成一实验目的1掌握坎尼查罗反应的原理和方法2了解苯甲醇和苯甲酸的其他制备方法3了解苯甲醇和苯…
-
苯甲醇和苯甲酸的制备预习报告及思考题
苯甲醇和苯甲酸的制备一实验目的1学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法2巩固机械搅拌器的使用3进一步掌握萃取洗涤蒸馏干燥和重结…
-
苯甲醇和苯甲酸的制备
南昌大学有机化学实验报告学生姓名小田田学号专业班级实验类型验证综合设计创新实验日期20xx年4月24日实验地点同组学生姓名指导教师…
-
实验十苯甲醇和苯甲酸的制备
实验十苯甲醇和苯甲酸的制备一实验目的1学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法2进一步熟悉机械搅拌器的使用3进一步掌握萃取洗涤蒸…
-
苯亚甲基苯乙酮的制备(期末实验报告)
苯亚甲基苯乙酮的制备一实验的目的和要求1掌握羟醛缩合反应的原理和机理学会苯亚甲基苯乙酮的合成方法2掌握水蒸气蒸馏3掌握反应温度控制…
- 实验课教案呋喃甲醇和呋喃甲酸的制备