离子迁移数的测定实验报告
离子迁移数的测定——界面法
姓名: 学号: 班级:(同组实验者:)
实验日期:提交报告日期:
实验助教:
1 引言
1.1 实验目的
1.采用界面法测定H+离子的迁移数。
2.掌握测定离子迁移数的基本原理与方法。
1.2 实验原理[1]
当电流通过电解池溶液时,电极上发生化学变化,溶液中阳离子与阴离子分别向阴极和阳极迁移。若两种离子传递的电荷量分别为q+和q-,通过的总电荷量为
Q=?++??
每种离子传递的电荷量与总电荷量之比称为离子迁移数,则阴、阳离子的迁移数分别为
????=?+=
且?++??=1
在包含数种电解质的溶液中,t-和t+分别为所有阴、阳离子迁移数总和,一般增加某种离子浓度,其离子迁移数增加;对只含一种电解质的溶液,浓度的改变使离子间引力场改变,自然离子迁移数也改变;若温度改变,迁移数亦变化,一般温度升高时,t-和t+差别减小。
实验中采用界面法,以镉离子作为指示离子,测量一定浓度的盐酸溶液中H+离子迁移数。在一截面均匀的垂直放置的迁移管中充满盐酸溶液,通以电流,当有Q电量的电流通过每个静止的截面时,t+Q当量的H+上行,t-Q当量的Cl-通过界面下移。假定在管的下部某处存在一个界面,界面以下没有H+而被Cd2+取代,此界面将随H+的上移而移动,界面位置可利用界面上下溶液pH值的不同,使用指示剂显色。正常条件下界面保持清晰,界面以上的一段溶液保持均匀,H+向上迁移的平均速率等于界面上移速率。在某通电时间t内,界面扫过体积V,H+输送电荷数为该体积中H+带电总数,即
?+=???
式中:C为H+的浓度,F为法拉第常数,电荷量以库[仑](C)计。
要想使界面保持清晰,须使界面上、下的电解质不相混合,这可
通过选择合适的指示离子在通电情况下达到,Cd2+就符合这个要求。
Cd2+的淌度(U)较小,有
?Cd2+<?H+
通电时,H+上行Cl-下移,Cd在Cd电极上氧化并经入溶液中生
成CdCl2,逐渐顶替HCl,在管内形成界面。由于溶液呈电中性,任
意截面都不会中断传递电流,H+迁移走后Cd2+紧随其后且两者迁移速
率相等,则
d?′d??Cd2+=?H+ d?′d?>
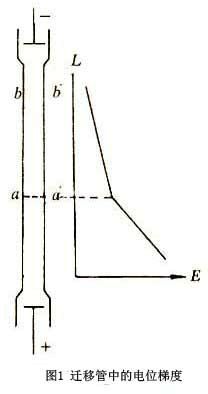
?+
说明CdCl2溶液中电位梯度较大(如图1),导致H+难以扩散至下层,而Cd2+也难以扩散到界面以上,可保持界面清晰。
2 实验操作
2.1 实验药品、仪器型号及测试装置示意图
迁移管,DC-0510节能型智能恒温槽,DHD300 V/500 mA直流稳压稳流电源,Cd电极,Ag电极,数字万用电表,HCl-甲基橙溶液(HCl浓度为0.1263 mol/L),秒表。
2.2 实验条件
实验室中为100.88 kPa,19.8 ℃。
2.3 实验操作步骤及方法要点
1.按图2安装仪器(实验室中溶液已配好),将恒温水浴调为25 ℃。先用去离子水清洗迁移管三次,再用溶液润洗三次,在管中加满溶液(注意不要有气泡)。将Cd电极套管中加满溶液(安装前检查电极,若表面被氧化则用砂纸打磨干净),安装在管下部。管垂直固定避免振荡,依图接线,检查无误后开始实验。
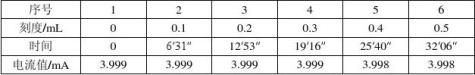
2.先做恒流,打开电源,开关搬至稳流,调节电流为4 mA。随电解进行,阳极不断溶解,将出现界面。界面移动至第一个刻度时立即打开秒表,此后每当界面移动至整刻度时记录时间及电流值,直至刻度为0.5 mL。
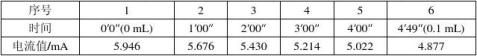
3.完成后,清洗、润洗迁移管并重新装好溶液。电源开关搬至稳压,调节电流在6~7 mA之间。需每隔1 min记录时间及电流值,每当界面移动至整刻度时记录时间及电流值,直至刻度为0.4 mL。
4.关闭开关,过几分钟后观察界面,再打开电源,数分钟再观察。试解释该现象。
5.整理实验仪器。
3 结果与讨论
3.1 原始实验数据
溶液酸度为0.1263 mol/L。 电流恒定:表1
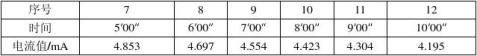

?+???=
离子迁移数计算式:
?+=
3.2 计算的数据结果
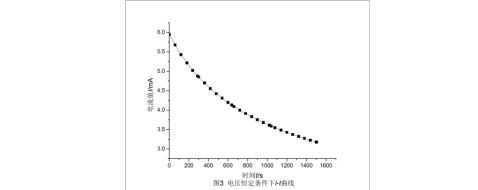
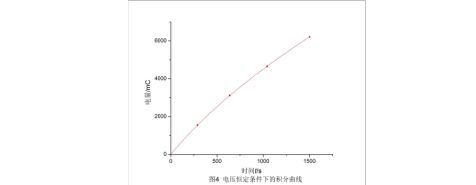
(1)电压恒定:分别作出电压恒定条件下的I-t曲线(图3)以及积分曲线(图4)。
从积分曲线图中可以读出第2、4、5整刻度点处(0刻度为第一刻度)的电量值,分别为1550.77 mC、4659.94 mC、6213.11 mC,从而分别求出刻度1~4、2~5、1~5所对应时间内的电量,表3列出了三个区段内的体积、时间和电荷量:
表3
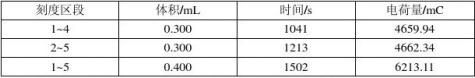
+t+(1~4)=0.7846 t+(2~5)=0.7842 t+(1~5)=0.7847
平均值为t+=0.7845,t-=0.2155
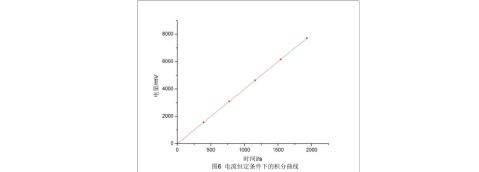
(2)电流恒定:如图5、6,分别为电流恒定条件下的电流-时间曲线和积分曲线。
从积分曲线图中可以读出第1、2、4、5整刻度点处(取0.1 mL刻度为第一刻度)的电量值,分别为1563.61 mC、3091.23 mC、6158.27 mC、7701.50 mV,列出表4
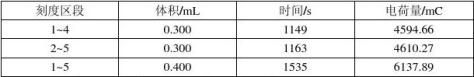
计算出各区段离子迁移数为
t+(1~4)=0.7958 t+ (2~5)=0.7931 t+ (1~5)=0.7943
平均值为t+=0.7944,t-=0.2056
3.3 讨论分析
1. 298.15 K下,H+浓度为0.1 mol/L时,迁移数的文献值为0.8314(本实验中可近似取该值为标准值),实验数据为0.7845和0.7944,两次实验平均值为0.7895,本组实验的结果偏小。
2.实验中观察到管内出现界面,界面上部分溶液为红色,下部呈无色。随着电解反应的进行,界面不断上移,且在银电极表面有气泡产生。关闭电源开关后,界面变得模糊,这是因为外加电场消失,界面上部的H+逐渐扩散所致;数分钟后打开电源,界面又变清晰。
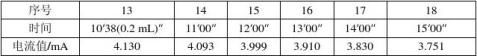
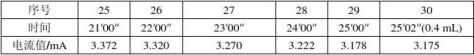
3.误差分析:实验的相对误差为-4.99%,误差略大。由于在做恒流法实验时测得的迁移数与文献值偏差较大,在所有实验完成后,本组又重做了一次恒流实验,为排除溶液浓度的影响,改用了另一瓶溶液。重做时先采用4 mA电流,中间又改用3 mA电流。结果如下:
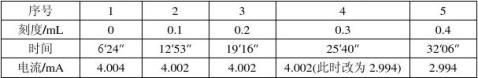
结果发现测得的迁移数依然在0.790附近,排除了操作失误和溶液浓度偏差的原因,初步判断可能是实验仪器造成的误差,如万用表未校正。
实验中要求管内不能有气泡,而电解过程中,Ag电极表面有气泡产生,应该也会对电路有一定影响。
4. 实验中迁移管需要先清洗三次,再用溶液润洗三次;给迁移管加溶液时不能有气泡,会造成断路。
4 结论
25 ℃条件下,恒流法测得迁移数为0.7944,恒压法为0.7845。
5 参考文献
[1] 贺德华,麻英,张连庆.基础物理化学实验.北京:高等教育出版社,2008:76-80.
6 附录
思考题
1.为什么在迁移过程中会得到一个稳定界面?为什么界面移动速率就是H离子移动 速率?
答:Cd2+的淌度(U)较小,H+和Cd2+迁移速率相等,即CdCl2溶液中电位梯度较大。++
若H扩散至CdCl2溶液中,则它要比Cd2+和界面上的H迁移的都要快,能返回HCl层,同理若Cd2+向上扩散至HCl溶液中也会很快返回至界面以下,这样界面将保持清晰。
+
2.实验过程中电流值为什么会逐渐减小?
+答:因为随着电解的进行,溶液中H浓度越来越小,单位时间内在银电极上参与反应
+的H也越来越少,所以电流值不断减小。
-3.如何求得Cl离子的迁移数?
-答:因为H+、Cl迁移数之和为1,只要用1减去H+迁移数即可。
第二篇:希托夫法测定离子迁移数
希托夫法测定离子迁移数
一、目的要求
1.掌握希托夫法测定离子迁移数的原理和LQY离子迁移数测定装置的使用方法,特别是铜库仑电量计的使用方法;
2.明确迁移数的概念;
3.了解电量计的使用原理和方法。
二、实验原理
电解质溶液的导电,是由于离子在电场作用下运动的结果,在电解质中,当有电流通过时,正、负离子均参与导电,阳离子向阴极迁移,阴离子向阳极迁移,由于阴、阳离子在溶液中的迁移速度不同,所以搬运电荷的量也不相同,但通过电解质溶液的总电量为两者迁移电量之和,现设定阴、阳离子搬运电量分别为Q-和Q+则总电量为:
Q总= Q- + Q+
在物理化学中,对于电解质溶液的导电机理的研究,用离子迁移数更为直观,通常将一种离子迁移的电量与通过电解质溶液的总电量之比称为该种离子的迁移数,并以符号t表示
阳离子迁移数:t+ = Q+/ Q总,Q+=z+n+迁移F
阴离子迁移数:t- = Q-/ Q总,Q-= z-n-迁移F
并且 t+ + t- = 1 (其中,z+,z-为正负离子所带电荷数,F为法拉第常数)
测定迁移数的方法有两种,一种是界面移动法,一种为电解法(即希托夫法)。本实验采用希托夫法测定CuSO4溶液中Cu2+的迁移数。希托夫法测定离子迁移数的示意图如图1所示。
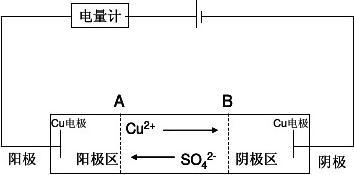
图1 希托夫法测定离子迁移数的示意图
将已知浓度的CuSO4溶液装入迁移管中(注:迁移管中所用电极为铜电极),若有Q库仑电量通过体系,在阴极和阳极上分别发生如下反应:
阳极: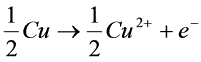 (1)
(1)
阴极: (2)
(2)
此时,溶液中Cu2+向阴极方向迁移,阴极上析出Cu,这时电解后阴极区Cu2+的物质的量n电解后Cu2+计算如下:
n电解后Cu2+=n原始Cu2+ + n迁移Cu2+ -n析出Cu
则,n迁移Cu2+= n电解后Cu2+- n原始Cu2++ n析出Cu
另外,SO42-离子向阳极方向迁移,阳极附近产生Cu2+,这时电解后阴极处SO42-的物质的量n 电解后SO42-计算如下:
n电解后SO42-= n原始SO42- + n迁移SO42- (3)
则,n迁移SO42-= n电解后SO42-- n原始SO42- (4)
电极反应与离子迁移引起的总结果是阴极区CuSO4浓度减小,阳极区的CuSO4浓度增大,且增加与减小的摩尔数相等。由于流过小室中每一截面的电量相同,因此离开与进入假想中间区Cu+数相同,SO42-数也相同,所以中间区的浓度在通电过程中保持不变。以阳极区CuSO4浓度变化为对象,结合上述可得计算离子迁移数的公式如下:
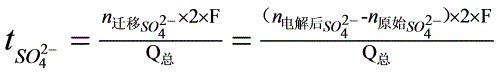 (5)
(5)
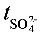 =1-
=1-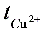 (6)
(6)
式中,F为法拉第常数;Q总为总电量,“2”表示SO42-所带电荷为2。Q总由铜库仑电量计测定。铜库仑电量计中也是一个CuSO4的电解槽(是一种特殊的电解槽,其电流效率为100%),它和迁移管中CuSO4的电解池串联,其电路连接如图2所示。
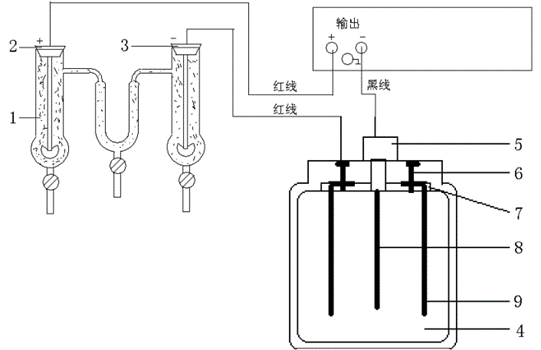
图2 LQY离子迁移数测定装置的电路连接图
其中,1---Hb迁移管,迁移管中电极为铜片;2---阳极;3---阴极;4---库仑计;5---阴极插座;6---阳极插座;7---电极固定板;8---阴极铜片;9---阳极铜片。在串联电路中通过迁移管中CuSO4溶液的Q总和通过铜库仑电量计中CuSO4溶液的Q总是相同的。铜库仑电量计中阴、阳极所发生的反应同式(1)和式(2),阴极铜片中析出铜,其质量增大,则通过铜库仑电量计中CuSO4溶液的Q总计算如下:
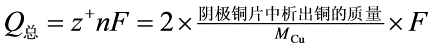 (7)
(7)
注意:(7)式中分母为1/2MCu (MCu为Cu的摩尔质量),是因为阴极反应式中带有1/2,具体原因可见课本P5。“阴极铜片上析出铜的质量”是指铜库仑电量计中阴极铜片。
将式(7)代入式(5)得:
 (8)
(8)
电解前后CuSO4浓度变化(注意是阳极区的CuSO4浓度)由滴定法测定。首先在铜离子溶液中加入过量的碘化钾,铜离子把电离子氧化成碘,生成的碘用硫代硫酸钠标准溶液滴定,从而间接求出铜离子的量。反应方程式如下:
 (9)
(9)
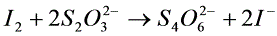 (10)
(10)
三、仪器药品
LQY离子迁移数测定装置,锥形瓶,0.05mol/LCuSO4溶液,10%KI溶液,1mol/L乙酸溶液,0.05mol/L NaS2O3溶液,0.5%淀粉溶液,6mol/L HNO3。
四、实验步骤
1. LQY离子迁移数测定装置简介
LQY离子迁移数测定装置的前面板示意图见图3。
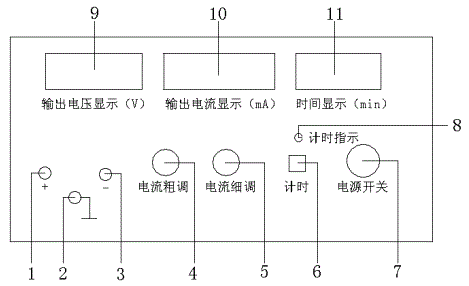
图3 LQY离子迁移数测定装置的前面板示意图
其中,1---正极接线柱:负载的正极接入处;2---接地接线柱;3---负极接线柱:负载的负极接入处;4---电流粗调:粗略调节电流所需电流值;5---电流细调:精确调节电流所需电流值;6---计时按钮:按下此按钮,停止或开始计时;7---电源开关;8---计时指示:计时开始计时指示灯亮;9---输出电压显示窗口:显示输出的实际电压值;10---输出电流显示窗口:显示输出的实际电流值;11---时间显示窗口:显示计时时间。注:
2. 具体实验操作步骤
(1)洗净所有的容器,用少量0.05mol/LCuSO4溶液洗涤希托夫迁移管3次,然后在迁移管中装满该溶液,迁移管中不应有气泡。
(2)将库仑计的阴极片放在6mol/L HNO3溶液中稍微洗涤一下,以除去表面的氧化层,用蒸馏水冲洗后,再用无水乙醇淋洗一下,用热空气将其吹干。在天平上称重得m1,然后放入库仑计。
特别注意库仑计的使用方法。(1)库仑计中共有三片铜片,两边铜片为阳极,中间铜片为阴极。(2)阳极铜片固定在电极固定板上,不可拆下,阴极铜片由阴极插座固定。拆下或固定阴极铜片时只需逆时针旋松或顺时针旋紧阴极插座即可。(3)电极固定板上有两个阳极插座,实验中可任意插入其中一个插座。
(3)将粗、细电流调节旋钮逆时针旋到底。
(4)按图3连接好测量线路。连接后面板电源插座。
(5)将电源开关置于“ON”位置,显示板即有显示。顺时针调节粗调旋钮,待接近所需电流15mA时,再顺时针调节细调旋钮,直到达到要求,按下计时按钮,开如计时(计时指示灯亮)。注意:在调节粗调旋钮时,一定要等电压、电流稳定后,再调下一档,切莫连续快速调节,另外,高压危险(实验过程电压大致在200v左右)。
(6)通电60分钟后,先将粗调旋钮逆时针旋到底,再将细调旋钮逆时针旋到底。注意:粗调旋钮的调节速度不应过快。
(7)切断电源,取出库仑计中的铜阴极,用蒸馏水冲洗后,用无水乙醇淋洗,再用热空气将其吹干,然后称重得m2。
(8)将阳极区溶液全部放入已知质量的锥形瓶后称重。
(9)测定阳极区溶液体积及滴定溶液中Cu2+浓度:①利用比重瓶测定阳极区的密度后再计算出阳极区溶液的总体积。②取10mL阳极区溶液加入10%KI溶液10mL和1mol/L 乙酸溶液10mL,先用0.05mol/L标准硫代硫酸钠溶液滴定至淡黄色,再加入1mL 0.5%淀粉滴至蓝紫色消失,溶液呈象牙粉色。
另外,还需要注意的事项有:(1)通电过程中,迁移管应避免振动。(2)电解结束时,尽快分流出阳极区溶液,瑾防各区域溶液混合。
五、数据处理
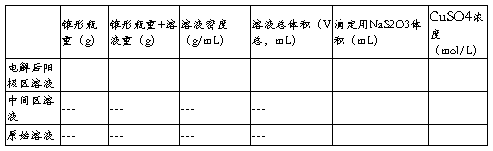
1. 数据记录
表1 基本数据

表2 各溶液相关质量与浓度
2. 此时,n(电解后SO42-)- n(原始SO42-)
=(电解后阳极区溶液中CuSO4浓度-原始溶液中CuSO4浓度)×V总= mol
将此结果代入式(8)中计算得到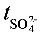 ,
,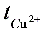 =1-
=1-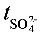 。
。
六、思考题
1. 实验中Q总为什么不用Q=It计算?对比使用Q=It计算所得Q总与使用库仑电量计计算Q总。
2.请简写利用阴极区电解前后CuSO4浓度变化求解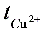 的过程。
的过程。
-
离子迁移数的测定实验报告
离子迁移数的测定界面法姓名学号班级同组实验者实验日期提交报告日期实验助教1引言11实验目的1采用界面法测定H离子的迁移数2掌握测定…
-
离子迁移数的测定实验报告
离子迁移数的测定界面法姓名张腾学号20xx011864班级化21同组实验者田雨禾实验日期20xx年12月4日提交报告日期20xx年…
- 离子迁移数的测定实验报告
-
18 离子迁移数的测定
实验十八离子迁移数的测定一实验目的1加深理解迁移数的基本概念2用希托夫法和界面移动法分别测定H2SO4水溶液和HCl水溶液中离子迁…
-
离子迁移数的测定
实验十五离子迁移数的测定当电流通过电解质溶液时溶液中的正负离子各自向阴阳两极迁移由于各种离子的迁移速度不同各自所带过去的电量也必然…
- 离子迁移数的测定实验报告
-
离子迁移数的测定实验报告
离子迁移数的测定界面法姓名张腾学号20xx011864班级化21同组实验者田雨禾实验日期20xx年12月4日提交报告日期20xx年…
-
希托夫法测定离子迁移数
希托夫法测定离子迁移数一目的要求1掌握希托夫法测定离子迁移数的原理和LQY离子迁移数测定装置的使用方法特别是铜库仑电量计的使用方法…
-
希托夫法测定离子迁移数
希托夫法测定离子迁移数平均室温平均气压Kpa同组人日期20xx315一实验目的1掌握希托夫法测定电解质溶液中离子迁移数的基本原理和…
- 电池电动势及温度系数的测定-实验报告(四川理工学院)