生化实验报告——蛋白质部分
实验题目:蛋白质的部分性质
第一部分 蛋白质的颜色反应
一、试验原理
? 蛋白质分子中某种或某些集团可与显色剂作用,产生颜色。不同的蛋白质由于所含的氨基酸不完全相同,颜色反应亦不完全相同。颜色反应不是蛋白质的专一反应,一些非蛋白物质也可产生同样的颜色反应,因此不能根据颜色反应的结果来决定被测物是否为蛋白质。另外,颜色反应也可作为一些常用蛋白质定量测定的依据。
二、实验仪器
1、吸管 2、滴管 3、试管 4、电炉 5、pH试纸 6、水浴锅
三、实验试剂
1、卵清蛋白液:鸡蛋清用蒸馏水稀释10-20倍,3-4层纱布过滤,滤液放在冰箱里冷藏备用。
2、 0.5%苯酚:1g苯酚加蒸馏水稀释至200ml。
3、Millon’s试剂:40g汞溶于60ml浓硝酸(水浴加温助溶)溶解后,冷却,加二倍体积的蒸馏水,混匀,取上清夜备用。此试剂可长期保存。
4、尿素晶体
5、1%CuSO4:1g CuSO4晶体溶于蒸馏水,稀释至100ml
6、10%NaOH:10g NaOH溶于蒸馏水,稀释至100ml
7、浓硝酸
8、0.1%茚三酮溶液:0.1g茚三酮溶于95%的乙醇并稀释至100ml.
9、 冰醋酸
10、浓硫酸
四、实验步骤
(一) 米伦(Millon’s)反应
原理:米伦试剂是硝酸、亚硝酸、硝酸汞、亚硝酸汞的混合物。他能与苯酚及某些二羟基苯衍生物起颜色反应。组成蛋白质的氨基酸中只有酪氨酸含苯酚集团,因此该反应为蛋白质中酪氨酸存在的依据。
操作:
1、苯酚实验:
取0.5%苯酚溶液1ml于试管中,加Millon’s试剂0.5ml,于电炉上小心加热,溶液即出现玫瑰红色。
2、蛋白质实验:
取2ml蛋白液,加Millon’s试剂0.5ml,出现白色的蛋白质沉淀,小心加热,凝固的蛋白质出现红色。
(二) 双缩脲反应
原理:尿素被加热,则两分子的尿素放出一分子氨而形成双缩脲。双缩脲在碱性环境中,能与硫酸铜结合成紫色的化合物,此反应称为双缩脲反应。蛋白质分子中含有肽键与缩脲结构相似,故也能进行此反应。双缩脲反应可作为蛋白质定量测定的依据。
操作:
1、取少量尿素晶体放在干燥的试管中,微火加热使其熔化成液体,有气体放出,用湿润石
蕊试纸检验,试纸变蓝,测生成气体为氨气,至液体重新结晶出现白色固体时, 停止加热,冷却。然后加10%NaOH溶液1ml,摇匀,再加2-4滴1% CuSO4溶液,混匀,有紫色出现。
2、取蛋白液1ml,加10%NaOH溶液1ml,摇匀,再加2-4滴1% CuSO4溶液,混匀,有紫色出现。
(三) 黄色反应
原理:蛋白质分子中含有苯环结构的氨基酸(如酪氨酸、色氨酸等),于浓硝酸可反应并生成黄色物质,此物质在碱性环境下变为桔黄色的硝基苯衍生物。
操作:取一支试管,加入1ml蛋白液及浓硝酸5滴。加热,冷却后颜色变为黄色。然后再加入10%NaOH溶液1ml。颜色呈橘黄色。
(四) 茚三酮反应
原理:蛋白质与茚三酮共热,产生兰紫色的还原茚三酮、茚三酮和氨的缩合物。此反应为一切蛋白质及a-氨基酸所共有。亚氨基酸(脯氨酸和羟脯氨酸)与茚三酮反应呈黄色,含有氨基的其他物质亦呈此反应。
操作:取蛋白液1ml于试管中,加4-8滴茚三酮溶液,加热至沸,即有蓝紫色出现。 第二部分、蛋白质的沉淀反应
一、试验原理
蛋白质是亲水性胶体,在溶液中的稳定性与质点大小、电荷水化作用有关,但其稳定性是有条件的,相对的。如果条件发生了变化,破坏了蛋白质的稳定性,蛋白质就会从溶液中沉淀出来。
二、实验仪器
1、移液管 2、吸管 3、试管 4、电炉
三、实验试剂
1、卵清蛋白液:鸡蛋清用蒸馏水稀释10-20倍,3-4层纱布过滤,滤液放在冰箱里冷藏备用。
2、饱和硫酸铵溶液:100ml蒸馏水中加硫酸铵至饱和。
3、硫酸铵晶体:用研钵研成碎末。
4、95%乙醇。
5、醋酸铅溶液:1g醋酸铅溶于蒸馏水并稀释至100ml
6、硫酸铜溶液:1g CuSO4晶体溶于蒸馏水,稀释至100ml
7、氯化钠晶体
8、10%三氯乙酸溶液:10g三氯乙酸溶于蒸馏水中并稀释至100ml
9、饱和苦味酸溶液:100ml蒸馏水中加苦味酸至饱和。
10、1%醋酸溶液。
四、实验步骤
(一)蛋白质的盐析作用
原理:向蛋白质中加入大量的中性盐(硫酸铵、硫酸钠或氯化钠等),使蛋白质胶体颗粒脱水,破坏其水化层,同时它所带有的电荷亦被中性盐上所带的相反电荷的离子所中和。于是稳定因素被破坏,蛋白质聚集沉淀。盐析作用一般不使蛋白质变性。
操作:1、取试管1支,向试管中加入蒸馏水3ml,然后加固体硫酸铵,直至其饱和(大约为50%)。取另一支试管,加蛋白液2ml,再加入上述饱和硫酸铵溶液2ml(上清液),摇匀静置数分钟,有絮状沉淀析出。
2、将上述混合液过滤。向滤液中逐渐加入少量固体硫酸铵(每次加入量约为
米粒大小),边加边摇,直至饱和为止,此时析出白色絮状沉淀。再加入少量蒸馏水,沉淀溶解。
(二)有机溶剂沉淀蛋白质
原理:某些有机溶剂(如乙醇、甲醇、丙醇等),因引起蛋白质脱去水化层以及降低介电常数而增加带电质点间的相互作用,致使蛋白质颗粒容易凝聚而沉淀。
操作:取一试管加蛋白液1ml,,加入晶体氯化钠少许,待溶解后再加95%乙醇3ml,摇匀,有白色沉淀生成。
(三)重金属盐与某些有机酸沉淀蛋白质
原理:重金属离子(如Pb2+、Cu2+等)与蛋白质的羧基等结合生成不溶性的金属盐类而沉淀,同时蛋白质发生变性。某些有机酸的酸根则与蛋白质的自由氨基结合而沉淀。 操作:1、取试管2支,各加蛋白液2ml,一支管中滴加1%醋酸铅溶液,另一支管中滴加1%硫酸铜溶液,有沉淀产生。
2、取一支试管加蛋白液2ml,再加入10%三氯乙酸1ml,充分混匀,有沉淀生成。
(四)生物碱试剂沉淀蛋白质
原理:植物体内具有显著生理作用的含氮碱性化合物成为生物碱。能沉淀生物碱或与其产生颜色反应的物质称为生物碱试剂。当溶液PH小于等电点时,蛋白质颗粒带正电荷,容易与生物碱试剂的负离子发生反应而沉淀。
操作:取一支试管,加入蛋白液2ml及醋酸4-5滴,再加饱和苦味酸数滴,生成白色絮状沉淀。。
第二篇:生化实验报告-福林(Folin)-酚试剂法测定蛋白质的浓度
实验:福林(Folin)-酚试剂法测定蛋白质的浓度
一、 原理
蛋白质或多肽分子中有带酚基酪氨酸或色氨酸,在碱性条件下,可使酚试剂中的磷钼酸化合物还原成蓝色(生成钼蓝和钨蓝化合物)。蓝色的深浅与蛋白质的含量成正比,可用比色法测定
二、实验仪器
1.卵清蛋白片
2.7220分光光度计
3.试管
4.移液管
三、实验试剂
1.Folin-酚试剂A:碱性铜溶液
甲液:取Na2CO32g溶于100ml0.1mol/l氢氧化钠溶液中
乙液:取CuSO4.5H2O晶体0.5g,溶于1%酒石酸钾100ml中。
临用时按甲:乙=50:1混合使用。
2.Folin-酚试剂B:将100g钨酸钠、25g钼酸钠、700ml蒸馏水、50ml85%磷酸继100ml浓盐酸置于1500ml的磨口圆底烧瓶中,充分混匀后,接上磨口冷凝管,回馏10小时,再加入硫酸锂150g,蒸馏水50ml及液溴数滴,开口煮沸15分钟,在通风橱内驱除过量的溴。冷却,稀释至1000ml,过滤,滤液成微绿色,贮于棕色瓶中。临用时,用1mol/l的氢氧化钠溶液滴定,用酚酞作指示剂,根据滴定结果,将试剂稀释至相当于1mol/L的酸。
3.1mg/mL牛血清蛋白液:称取1g牛血清蛋白片溶于0.9%氯化钠溶液中,并稀释至 1000ml
四、实验步骤
1.标准曲线的绘制
取7支干燥的试管,编号,按下表加入试剂,比色后,以光密度为纵坐标,蛋白质浓度为横坐标作图。
2.样品测定
准确吸取样液0.5ml于干燥的试管中,同样按下表加入试剂,测出光密度值后,对照标准曲线求出样液的蛋白质浓度。
五、实验数据
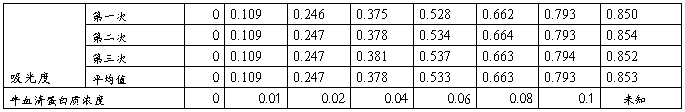
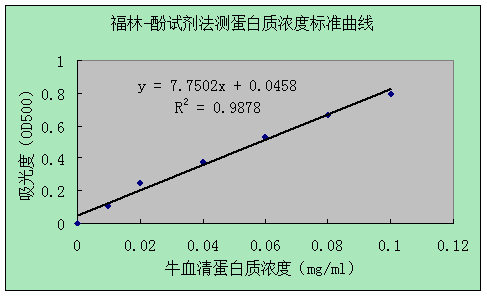
1标准曲线的绘制
2.样品测定
右上表可知待测样液的蛋白质吸光度y=0.853,则由图可知x=0.104mg/ml
故待测样液的蛋白质浓度为0.104mg/ml×5ml÷0.5ml=1.04mg/ml
六、实验分析
注意事项:
1. 在实验时,不要将牛血清蛋白和样液加反了;
2. 一定要注意实验的时间,因为溶液的光密度值是随着时间在不断增大的,如果时间超过了30分钟,则测得的光密度值就不准确了;
3. 由于分光光度计比较精密,所以往试管中加药品的时候要尽量做到准确;
4. 在使用分光光度计时,那比色皿是要拿它的毛面,不可以用手接触它的光滑面,防止自己手上的油污是测量值不准确;
5. 在擦拭比色皿时,要顺着一个方向擦;
6. 在比色皿中装入的液体量大约要是比色皿体积的三分之二
-
生化实验报告
生化实验报告单位学号姓名实验1多酚氧化酶PPO的分离提取一实验原理与目的植物受到机械损伤和病菌侵染后PPO催化酚与O2氧化形成为醌…
-
生物化学实验报告
20xx年生物化学实验B姓名学号实验时间实验分组组内成员任课教师实验报告XXXX20xx年11月17日摘要本实验通过从小牛肠中通过…
-
生化实验报告4
生物化学实验报告纤维素酶活力的测定还原糖的测定35二硝基水杨酸法刘欣怡20xx0014005720xx级生物基地班周一下午同组者刘…
-
生物化学实验报告
实验一考马斯亮蓝G250染色法测定蛋白质的含量p24一目的要求掌握考马斯亮蓝CoomassieBrilliantBlue法测定蛋白…
-
生化大实验报告
生化实验报告键入文档副标题实验一多酚氧化酶PPO的分离与提取一实验目的1本实验以马铃薯为主要的实验材料通过细胞组织破碎匀浆过滤离心…
-
20xx救灾救济工作总结
20xx年度工作总结20xx年是充实的一年,是精彩的一年,经过这一年繁忙紧张的工作,我们低保科顺利的完成了上级领导布置给我们的各项…
-
人武部工作总结
街道的武装工作,在区人武部和街道党工委的正确领导下,紧紧围绕军事斗争准备这个中心,大力加强民兵预备役建设,较好地完成了今年的各项任…
-
评职称工作总结
李东东,20xx年x月毕业于山西省建筑工程技术学校工业与民用建筑专业,20xx年x月进入山西省第三建筑工程公司第六工程处工作,现在…
-
化工八大社团联谊会总结
十二月一日我们协会同其他七个兄弟协会成功的举办了此次联谊晚会。活动教室内灯光照着社员们愉悦的笑脸,我们都对这次联谊期待已久。。。。…
-
科普知识竞赛活动总结
活动总结于20xx年x月x日,我们部举办了科普知识竞赛。此次活动面向我院大一,大二,大三学生展开,由每班推选出一个团队参赛,共有1…