实验8HAc电离度和电离常数的测定
实验8 HAc电离度和电离常数的测定
[实验目的]
1、 配制不同浓度的标准HAc溶液。
2、 掌握电导仪的使用方法,学习电导法测定电离度和电离常数的原理及在井穴板上进行溶液电导率测试的操作。
3、 加强对弱酸的电离度,电离常数和溶液的浓度与电导关系的理解。
[实验原理]
HAc在H2O中电离:HAc=H++Ac-,平衡时平衡常数Kc,浓度c和电离度〆间的关系为:Kc=c·〆2/(1-〆) (1)
求得〆,即可由已知的c求出Kc。电解质导电能力由电导(L)(电阻的倒数)来衡量,L=k·A/d (K为电导率,S·m-1)
摩尔电导(便于比较不同电解质溶液的导电能力):1mol电解质溶液置于单位距离(1m)的两个电导池的平行电极间,此时的电导称摩尔电导(∧m),∧m 与电导率k的关系为:
∧m =k·Vm=k/c

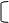 式中Vm为m3时,∧m为s·m2·mol-1,c为mol·m-3;若V为dm3,c为mol·L-1,则∧m为s·dm2·mol-1,此时公式为∧m=K×10-3/c。
式中Vm为m3时,∧m为s·m2·mol-1,c为mol·m-3;若V为dm3,c为mol·L-1,则∧m为s·dm2·mol-1,此时公式为∧m=K×10-3/c。
弱电解质无限稀释时,看作完全电离(〆→1),此时的∧m称极限摩尔电导∧∞,m,T一定,∧∞,m一定。
T一定时,〆=∧m/∧∞ (∧m为浓度c时的摩尔电导)
上式代入(1)式即得:Kc=c·∧m2/[∧∞(∧∞-∧m)],
另:内插法求所需∧∞值:
(∧∞,2-∧∞,1)/(∧∞,x-∧∞)=(T2-T1)/(Tx-T1),代入具体数据即可求出∧∞,x的值。
[结论]
〆随HAc浓度c↗而↘;c↘,k↘,∧∞↗;Kc与HAc的浓度c无关。
μs/cm=10-6s/10-2m=10-4s/m (s=Ω-1)
[注意事项]
1、 电极一定要保护好。
2、 井穴板必须整洁干燥,但不能在烘箱内干燥!
3、 所测溶液从稀到浓。
4、 井穴板中溶液不能注满,电极要完全浸入,每做完一次测定后要用蒸馏水清洗,再用待测液润洗。
实验9 电离平衡
[实验目的]
1、 巩固PH值的概念,掌握测试溶液PH值的基本方法。
2、 加强对盐类水解的认识。
3、 理解电离平衡,水解平衡和同离子效应的基本原理。
4、 学会配制缓冲溶液并试验其性质。
[实验原理]
1、 弱电解质(弱酸、弱碱等)在溶液中存在电离平衡:
HAc+H2O==H3+O+Ac- Ka NH3·H2O==NH4++OH- Kb
化学平衡移动规律同样适用于这种平衡体系。
2、 同离子效应:(弱酸、弱碱等)弱电解质溶液中加入含有相同离子的另一种电解质时,会使弱电解质的电离程度减小。

 H
2O+HAc == H
3
+O + Ac
-
H
2O+HAc == H
3
+O + Ac
-
 NaAc == Na+ + Ac-
NaAc == Na+ + Ac-
3、 盐类的水解:酸碱中和反应的逆过程,组成盐的离子与H2O中的H+或OH-结合生成弱电解质(酸、碱)的过程。盐的性质决定溶液水解后的酸、碱性。
H2O+CO32-==OH-+HCO-3 Kh=[HCO3-][OH-][H+]/([ H2O][CO-3][H+])=Kw/Ka2
4、 缓冲溶液:由浓度较大的弱酸(碱)及其共轭碱(酸)组成(实际为盐),在稀释或加少量酸、碱时,其PH值变化很小。缓冲能力与缓冲溶液的总浓度及配比有关(缓冲能力是有限的!)。
HAc+ H2O==H3O++Ac- K =[H+][ Ac-]/[ HAc]
[H+]=Ka·C酸/C盐==PH=Pka –lgC酸/C盐
对于一元弱碱:POH=PKb-lg C碱/C盐,其比值C酸/C盐或C碱/C盐从0.1→10时,PH(POH)变化只是从0.1→1。
5、 盐效应:加入强电解质而使弱电解质电离程度(或沉淀溶解度)增加的效应,(因离子强度↗,f↘)I=1/2∑(CiZi2);lgr=-0.509|z+·z-|·I/ (I +1);f=rc。
[注意事项]
1、 测溶液酸碱性(自制色阶亦如此)时,事先要将溶液搅匀,否则测出的只是局部酸碱性,出现错误结论。
2、 在缓冲溶液酸碱性测试时,要注意仪器的酸性范围与碱性范围,不能混测,这是事先标定时所决定了的。
3、 在NaAc中加1d酚酞,加热至沸时,可能会有浅红色沉淀生成,这是由于盐析现象所致。
4、 一定要注意保护电极!
第二篇:样章-实验 醋酸电离度和电离常数的测定
实验四 醋酸电离度和电离常数的测定
一、实验目的
1. 了解用数字酸度计测定醋酸电离度和电离常数的原理
2. 掌握数字酸度计的使用方法。
3. 测定醋酸的电离常数,加深对电离度、电离平衡常数和弱电解质电离平衡的理解。
二、实验原理
醋酸是弱电解质,在溶液中存在如下电离平衡:

[H+]、[Ac-]和[HAc]分别为H+、Ac-和HAc的平衡浓度,Ka为HAc的电离常数,c为醋酸的初浓度,α为醋酸的电离度。
醋酸溶液的总浓度可以用标准NaOH溶液滴定测得。其电离出来的H+的浓度,可在一定温度下用数字酸度计测定醋酸溶液的pH值,根据pH=-lg[H+]关系式计算出来。另外,再根据[H+]=cα,便可求得电离度α和电离平衡常数Ka。
电离度α随初浓度c而变化,而电离常数与c无关,因此在一定温度下,对于一系列不同浓度的醋酸溶液,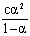 值近似地为一常数,取所得一系列
值近似地为一常数,取所得一系列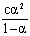 的平均值,即为该温度下醋酸的电离常数Ka。
的平均值,即为该温度下醋酸的电离常数Ka。
三、仪器和试剂
仪器:酸度计,25mL移液管,酸、碱式滴定管(25mL),锥形瓶(250mL),烧杯(100mL),滴定管夹和铁架台,洗耳球,温度计。
试剂:HAc溶液(0.05mol·L-1),NaOH标准溶液(0.05mol·L-1,已标定),缓冲溶液(pH=4~5),酚酞指示剂。
四、实验内容
1. 醋酸溶液浓度的测定
用清洁的25mL移液管吸取待测醋酸溶液25.00mL,放入250mL锥形瓶中,加入酚酞指示剂2~3滴,用NaOH标准溶液滴定至溶液呈微红色并半分钟不褪色为止,记下所用的NaOH溶液体积。平行测定3份,把滴定的数据和计算结果填入表中。

2. 配制不同浓度的醋酸溶液
用酸式滴定管分别放出40.00mL、20.00mL、10.00mL和5.00mL上述已知浓度的HAc溶液于4只干燥的100mL烧杯中,并依次编号为1、2、3、4。然后用碱式滴定管往2、3、4号烧杯中分别加20.00mL、30.00mL和35.00mL蒸馏水,并混合均匀。计算出稀释后醋酸溶液的精确浓度并填于下表中。
室温:T= K

3. 测定 HAc溶液的pH值、α和Ka
把以上四种不同浓度的醋酸溶液,按由稀至浓的次序依次在数字酸度计上分别测定它们的pH值,记录数据和室温,计算电离度和电离常数。
五、思考题
1. 根据实验结果讨论HAc电离度和电离常数与其浓度的关系,如果改变温度,对HAc的电离度和电离常数有何影响?
2. 若所用HAc溶液的浓度极稀,是否能用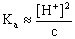 求电离常数?
求电离常数?
3. 配制不同浓度的醋酸溶液有哪些注意之处?为什么?
4. 在测定一系列同一种电解质溶液的pH时,测定的顺序按浓度由稀到浓和由浓到稀,结果有何不同?
-
无机化学实验六 醋酸电离度和电离常数的测定1
实验六醋酸电离度和电离常数的测定pH法一实验目的1测定醋酸的电离度和电离常数2学习pH计的使用教学重点醋酸的电离度电离常数的测定教…
-
醋酸电离常数和电离度的测定
实验三醋酸电离常数和电离度的测定一实验目的1测定醋酸的电离常数加深对电离度的理解2学习正确使用pH计二实验原理醋酸CH3COOH或…
-
实验十五 醋酸电离度和电离常数的测定
实验十五醋酸电离度和电离常数的测定一教学要求1学习测定醋酸离解度和离解常数的基本原理和方法2学会酸度计的使用方法3巩固溶液的配制及…
-
醋酸电离度和电离常数的测定
实验题目醋酸电离度和电离常数的测定教材p5759一实验目的1测定醋酸的电离度和电离常数2掌握滴定原理滴定操作及正确判断滴定终点3练…
-
醋酸电离度和电离常数的测定—pH计的使用
醋酸电离度和电离常数的测定pH计的使用实验目的测定醋酸的电离度和电离常数进一步掌握滴定原理滴定操作及正确判断滴定终点学习使用pH计…
-
第四版无机化学实验报告实验十三:醋酸解离度和解离常数的测定——pH计的使用
实验名称醋酸解离和解离常数的测定pH计的使用实验日期温度气压一实验目的1测定醋酸的解离度和解离常数2掌握滴定原理滴定操作及正确判断…
-
采用分光光度法测定弱电解质的电离常数实验报告
采用分光光度法测定弱电解质的电离常数实验报告一实验目的1了解一种测定弱电解质电离常数的方法2掌握分光光度计的测试原理和使用方法3进…
-
四川理工实验报告电导法测定乙酸电离平衡常数 (2)
实验六电导法测定乙酸电离平衡常数报告人曾辉实验时间20xx年03月07日一实验目的1掌握电导电导率摩尔电导率的概念以及它们之间的相…
-
实验3 食用白醋的总酸度、电离度和电离常数的测定
实验3食用白醋的总酸度电离度和电离常数的测定教学目的与要求1学习食用白醋的总酸度电离度和电离常数的的原理和方法2学习酸度计的原理和…
-
报告示例:实验三__醋酸解离度和解离常数的测定
山东轻工业学院实验报告成绩课程名称基础化学实验1指导教师周磊实验日期院系专业班级实验地点实验楼A座412学生姓名学号同组人实验项目…