甲基红电离平衡常数测定实验预习报告

第一部分:实验预习报告
1. 实验目的(要求)
测定弱电解质电离平衡常数
了解指示剂变色反应原理
学习使用721型(或VIS-7220型)分光光度计及pHS-3C酸度计
2. 实验原理(概要)
甲基红是一种酸碱指示剂。它是一种弱酸,在一定pH值条件下,可发生电离,在乙醇水溶液中点力度很小。甲基红(HMR)醌式分子显红色,电离后的偶氮式阴离子( MR¯ )显黄色。
甲基红的电离平衡常数 为:
为:
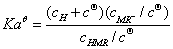
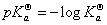
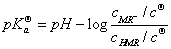
根据朗伯-比尔定律,溶液对单色光的吸收遵守下列关系式: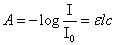
A为吸光度, 为透光率,
为透光率, 为摩尔吸光系数,l为被测溶液厚度,c为浓度。令
为摩尔吸光系数,l为被测溶液厚度,c为浓度。令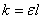
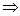
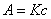 即被测溶液的吸光度与其浓度成正比。
即被测溶液的吸光度与其浓度成正比。
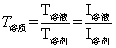
a. 若两种溶质的特征波长相差较大,被测溶质的吸收光谱图不重叠
b. 若两种被测溶质的吸收光谱图重叠,而且遵守朗伯-比尔定律,则用线性组合的关系式可求出两种被测组分的浓度。

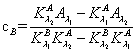
3. 实验操作过程概述:
1溶液制备。
甲基红标准液:80mg甲基红晶体分次以600mL乙醇溶解移入1000mL容量瓶中
A液:10mL甲基红标准液+10HCl加水定容于100mL容量瓶。(HMR醌式分子溶液,红色)
B液:10mL甲基红标准液+25mLNaAc溶液加水定容于100mL容量瓶。(甲基红偶氮式阴离子溶液,黄色)
2吸收光谱图的标绘
(1)调节VIS-7220型分光光度计
(2)测定溶液A和溶液B的吸收光谱图
3验证朗伯-比尔定律
测定 ,
,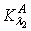 ,
, ,
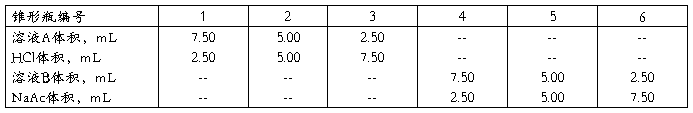
, :取6个干燥的锥形瓶(50mL),分别编号。摇匀各瓶溶液。在波长
:取6个干燥的锥形瓶(50mL),分别编号。摇匀各瓶溶液。在波长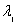 ,
, 下测定6个锥形瓶中各溶液的吸光度A。若在处HMR及
下测定6个锥形瓶中各溶液的吸光度A。若在处HMR及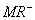 的溶液均符合朗伯-比尔定律,则以溶液A,B及上述6种溶液的吸光度与甲基红的浓度,可以作HMR和
的溶液均符合朗伯-比尔定律,则以溶液A,B及上述6种溶液的吸光度与甲基红的浓度,可以作HMR和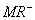 分别在波长
分别在波长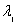 ,
, 下的4条A-c直线。它们的斜率分别为
下的4条A-c直线。它们的斜率分别为 ,
,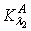 ,
, ,
, :。
:。
4. 测定混合溶液的吸光度与pH值
(1) 配制混合溶液a,b
(2) 在波长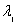 ,
, 下分别测定a,b两个混合溶液的吸光度
下分别测定a,b两个混合溶液的吸光度 ,
,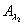
(3) 用pHS-3C型酸度计的操作方法,分别测定两个混合溶液a,b的PH值
第二部分:实验过程记录
1. 实验所用仪器及主要试剂(仪器名称﹑型号及编号,试剂等级,装置图)
仪器:721型(或VIS-7220型)分光光度计、pHS-3C酸度计、容量瓶(100mL、1000mL)、移液管(10mL)、吸量管(10mL)、量筒(10mL、25 mL、100 mL)、锥形瓶(50mL)。
药品:HCL溶液(0.01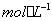 、0.1
、0.1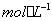 )、NaAc溶液(0.01
)、NaAc溶液(0.01 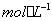 、0.04
、0.04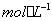 )HAc溶液(0.02
)HAc溶液(0.02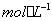 )、甲基红晶体、乙醇(95%)。
)、甲基红晶体、乙醇(95%)。
2. 实验过程记录(实验原始数据记录及现象)
第三部分:实验结果分析及思考题
1. 实验结果(数据处理及实验最终结果)
2. 思考题及建议
批阅教师:——————————
批阅日期:——————————
第二篇:实验三醋酸电离度和电离平衡常数的测定
实验三 醋酸电离常数的测定
一、实验目的
1.测定醋酸的电离度和电离平衡常数。
2.学会正确地使用pH计。
3.练习和巩固容量瓶、移液管、滴定管等仪器的基本操作。
二、实验原理
醋酸CH3COOH(简写为HAc)是一元弱酸,在溶液中存在下列电离平衡:


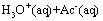
忽略水的电离,其电离常数:
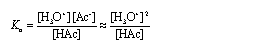
首先,一元弱酸的浓度是已知的,其次在一定温度下,通过测定弱酸的pH值,由pH=-lg[H3O+],可计算出其中的[H3O+]。对于一元弱酸,当c/Ka≥500时,存在下列关系式:

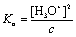
由此可计算出醋酸在不同浓度时的解离度(a)和醋酸的电离平衡常数(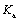 )。或者也可由
)。或者也可由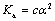 计算出弱酸的解离常数(
计算出弱酸的解离常数(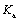 )。
)。
三、仪器和试药
仪器:移液管、吸量管、容量瓶、碱式滴定管、锥形瓶、烧杯、量筒、pHS-3C型酸度计。
试剂:冰醋酸(或醋酸)、NaOH标准溶液(0.1mol·L-1)、标准缓冲溶液(pH=6.86, 4.00)、酚酞溶液(1%)。
四、实验内容
1.配置250mL浓度为0.1mol·L-1的醋酸溶液
用量筒量取4mL 36%(约6.2 mol·L-1)的醋酸溶液置于烧杯中,加入250mL蒸馏水稀释,混匀即得250mL 浓度约为0.1mol·L-1的醋酸溶液,将其储存于试剂瓶中备用。
2.醋酸溶液的标定
用移液管准确移取25.00mL醋酸溶液(V1)于锥型瓶中,加入1滴酚酞指示剂,用标准NaOH溶液(c2)滴定,边滴边摇,待溶液呈浅红色,且半分钟内不褪色即为终点。由滴定管读出所消耗的NaOH溶液的体积V2,根据公式c1V1=c2V2计算出醋酸溶液的浓度c1。平行做三份,计算出醋酸溶液浓度的平均值。
3.pH值的测定
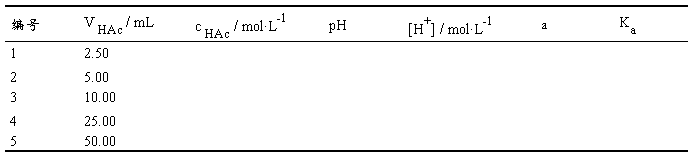
分别用吸量管或移液管准确量取2.50、5.00、10.00、25.00mL上述醋酸溶液于四个50mL的容量瓶中,用蒸馏水定容,得到一系列不同浓度的醋酸溶液。将四溶液及0.1mol·L-1原溶液按浓度由低到高的顺序,分别用pH计测定它们的pH值。
4.由测得的醋酸溶液pH值计算醋酸的电离度、电离平衡常数。
五、实验结论
数据记录与处理
六、注意事项
1.测定醋酸溶液pH值用的小烧杯,必须洁净、干燥,否则,会影响醋酸起始浓度,以及所测得的pH值。
2.吸量管的使用与移液管类似,但如果所需液体的量小于吸量管体积时,溶液仍需吸至刻度线,然后放出所需量的液体。不可只吸取所需量的液体,然后完全放出。
3.pH计使用时按浓度由低到高的顺序测定pH值,每次测定完毕,都必须用蒸馏水将电极头清洗干净,并用滤纸擦干。
七、思考题
1.用pH计测定醋酸溶液的pH值,为什么要按浓度由低到高的顺序进行?
2.本实验中各醋酸溶液的[H+]测定可否改用酸碱滴定法进行?
3.醋酸的电离度和电离平衡常数是否受醋酸浓度变化的影响?
4.若所用醋酸溶液的浓度极稀,是否还可用公式 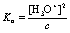 计算电离常数?
计算电离常数?
-
无机化学实验六 醋酸电离度和电离常数的测定1
实验六醋酸电离度和电离常数的测定pH法一实验目的1测定醋酸的电离度和电离常数2学习pH计的使用教学重点醋酸的电离度电离常数的测定教…
-
醋酸电离常数和电离度的测定
实验三醋酸电离常数和电离度的测定一实验目的1测定醋酸的电离常数加深对电离度的理解2学习正确使用pH计二实验原理醋酸CH3COOH或…
-
实验十五 醋酸电离度和电离常数的测定
实验十五醋酸电离度和电离常数的测定一教学要求1学习测定醋酸离解度和离解常数的基本原理和方法2学会酸度计的使用方法3巩固溶液的配制及…
-
醋酸电离度和电离常数的测定
实验题目醋酸电离度和电离常数的测定教材p5759一实验目的1测定醋酸的电离度和电离常数2掌握滴定原理滴定操作及正确判断滴定终点3练…
-
醋酸电离度和电离常数的测定—pH计的使用
醋酸电离度和电离常数的测定pH计的使用实验目的测定醋酸的电离度和电离常数进一步掌握滴定原理滴定操作及正确判断滴定终点学习使用pH计…
-
《水溶液中的解离平衡》实验报告
二实验步骤一同离子效应取两只小试管01molLHAc溶液及滴甲基橙混合均匀溶液呈红色在一试管中加入少量NaAcs观察指示剂颜色变化…
-
实验四 酸碱解离平衡和沉淀-溶解平衡
山东大学西校区实验报告姓名危诚年级班级公共卫生1班实验四酸碱解离平衡和沉淀溶解平衡实验目的了解弱酸与弱碱的解离平衡及其平衡移动原理…
-
无机化学实验十一 电离平衡和沉淀反应
实验十一电离平衡和沉淀反应一实验目的1了解同离子效应对弱电解质电离平衡的影响2学习缓冲溶液的配制并了解其缓冲作用3加深理解盐类的水…
-
电导法测定乙酸电离平衡常数 实验报告
物理化学实验报告姓名何思思班级工艺五班学号教师李慎新学院材料化学与工程学院10031010526电导法测定乙酸电离平衡常数一实验目…
-
四川理工实验报告电导法测定乙酸电离平衡常数 (2)
实验六电导法测定乙酸电离平衡常数报告人曾辉实验时间20xx年03月07日一实验目的1掌握电导电导率摩尔电导率的概念以及它们之间的相…
-
第四版无机化学实验报告实验十三:醋酸解离度和解离常数的测定——pH计的使用
实验名称醋酸解离和解离常数的测定pH计的使用实验日期温度气压一实验目的1测定醋酸的解离度和解离常数2掌握滴定原理滴定操作及正确判断…