篇一 :产品稳定性考察报告--空白格式
产品稳定性考察报告
1 样品情况:
来源:由本公司生产
包装:模拟市售包装
稳定性考察三批批号: 、 、
2 考察项目
按《中国药典》20##年版二部标准对样品进行 、 、 等项目进行考察。
3 考察条件
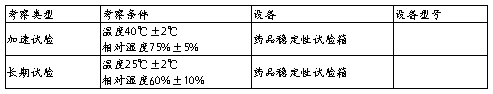
4 考察项目
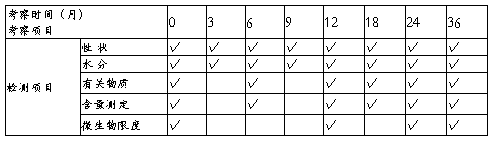
5、考察结果:
5.1加速试验
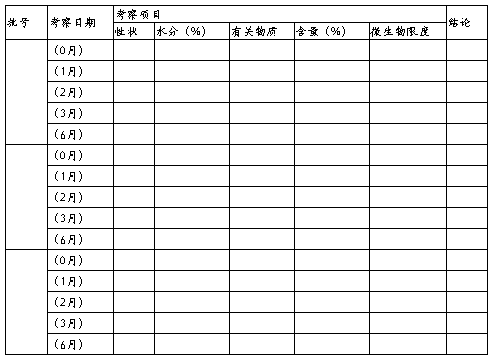
5.2长期试验

6 考察过程中出现的偏差及处理情况
考察过程未出现过偏差。
7 考察结果分析
7.1数据统计与趋势分析(附水分变化趋势图,含量变化趋势图,有关物质变化趋势图)
7.2在三年的稳定性考察中,性状、水分、有关物质、含量项均符合标准要求;细菌数、霉菌和酵母菌数与原检验结果(0月)相比没有显著变化,非常稳定。
8 稳定性考察结论:
我公司将该产品有效期定为三年。
XXXX有限责任公司
XXXX年XX月XX日
…… …… 余下全文
篇二 :稳定性考察报告
文件编号:
XX品种
稳定性考察汇总分析报告
报告内容:
产品名称:
产品规格:
产品质量标准:
考察时间:
产品批号:
产品有效期:
责任部门:
报告完成时间:
一. 目的:
二. 依据的标准:
三. 考察项目:
四. 贮藏条件:
五. 产品质量汇总分析:
六. 结论与建议:
七. 报告参与人员:
报告提交人:
报告审核人:
报告批准人: 日期: 日期: 日期:
附录:
XX品种XX批号
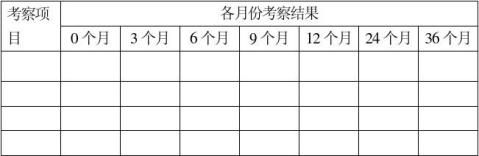
…… …… 余下全文
篇四 :稳定性考察报告
F3稳定性考察方案及报告
文件编号: F3-LST 001.01
生效日期:
方案/报告的审核批准

1目的
本方案主要描述了F3长期定性考察的实施计划,为产品的长期稳定性考察计划提供稳定性考察的数据。
2职责
QC专员:负责稳定性考察方案与报告的起草、检验结果的汇总;
QA专员: 负责稳定性考察方案与报告、检验结果的审核;
质量主任:负责稳定性考察方案与报告、检验结果评估批准;
3产品介绍
产品名称:F3
产品代号:C27
生产地点:3车间
包装规格: 20.0kg/桶
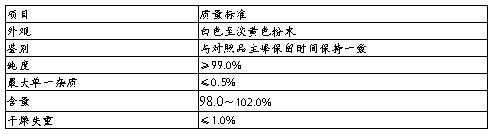
F3产品质量标准:
考察批次:3批
考察条件:
包装:采用模拟商业包装,双层PE袋包装.
5考察项目及测试计划
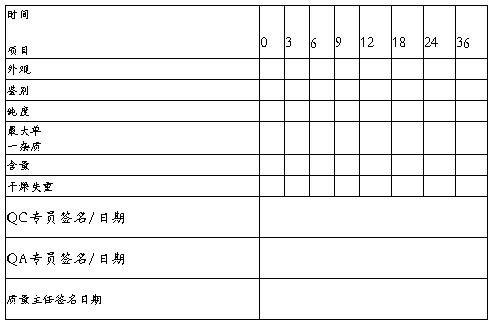
按照中国药典对样品分别在第3,6,9,12,18,24,36个月进行各稳定性考察项目,检测.检测标准按照F3质量标准及分析方法进行检测.
6数据汇总
批号:
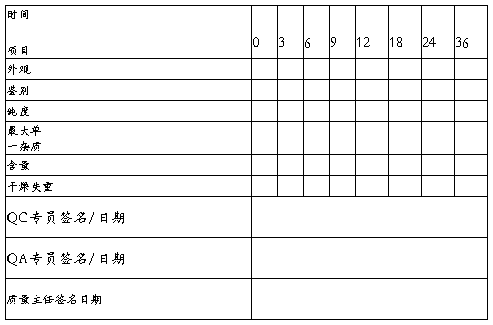
批号:

批号:
检验过程中如有任何偏差,应及时记录偏差,按照公司内部偏差管理进行处理.
8稳定性数据评估及批准

…… …… 余下全文
篇五 :内包材稳定性考察总结报告
内包装材料稳定性考察总结报告
为了确定内包材的贮存期限,保证药品生产用内包材质量,质量部根据内包材贮存条件和实际生产用量选择药品包装用复合铝膜、药用聚氯乙烯PVC、口服液体药用塑料瓶等未规定有效期的内包材各三批留样进行考察。
上述三种内包材,在公司药品生产过程中用量较大,分别为公司胶囊剂、颗粒剂糖浆剂以及合剂生产中所用的主要内包材,贮存条件不当易造成外观质量变化、微生物限度超标,进而影响药品质量。因此,我们根据SOP“长期稳定性考察程序”及“内包装材料稳定性考察计划”进行了稳定性考察试验,现进行总结。
试验考察数据:见附页。
实验数据分析:根据试验数据,可以看出复合铝膜、药用聚氯乙烯PVC、口服液体药用塑料瓶等物料在经过十八个月贮存后,其外观和微生物限度均能符合质量标准,证明其贮存有效期可达十八个月。但为确保内包材使用质量,现规定其贮存有效期为十二个月。到达有效期后,应重新请验,检验合格后重新确定有效期。
清华德人西安幸福制药有限公司质量部 二00八年x月二十六日
…… …… 余下全文
篇六 :产品稳定性考察方案
*****产品稳定性考察方案
起草人: 日期:
审核人: 日期:
批准人: 日期:
扬州市三药制药有限公司
1、目的
本方案主要描述********稳定性考察的实施计划,为产品的持续稳定性考察计划,提供稳定性考察的数据。
*****产品现行贮存条件为****保存。现进行30°C±2°C、65%±5%条件下36个月的长期稳定性考察,确定***产品能够在标示的贮存条件下,符合质量标准的各项要求。
2、职责
QC人员负责稳定性考察方案与报告的起草、检验结果的汇总。
QC人员按照该方案完成实验并报告检验结果。
…… …… 余下全文
篇七 :稳定性考察方案0424
稳定性考察方案
制定人: 日期:
审核人: 日期:
批准人: 日期:
北京远策药业有限公司
目录
一、目的
二、范围
三、职责
四、产品介绍
五、药品稳定性考察信息表和检测方法依据
六、具体方案
…… …… 余下全文
篇八 :20xx年度持续稳定性考察计划(方案)
xx年度产品持续稳定性考察方案
1、目的:
本方案为考察我公司生产品种的稳定性,决定对所有品种进行持续稳定性考察,为确保患者用药安全、有效,以及有效期内产品质量情况提供数据。
2、范围:
xx年生产的所有品种
3、持续稳定考察成员及职责范围

4、方案审核及批准

5、稳定性考察品种及考察要点
5. 1加速试验稳定性考察品种
详见列表:

5. 2长期稳定性考察品种

6、具体方案
以上所有品种均为已生产品种,如无变更等情况,每一种规格取一个批次,若所使用的原料非唯一,则按每一种规格,每一家供应商分别取一个批次进行稳定性考察。(具体品种的规格及供应商情况见附件1)。若发生生产工艺参数或关键设备等重大变更,则应涉及变更的所有批次均进行持续稳定性考察,同时,进行加速实验。若出现无计划变更,则需进行持续稳定性考察方案变更审批(持续稳定性考察方案变更审批表见附件4)。
因品种多,批次多,为了避免样品检验周期过于集中,合理利用检验资源,保证各阶段检验能够顺利有效进行,上述长期生产的品种,取样时间明确规定如附件5,其它品种可根据排产情况及时安排取样,留样。因生产时间安排与方案取样时间不一致时,可根据实际生产时间顺延至下月或下一阶段。
…… …… 余下全文
