篇二 :实验三 硫酸铜的提纯
实验二 硫酸铜的提纯
实验目的
1、了解化学方法提纯粗硫酸铜的原理和方法。
2、练习无机制备的基本操作。
实验原理
粗硫酸铜中含有不溶性杂质和可溶性杂质FeSO4、Fe2(SO4)3等,不溶性杂质可用过滤法除去,杂质FeSO4需要用氧化剂H2O2或Br2氧化为Fe3+,然后调节溶液的pH值4,使Fe3+水解成Fe(OH)3沉淀而除去,其反应如下:
2FeSO4 + H2SO4 + H2O2= Fe2(SO4)3 + 2H2O
Fe3++ 3H2O → Fe(OH)3↓ + 3H+
除去铁离子之后的滤液,蒸发结晶,其它微量可溶性杂质在硫酸铜结晶时仍留在母液中,过滤时可与硫酸铜分离。
实验步骤
称取5g研细的粗硫酸铜放在100mL小烧杯中,加入20mL蒸馏水,加热搅拌促使溶解.
滴加1 mL 3% H2O2,将溶液加热,同时逐滴加入0.5 mol?L-1NaOH溶液,直到pH≈4,再加热片刻静置使水解生成Fe(OH)3沉淀用倾斜法在普通漏斗上过滤,滤液过滤到洁净的蒸发皿中。
在提纯后的硫酸铜滤液中,滴加1mol?L-1 H2SO4酸化,调节pH至1~2,然后在石棉网上加热,蒸发浓缩至液面出现薄层结晶时,即停止加热。
…… …… 余下全文
篇四 :实验一 硫酸铜的提纯
实验一硫酸铜的提纯
一实验目的
1.了解用化学法提纯硫酸铜的方法;
2. 掌握溶解、加热、蒸发浓缩、过滤、重结晶等基本操作。
二实验原理
粗硫酸铜中含有不溶性杂质和可溶性杂质FeSO4、Fe2(SO4)3及其它重金属盐等。不溶性杂质可通过常、减压过滤的方法除去。可溶性杂质Fe2+、Fe3+的除去方法是:先将Fe2+用氧化剂H2O2或Br2氧化成Fe3+,然后调节溶液的pH值在3.5~4之间,使Fe3+水解成为Fe(OH)3沉淀而除去,反应式如下:
2Fe2+ + H2O2 + 2H+ ═ 2Fe3+ + 2H2O
Fe3++ 3H2O ═ Fe(OH)3↓+ 3H+
控制pH值在3.5~4之间是因为Cu2+在pH值大于4.1时有可能产生Cu(OH)2沉淀,而Fe3+则不同,根据溶度积规则进行计算,其完全沉淀时的pH值是大于3.3,因此控制溶液的pH值在3.3~4.1之间,便可使Fe3+完全沉淀而Cu2+不沉淀从而达到分离,pH值相对越高,Fe3+沉淀就越完全。其它可溶性杂质因含量少,可以通过重结晶的方法除去。
硫酸铜的纯度检验是将提纯过的样品溶于蒸馏水中,加入过量的氨水使Cu2+生成深蓝色的[Cu(NH3)4]2+,Fe3+形成Fe(OH)3沉淀。过滤后用HCl溶解Fe(OH)3,然后加KSCN溶液,Fe3+愈多,血红色愈深。其反应式为:
…… …… 余下全文
篇五 :实验 硫酸铜的提纯
硫酸铜的提纯
一、实验目的
1.了解用重结晶法提纯物质的基本原理。
2.练习托盘天平的使用。
3.掌握加热、溶解、蒸发浓缩、结晶、常压过滤、减压过滤等基本操作技术。
二、实验原理
硫酸铜为可溶性晶体物质。根据物质的溶解度的不同,可溶性晶体物质中的杂质包括难溶于水的杂质和易溶于水的杂质。一般可先用溶解、过滤的方法,除去可溶性晶体物质中所含的难溶于水的杂质;然后再用重结晶法使可溶性晶体物质中的易溶于水的杂质分离。
重结晶的原理是由于晶体物质的溶解度一般随温度的降低而减小,当热的饱和溶液冷却时,待提纯的物质首先结晶析出而少量杂质由于尚未达到饱和,仍留在母液中。 粗硫酸铜晶体中的杂质通常以硫酸亚铁(FeSO4)、硫酸铁[Fe2(SO4) 3]为最多。当蒸发浓缩硫酸铜溶液时,亚铁盐易氧化为铁盐,而铁盐易水解,有可能生成Fe(OH) 3 沉淀,混杂于析出的硫酸铜晶体中,所以在蒸发浓缩的过程中,溶液应保持酸性。 若亚铁盐或铁盐含量较多,可先用过氧化氢(H2O2)将 Fe2氧化为 Fe3,再调节溶液++的pH值约至4,使Fe3水解为Fe(OH) 3沉淀过滤而除去。 +
2Fe2 + H2O2 + 2H = 2Fe3 + 2H2O Fe3 + 3H2O = Fe(OH)3 + 3H +++++pH≈4
…… …… 余下全文
篇六 :实验十三 硫酸铜的提纯
实验十三 硫酸铜的提纯
一、实验目的
1. 了解用重结晶法提纯物质的原理;
2. 学习台天平的使用以及加热蒸发、重结晶等基本操作。
二、实验原理
可溶性晶体物质可用重结晶法提纯, 根据物质溶解度的不同, 一般可先用溶解、过滤的方法,除去易溶于水的物质中所含难溶于水的杂质, 然后再用重结晶法使少量易溶于水的杂质分离, 重结晶的原理是由于晶体物质的溶解度一般随温度的降低而减小, 当加热的饱和溶液冷却时, 待提纯的物质首先以结晶析出, 而少量杂质由于尚未达到饱和, 仍留在溶液中。
粗硫酸铜晶体中的杂质通常以硫酸亚铁、硫酸铁为最多, 当蒸发浓缩硫酸铜溶液时, 亚铁盐易被氧化为铁盐, 而铁盐易水解有可能生成 Fe(OH)3 沉淀, 混杂于析出的硫酸铜结晶中, 所以在蒸发过程中溶液应保持酸性。
若亚铁盐或铁盐含量较多, 可先用过氧化氢 (H2O2 )将 Fe2+ 离子氧化为 Fe3+ 离子, 再调节溶液的 pH 值至约为 4, 使 Fe3+ 水解为 Fe(OH)3 沉淀而除去。
…… …… 余下全文
篇七 :实验一 无水硫酸铜的制备与提纯
实验一 无水硫酸铜的制备与提纯
一 目的及要求
(1)了解重结晶法提纯物质的原理
(2)联系并掌握溶解、过滤、加热、蒸发、重结晶等基本操作技能
二 原理
采用氧化铜与硫酸作用制取硫酸铜。CuO +H2SO4=CuSO4+H2O
将制备得到的硫酸铜在水中结晶,即得到无水硫酸铜晶体。
CuSO4+5H2O=CuSO4·5H2O
将反应产物中不溶性杂质用过滤方法除去。可溶性杂质用重结晶方法除去
三 主要仪器及试剂
电子天平(0.1g)、玻璃棒、酒精灯、石棉网、三脚架、烧杯(500ml)、蒸发皿、表面皿、量筒(10ml,50ml)、滤纸漏斗、漏斗架、锥形瓶(100ml)
四 内容及步骤
1.将浓硫酸稀释配成3摩每升
2.(1)称样,称取2.03gCuO粉末于洁净干燥的蒸发皿中。
(2)反应。用量筒量取20ml 3mol.\L H2SO4于上述蒸发皿中。将蒸发皿隔着石棉网用酒精灯加热,同时用玻璃棒不停地搅拌,溶液逐渐由黑色变为蓝色。当有大量结晶出现时,停止加热。用坩埚钳将蒸发皿取下,带齐充分冷却,有蓝色晶体析出,将母液倒入回收瓶中。
3.(1)溶解。用量筒量取15ml纯水,倒入盛有CuSO4·5H2O粗晶体的蒸发皿中,加热搅拌,溶液变蓝,晶体全部溶解后立即停止加热。
…… …… 余下全文
篇八 :五水硫酸铜结晶水含量的测定(综合实验)实验报告
五水硫酸铜结晶水含量的测定
一、实验目的要求:
1.了解制备五水硫酸铜晶体的方法。
2.测定硫酸铜的结晶水含量。
二、实验内容:
1.五水硫酸铜的提纯。
2.五水硫酸铜晶体自由水的脱去。
3.测定硫酸铜晶体里的结晶水含量。
三、主要仪器设备及药品:
仪器设备:电子天平,称量瓶,不锈钢锅(薄壁,内装食盐用于盐浴),温度计(量程在350℃,测量盐浴温度),烘箱(烘干自由水),电炉,滤纸,皮筋。
药品:五水硫酸铜,3公斤食盐左右(用于盐浴加热),无水乙醇。
四、实验原理
五水硫酸铜结构:
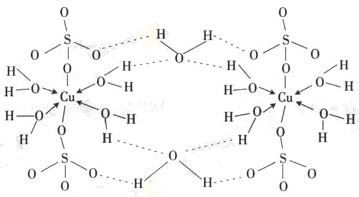
图1 CuSO4·5H2O的晶体结构
一般性质
硫酸铜CuSO4(硫酸铜晶体:CuSO4·5H2O)分子量249.68。深蓝色大颗粒状结晶体或蓝色颗粒状结晶粉末,略透明。有毒,无臭,带有金属涩味。密度2.2844g/cm-3。干燥空气中会缓慢风化。易溶于水,水溶液呈弱酸性。不溶于乙醇,缓缓溶于甘油。150℃以上将失去全部水结晶成为白色粉末状无水硫酸铜。五水硫酸铜有极强的吸水性,把它投入95%乙醇成含水有机物(即吸收水分)而恢复为蓝色结晶体。
失水过程
…… …… 余下全文