物理化学总总结
第一章 热力学第一定律
一、基本概念
系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律
热力学第一定律:ΔU=Q+W。
焦耳实验:U=f(T) ; H=f(T)
三、基本关系式
1、体积功的计算 δW= -pedV
恒外压过程:W= -peΔV
可逆过程: W=nRT
2、热效应、焓
等容热:QV =ΔU(封闭系统不作其他功)
等压热:Qp =ΔH(封闭系统不作其他功)
焓的定义:H=U+pV ; dH=dU+d(pV)
焓与温度的关系:ΔH=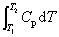
3、等压热容与等容热容
热容定义: ;
;
定压热容与定容热容的关系:
热容与温度的关系:Cp=a+bT+c’T2
四、第一定律的应用
1、理想气体状态变化
等温过程:ΔU=0 ; ΔH=0 ; W=-Q= pedV
pedV
等容过程:W=0 ; Q=ΔU= ; ΔH=
; ΔH=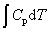
等压过程:W=-peΔV ; Q=ΔH=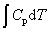 ; ΔU=
; ΔU=
可逆绝热过程:Q=0 ; 利用p1V1γ=p2V2γ求出T2,
W=ΔU= ;ΔH=
;ΔH=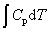
不可逆绝热过程:Q=0 ; 利用CV(T2-T1)=-pe(V2-V1)求出T2,
W=ΔU= ;ΔH=
;ΔH=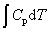
2、相变化
可逆相变化:ΔH=Q=nΔ_Hm;W=-p(V2-V1)=-pVg=-nRT ; ΔU=Q+W
3、热化学
物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算: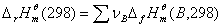
反应热与温度的关系—基尔霍夫定律:
 。
。
第二章 热力学第二定律
一、基本概念
自发过程与非自发过程
二、热力学第二定律
1、热力学第二定律的经典表述
克劳修斯,开尔文,奥斯瓦尔德。实质:热功转换的不可逆性。
2、热力学第二定律的数学表达式(克劳修斯不等式)
 “=”可逆;“>”不可逆
“=”可逆;“>”不可逆
三、熵
1、熵的导出:卡若循环与卡诺定理
2、熵的定义:
3、熵的物理意义:系统混乱度的量度。
4、绝对熵:热力学第三定律
5、熵变的计算
(1)理想气体等温过程: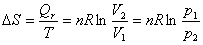
(2)理想气体等压过程:
(3)理想气体等容过程: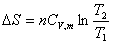
(4)理想气体pTV都改变的过程: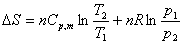
(5)可逆相变化过程:
(6)化学反应过程:
四、赫姆霍兹函数和吉布斯函数
1、定义:A=U-TS;G=H-TS
等温变化:ΔA=ΔU-TΔS;ΔG=ΔH-TΔS
2、应用:不做其他功时,ΔAT,V≤0 ;自发、平衡
ΔGT,p≤0 ;自发、平衡
3、热力学基本关系式
dA=-SdT-Vdp;dG=-SdT+pdV
4、ΔA和ΔG的求算
(1)理想气体等温过程
用公式:ΔA=ΔU-TΔS;ΔG=ΔH-TΔS
用基本关系式:dA=-SdT-Vdp;dG=-SdT+pdV
(2)可逆相变过程
ΔA=ΔU-TΔS=W=-nRT;ΔG=0
(3)化学反应过程的ΔG
标准熵法:ΔG=ΔH-TΔS
标准生成吉布斯函数法:
(4)ΔG与温度的关系
ΔG=ΔH-TΔS ,设ΔH、ΔS不随温度变化。
五、化学势
1、化学式的定义和物理意义
 ;在T、p及其他物质的量保持不变的情况下,增加1molB物质引起系统吉布斯函数的增量。
;在T、p及其他物质的量保持不变的情况下,增加1molB物质引起系统吉布斯函数的增量。
2、化学势的应用
在等温等压不作其他功时, <0自发;=0平衡;>逆向自发
<0自发;=0平衡;>逆向自发
3、化学时表示式
理想气体: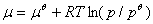
纯固体和纯液体:
第三章 化学平衡
一、化学平衡常数与平衡常数表达式
如:Zn+2HCl(aq)=H2+ZnCl2(aq);
二、 标准平衡常数的求算
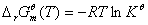
三、 范特荷夫等温方程
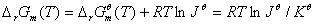
四、平衡常数与温度的关系
 ;
;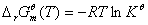
五、各种因素对平衡的影响
分压、总压、惰性气体、温度。
第四章 液态混合物和溶液
一、拉乌尔定律和亨利定律
1、拉乌尔定律
pA=p*xA ;pA=p*ax,A 适用于液态混合物和溶液中的溶剂。
2、亨利定律
pB=kx,BxB=kb,BbB=k%,B[%B] ; pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B 适用于溶液中的溶质。
二、液态混合物和溶液中各组分的化学势
1、理想液态混合物
 标准态为:同温下的液态纯溶剂。
标准态为:同温下的液态纯溶剂。
2、真实液态混合物
 标准态为:同温下的液态纯溶剂。
标准态为:同温下的液态纯溶剂。
3、理想稀溶液
溶剂: 标准态为:同温下的液态纯溶剂。
标准态为:同温下的液态纯溶剂。
溶质: 标准态为:同温下xB=1且符合亨利定律的溶质(假想状态)。
标准态为:同温下xB=1且符合亨利定律的溶质(假想状态)。
4、真实溶液
溶剂: ;ax,A=fx,A x; 标准态为:同温下的液态纯溶剂。
;ax,A=fx,A x; 标准态为:同温下的液态纯溶剂。
溶质: ; ax,B=γx,B xB; 标准态为:同温下xB=1且符合亨利定律的溶质(假想状态)。
; ax,B=γx,B xB; 标准态为:同温下xB=1且符合亨利定律的溶质(假想状态)。
 ; ab,B=γb,B bB; 标准态为:同温下bB=1且符合亨利定律的溶质(假想状态)。
; ab,B=γb,B bB; 标准态为:同温下bB=1且符合亨利定律的溶质(假想状态)。
 ; a%,B=γ%,B[%B]; 标准态为:同温下[B%]=1且符合亨利定律的溶质(一般为假想状态)。
; a%,B=γ%,B[%B]; 标准态为:同温下[B%]=1且符合亨利定律的溶质(一般为假想状态)。
三、各种平衡规律
1、液态混合物的气液平衡
pA=p ax,A ; pA=p
ax,A ; pA=p ax,A ; p=pA+pB
ax,A ; p=pA+pB
2、溶液的气液平衡
pA=p ax,A;pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B;p=pA+pB
ax,A;pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B;p=pA+pB
3、理想稀溶液的凝固点降低

4、分配定律
5、化学平衡
6、西弗特定律
第五章相平衡
一、相律
1、物种数、独立组分数、相数、自由度数
2、相律公式
f=C-φ+2
二、单组分系统
1、克-克方程
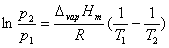
2、水的相图
三面、三线、一点。
三、双组分系统
1、相律分析
根据f=C-φ+1(一般固定压力),φ=2,f=1;φ=3,f=0
2、杠杆规则
3、步冷曲线
四、典型相图
1、Mg-Ge相图
2、Na-K相图
3、Ag-Cu相图
第六章电解质溶液
一、电解质溶液的电导
1、电导
G=1/R ; 单位:S(西门子)
2、电导率
G=κA/l 或κ=G l/A ; 单位:S/m
3、摩尔电导率
Λm=κ/c
4、无限稀释摩尔电导率

5、离子的电迁移
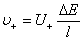 ;
; ;
;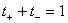
二、电解质溶液的活度
1、电解质的化学势(电解质溶液的浓度用mB或bB表示)


2、离子强度

3、德拜—休克尔极限公式
 ;适用于25℃时的极稀水溶液。
;适用于25℃时的极稀水溶液。
第七章电化学
一、可逆电池的构成
电池反应互为逆反应;充放电时电流无穷小。
二、可逆电池热力学
1、
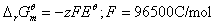
2、
3、
4、 ;电池反应做了其他功。
;电池反应做了其他功。
三、能斯特方程
1、电池反应的能斯特方程
 ;常用
;常用
2、电极反应的能斯特方程
 ;不常用
;不常用
四、可逆电极的种类
1、第一类电极
金属电极;气体电极
2、第二类电极
难溶盐电极;难溶氧化物电极
3、氧化还原电极
五、电极电势的应用
1、测定电池反应的热力学函数
2、测定电解质的
3、测定溶液的pH值
4、浓差定氧
六、极化现象和超电势
1、浓差极化
电极反应速度比离子迁移速度快造成的。
2、电化学极化
电极反应速度比电子移动速度慢造成的。
3、极化结果
 ;对阳极η总为正;对阴极η总为负。
;对阳极η总为正;对阴极η总为负。
七、金属腐蚀与防护
1、金属腐蚀
电化学腐蚀:析氢腐蚀,吸氧腐蚀
2、金属防护
阴极保护法:牺牲阳极法,外加电流法。
阳极保护法:钝化。
涂层保护法:热镀、电镀、有机涂层。
第八章 表面现象
一、表面吉布斯函数
1、产生
表面分子与内部分子的差别。
2、定义及单位
 ;J/m2或N/m;因此又称表面张力。
;J/m2或N/m;因此又称表面张力。
3、影响因素
物质本性、温度、相邻相、溶质的种类。
4、表面热力学
在温度、压力、组成不变的情况下,
缩小表面积和降低表面张力为自发方向。
二、弯曲液面的表面现象
1、附加压力
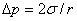
2、饱和蒸气压

3、毛细管现象

三、新相生成与介安状态
1、过饱和蒸汽与人工降雨
2、过冷现象与晶种
3、过饱和溶液与种盐
4、过热现象与沸石
5、淬火与回火
四、固体表面的吸附作用
1、物理吸附与化学吸附
范德华力与化学键力;又无选择性;单分子层与多分子层。
2、吸附曲线
等温线(判断单多层);等压线(判断吸附类型)、等量线(求吸附热)
3、吸附等温式
弗伦德里希:
朗格谬尔:
五、溶液表面的吸附
1、溶液的表面张力
各类溶质对表面张力的影响。
2、吉布斯吸附公式

六、润湿现象
1、接触角θ
θ=0°,完全润湿;θ<90°,润湿;θ>90°,不润湿;
θ=180°,完全不润湿。
2、杨氏方程

七、表面活性剂
1、定义
溶于水后能显著降低水的表面张力的物质。
2、分类
离子型、非离子型。
3、结构特点
一端亲水基一端亲油基。
4、应用
乳化、去污(增溶)、浮选、改变润湿角。
第九章 化学动力学基础
一、关于反应速率的基本概念
1、反应速率的表示

2、反应速率的测定
测定不同时刻的浓度(化学法、物理法),作c~t曲线,t时刻切线的斜率即为t时的反应速率。
3、基元反应和非基元反应
一步完成的反应为基元反应,基元反应遵守质量作用定律。是否基元反应只能通过实验确定。
4、速率方程与速率常数
质量作用定律是速率方程的特殊形式,对于非基元反应也有类似的式子。
速率常数仅与温度和催化剂有关,而与浓度无关。
5、反应级数
速率方程中浓度幂之和称之。基元反应一定为正整数,非基元反应可为0或小数。
二、浓度对反应速率的影响
1、一级反应
微分式: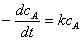 ——反应速率与浓度的一次方成正比;k的单位为时间-1;
——反应速率与浓度的一次方成正比;k的单位为时间-1;
积分式: ——以lnc~t作图得一直线;
——以lnc~t作图得一直线;
半衰期: ——与起始浓度无关。
——与起始浓度无关。
2、二级反应与准一级反应
微分式: ——反应速率与浓度的二次方成正比;k的单位为浓度-1时间-1;
——反应速率与浓度的二次方成正比;k的单位为浓度-1时间-1;
积分式: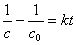 ——以1/c~t作图得一直线;
——以1/c~t作图得一直线;
半衰期: ——与起始浓度的一次方成反比。
——与起始浓度的一次方成反比。
准一级反应:对于A+B==Y+Z,当A大大过量或B大大过量时,可按一级反应处理。
3、反应级数的测定
尝试法:将一组c~t数据代入不同积分公式求k,若k为常数则所代公式正确;
作图法:将一组c~t数据按lnc~t、1/c~t等作图,若得直线可判定反应级数;
半衰期法:根据 得
得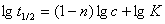 ,以
,以 ~
~ 作图可得直线,从斜率可求n。
作图可得直线,从斜率可求n。
微分法:根据 得
得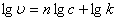 ,以
,以 ~
~ 作图可得直线,斜率即为n。
作图可得直线,斜率即为n。
四、温度对反应速率的影响
1、阿仑尼乌斯公式
微分式:
积分式:
2、活化能
活化分子的平均能量与反应物分子的平均能量之差。
第十章 复合反应动力学
一、复合反应基本类型
1、平行反应
 ;
;
2、对行反应
 ;
;
3、连串反应
 ;
; ;
;
二、复合反应机理近似处理方法
1、平衡态法
对于
 ;若
;若 ,则反应物与中间物达成平衡。
,则反应物与中间物达成平衡。
 ;
;
2、稳态法
对于
 ;若
;若 ,则中间物的浓度维持微小量不变。
,则中间物的浓度维持微小量不变。
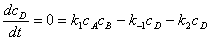 ;
;

三、链反应与爆炸半岛
1、链反应
分为直链反应和支链反应;链引发、链传递、链终止。
2、爆炸半岛
常见可燃气体在空气中的爆炸限。
第二篇:物理教学工作总结
物理教学工作总结
本学期我担任初二129班和初三128班物理教学工作,一学期很快过去,总体看,我认真落实教学工作计划,狠抓教学质量,努力完成各项任务,同时积极探索,改变教学方法,收到较好的效果。现将本学期的教育教学工作总结如下:
一、积极组织并参加教研活动。 为了不断提教学水平和教学质量,积极组织并参加我校的各种教研活动和联片教研活动。认真备课、上课、听课、评课。在教学上,有疑必问。同时,多听其他老师的课,做到边听边学,学习别人的优点,克服自己的不足,征求他们的意见,向老教师学习和交流取长补短,改进工作。特别是本学期以集体备课为平台,把初中物理第八章电功率各节和第十三章复习教学进行了深入的研究和探讨,形成比较成功完善的教学设计方案。
二、认真学习新课程标准。
本学期我校以教研组为单位认真学习新课程标准,发现《物理新课程标准》对物理的教学内容,教学方式,教学评估教育价值观等多方面都提出了许多新的要求。为此,我不断教学理论理念,深入研究拳的课标,明晰的目标,从而对新课程标准的基本理念,设计思路,课程目标,内容标准及课程实施建议有了更深的了解,本学期我在新课程标准的指导下教育教学工作跃上了一个新的台阶。 三、提高课堂教学质量
为了能提高课堂教学质量,顺利完成初二物理教学任务,我做了下面的工作: ①认真钻研教材,了解教材的结构,章节教学目标和教学重点与难点。②了解学生原有的知识技能,他们的兴趣、需要、方法、习惯,突破重点与难点应采取的措施。 ③考虑教法,解决如何让学生把知识掌握,包括如何组织教材、如何安排每节课的活动。 ④ 组织好课堂教学,关注全体学生,注意信息反馈,调动学生的兴趣,激发学生的情感,创造良好的课堂气氛。⑤做好课后辅导工作。 很多学生爱动、好玩,缺乏自控能力,常在学习上不能按时完成作业,有的学生抄袭作业。针对这种问题,抓好学生的思想教育,并使这一工作贯彻到对学生的学
习指导中去,通过各种途径激发他们的求知欲和上进心,让他们意识到学习并不是一项任务,也不是一件痛苦的事情。而是充满乐趣的。从而自觉的把身心投放到学习中去。这样,他们就会学得轻松,进步也快,兴趣和求知欲也会随之增加。
四、提高复习效率
如何提高初三物理总复习的质量和效益,我做了如下的工作:
1、夯实基础
物理的基本概念、定义、公式、规律是复习的重中之重。中考物理试题的一个显著特点就是注重基础。扎实的基础是成功解题的关键。
2、立足教材
整合知识,夯实基础,应以课本为主。只有吃透课本上的例题、探究,才能全面、系统地掌握基础知识和基本方法,构建成完整的知识网络,以不变应万变。
3、强化学生参与
教师要严格要求学生自主养成良好的学习习惯。认真阅读题目,仔细分析题意,规范解题格式,主动对知识、方法进行归纳、概括、总结等,加强解题的规范化,力争培养只要会做就能得分的良好习惯。
4、处理好课内与课外的关系
要真正减轻学生学习的负担,必须提高课堂45 分钟的效率,切实做到“时间花在备课上,功夫显在课堂上”。例题讲解前,留给学生思考时间;讲解中,让学生陈述不同解题思路,对于解题过程中的闪光之处或不足之处进行褒扬或纠正;讲解后,对解法进行总结。对题目要尽量做到一题多解,一题多用。
5、以“错”纠错,查漏补缺
积累错题,然后每过一段时间,就把“错题笔记”或标记错题的试卷拿出来看一看。这样复习就会有所侧重。查漏补缺的过程就是反思的过程。除了把不同的问题弄懂以外,还要学会“举一反三”,及时归纳。重复犯的错误一定会越来越少。
五、 突出中考物理教学与研究
1.合理安排每轮复习内容,认真分析和研究近三至五年的中考试题以及各地的模拟试卷。更好地把握中考的特点,使复习能把握大局,突出重点。
2.注意教学细节。如:①注意解题格式的训练。②精心设计实验探究教学,③注重回归教材,强调物理概念、规律。④加强实验教学,增强学生实践能力。 ⑤加强模拟练习,强化对知识的掌握和答题速度、节奏、经验等方面的积累训练。⑥注重解题中的错误分析。
以上是我半年来的工作总结,点点滴滴造就不凡,在今后的工作中,我将继续勤奋工作,从点滴做起,团结奋进,大胆创新,为教育事业奉献自己的力量。
-
物理化学总结
一、简史随着化学与物理学两个学科的发展,二者之间相互结合渗透并吸收其他学科(如计算机、数学等)的科研成果逐步形成比较成熟的现代的物…
-
物理化学各章节总结
物理化学每章总结第1章热力学第一定律及应用1系统环境及性质热力学中把研究的对象物质和空间称为系统与系统密切相关的其余物质和空间称为…
-
物理化学重点超强总结
第一章热力学第一定律1热力学三大系统1敞开系统有物质和能量交换2密闭系统无物质交换有能量交换3隔绝系统孤立系统无物质和能量交换2状…
-
物理化学(下)总结
物理化学下南京大学第五版总结第八章电解质溶液一基本概念与定义1离子迁移数t电解质溶液导电时溶液中的i离子运载的电流Ii与总电流之比…
-
物理化学学习小结
本学期,我们学习了物理化学这门课程,在这近半年的物理化学学习历程中,对于物理化学这门课程,我自己内心有了属于自己的深深地体会,在刚…
-
物理化学总结
第一章热一定律一基本概念系统与环境状态与状态函数广度性质与强度性质过程与途径热与功内能与焓二基本定律热力学第一定律UQW焦耳实验U…
-
物理化学总结
第二章热力学第一定律一基本概念系统与环境状态与状态函数广度性质与强度性质过程与途径热与功内能与焓二基本定律热力学第一定律UQW焦耳…
-
大学 物理化学 笔记总结
第一章物理化学的定义相变化物质在熔点沸点间的转化物理化学的基本组成1化学热力学方向限度2化学动力学速率与机理3结构化学物理化学的研…
-
物理化学重要概念公式总结
第一章热力学第一定律一基本概念系统与环境状态与状态函数广度性质与强度性质过程与途径热与功内能与焓二基本定律热力学第一定律UQW焦耳…
-
物理化学考点总结
第一章气体1理想气体状态方程pVnRT熟练掌握压力越低温度越高气体越能符合这个关系式我们把在任何压力任何温度下都能遵从此式的气体叫…
-
物理化学学习总结
学习物理化学已经有一学年的时间了,感触颇深,早在以前就听说物理化学是化学基础课中的难点,因为学习这么门课有它自身的学习方法,与其他…