物理化学重点超强总结
第一章 热力学第一定律 1、热力学三大系统:
(1)敞开系统:有物质和能量交换; (2)密闭系统:无物质交换,有能量交换; (3) 隔绝系统(孤立系统):无物质和能量交换。 2、状态性质(状态函数):
(1)容量性质(广度性质):如体积,质量,热容量。 数值与物质的量成正比;具有加和性。 (2)强度性质:如压力,温度,粘度,密度。
数值与物质的量无关;不具有加和性,整个系统的强度性质的数值与各部分的相同。
特征:往往两个容量性质之比成为系统的强度性质。 3、热力学四大平衡:
(1)热平衡:没有热隔壁,系统各部分没有温度差。
(2)机械平衡:没有刚壁,系统各部分没有不平衡的力存在,即压力相同 (3)化学平衡:没有化学变化的阻力因素存在,系统组成不随时间而变化。 (4)相平衡:在系统中各个相(包括气、液、固)的数量和组成不随时间而变化。 4、热力学第一定律的数学表达式:
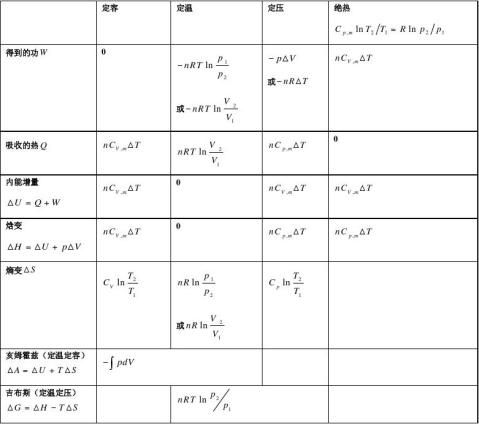
1
12、在通常温度下,对理想气体来说,定容摩尔热容为:
单原子分子系统 CV,m=
32
R
5262
双原子分子(或线型分子)系统 CV,m=多原子分子(非线型)系统 CV,m?定压摩尔热容:
单原子分子系统 Cp,m?
R R?3R
52
R
72R
双原子分子(或线型分子)系统 Cp,m?CV,m?RCp,m?多原子分子(非线型)系统 Cp,m?4R 可以看出:
Cp,m?CV,m?R
c'T
2
13、Cp,m的两种经验公式:Cp,m?a?bT?cT2 (T是热力学温度,a,b,c,c’ 是经 Cp,m?a?bT?
验常数,与物质和温度范围有关)
14、在发生一绝热过程时,由于?Q?0,于是dU??W
理想气体的绝热可逆过程,有:nCV,mdT??pdV ? CV,mln
T
2
T1
??Rln
V
2
V1
?CV,mln
p2p1
?Cp,mln
V1V
2
pV
?
?常数 ?=
Cp,mCV,m
>1.
15、焦耳?汤姆逊系数:?J-T=(
?T?p
)H
?J-T>0 经节流膨胀后,气体温度降低;
?J-T<0 经节流膨胀后,气体温度升高; ?J-T=0 经节流膨胀后,气体温度不变。
16、气体的节流膨胀为一定焓过程,即?H?0。
17、化学反应热效应:在定压或定容条件下,当产物的温度与反应物的温度相同而在反应过程中只做体积功不做其他功时,化学反应所
吸收或放出的热,称为此过程的热效应,或“反应热”。 18、化学反应进度:??
n?B?末?n?B?初
??B?
?rU
(对于产物v取正值,反应物取负值)
??1时,?rUm?
?
,?rHm?
?rH
?
19、(1)标准摩尔生成焓(?rHm):在标准压力和指定温度下,由最稳定的单质生成单位物质的量某物质的定压反应热,为该物质的
标准摩尔生成焓。
(2)标准摩尔燃烧焓(?cHm):在标准压力和指定温度下,单位物质的量的某种物质被氧完全氧化时的反应焓,为该物质的标
准摩尔燃烧焓。
任意一反应的反应焓?rHm等于反应物燃烧焓之和减去产物燃烧焓之和。
2
20、反应焓与温度的关系-------基尔霍夫方程
?Cp?0,???H?T?p?0???rH???HB???HA? ? p p?C(pB)?C(pA)??C?p??p???H?2???H?1???Cp?T2?T1???T???T???T?
?Cp?0,即产物热容小于反应物热容,则 ???H?T
?Cp?0,即产物热容大于反应物热容,则 ???H?T
?Cp?0,或很小时,反应焓将不随温度而改变。
21、基尔霍夫方程的应用: ?H?2???H?1???Cp?T2?T1?
适用条件:温度变化范围不大时,将 ?Cp近似看作常数,与温度无关。
第二章 热力学第二定律
1、热力学第二定律的经典表述:人们不可能设计成这样一种机器,这种机器能不断循环工作,它仅仅从单一热源吸热变为功而没有任何
其他变化。
2、卡诺循环:
过程1 保持T2定温可逆膨胀。故Q2??W1?RT2ln?p?0,即温度升高时反应焓减小。 ?p?0,即温度升高时反应焓增大。 V2
V1
2 过程2 绝热可逆膨胀。由于系统不吸热,Q?0,故 W
过程3 保持T1定温可逆压缩。故 Q1??W
过程4 绝热可逆压缩。故 W??U?CV(T1?T)2 3?RT1lnVV434??U?CV(T2?T)1 卡诺热机的效率:???W
Q2?T2?T1T2 制冷效率:??T1T2?T1
3、卡诺定理:
(1)在两个不同温度的热源之间工作的任意热机,以卡渃热机的效率为最大。否则将违
反热力学第二定律。
(2)卡诺热机的效率只与两个热源的温度有关,而与工作物质无关。否则也将违反热力学第二定律。
4、热力学第二定律人数学表达式--------克劳修斯不等式
dS??Q
T
dS是系统的熵变,?Q是实际过程中传递的热,T是热源温度,
号适用于不可逆过程。它的含义是:
(1)
(2)
(3)
?QT是实际过程中的热温商。该式的等号适用于可逆过程;大于假如某一过程的发生将使系统的熵变大于热温商,则该过程是一个不违反热力学第二定律的、有可能进行的不可逆过程。 假如某一过程发生时,系统的熵变为热温商相等地,则该过程是一个可逆过程。 dS??QT的过程不可能发生。 3
(4) 克劳修斯不等式用于孤立系统时,dS?0,即孤立系统中所发生的任意过程总是向着熵增大的方向进行。
5、熵变的计算:
(1)定温过程中的熵变:?S??
T2QrTnRTln?TV2V1?nRlnV2?nRlnp1 TV1p2CpdT
T
CVdT
T?Cpln?CVlnTT2(2)定压过程的熵变:?S?(3)定容过程的熵变:?S?
(4)相变化的熵变:?S???T?QrTT1T2????2T1T2T12 ?QrT1?H?Tn?H
TT1T1 (定温定压,两相平衡,可逆)
6、熵是系统混乱度的度量: S?kln?
?是热力学概率,k是玻耳兹曼常数。
7、热力学第二定律的本质:一切自发过程,总的结果都是向混乱度增加的方向进行。
8、热力学第三定律:在0K时,任何纯物质的完美晶体其熵值为零。
9、有反应: aA?bB?
ogG?oh Hooo 熵变计算:?rSm??gSm(G)?hSm(H)???aSm(A)?bSm(B)? ????
10、定温定容的系统--------亥姆霍兹函数A
(1)定义A?U?TS
(2)??A?T,V?W' 等式表示可逆,不等式表示不可逆。
在定温定容条件下,系统亥姆霍兹函数的减少等系统所能做的最大有效功(绝对值)。
(3)??A?T,V?0 ,表示能够发生的不可逆过程。
??A?T,V
??A?T,V?0 ,表示可逆过程(或平衡) ?0 ,表示不可能发生的过程
11、定温定压系统-----------吉布斯函数G
(1)定义: G?H?TS?U?pV?TS?A?pV
(2)??G?T,p?W' 等式表示可逆,不等式表示不可逆。
在定温定压条件下,系统亥姆霍兹函数的减少等系统所能做的最大有效功(绝对值)。
(3)??G?T,
??G?T,p?0 ,表示能够发生的不可逆过程。 ?0 ,表示可逆过程(或平衡)
?0 ,表示不可能发生的过程 p ??G?T,p
12、热力学的基本公式:
4
dU?TdS?pdV
当系统只做体积功不做其他功时dH?TdS?VdpdA??SdT?pdV
dG??SdT?Vdp
13、麦克斯韦关系式: ???T???V???T???p? S?????p ?S????V
??S???V???S???p?
??S???V???S???p?T?T?V ?????p ????p?T?V?T???????? ?
14、计算?G:
(1)定温:?G??p2
p1Vdp??p2p1nRTpdp?nRTlnp2
p1
(2)发生相变:始态和终态的两个相平衡,且温度和压力相同,则?G?0
始态和终态不平衡,则设计可逆过程来计算。
(3)化学反应:?G??H?T?S
(4)?G温度的变化--------吉布斯--亥姆霍兹公式
定温:?????G?????T?p????G??????G???Hp?????S ?T?p??G??H? ???2?TT????T?
应用式: ???G???G?T2????T1?
?T??T??T2
T1??H??2?T11?dT??H(?) ?T2T1?
附第二章 化学势
1、 (1)偏摩尔量的定义:多组分系统的任一种容量性质X(X可分别代表V,U,H,S,A,G等),可以看成是温度T、压力p及各
物质的量nB,nC,?的函数:
X?f?T,p,nB,nC,nD,???
??X???X???X???X?dX??dT?dp?dn ?dnB??? 定义: ????A?????T?p,n(B)??p?T,n(B)??nA?T,p,nC(C?A)??nB?T,p,nC(C?B)
de?f?X?XB????nB?T,则dX?XAdnA?XBdnB??? ?p,Cn??C?BXBdnB ?B
XB称为B的“偏摩尔量”。
(2)偏摩尔量的集合公式: X?nAXA?nCXC???
2、(1)化学势定义:?B??G?GB?? ??n?B?T,P,nC(C?B)
(2)物理意义:决定物质传递方向和限度的强度因素。
5
(3)定温定压下: dG???BdnB??Wr' ,也就是说??BdnB是定温度定压条件下一多组分均相系统在发生状态变化时所
能做出的最大有效功。
(4)在不做其他功的条件下,?dG?T,p?0是能够进行的过程;?dG?T,p?0,过程即达平衡。
p
p?3、理想气体化学势表达式:?????RTln
4、对于理想气体混合物来说,其中某种气体的行为与该气体单独占有混合气体总体积时的 行为相同。即?B??B?RTln?pBp?
5、实际气体的化学势:?????RTln?p
p????RTln?f?p??
定义逸度f??p 校正因子?称为逸度系数或逸度因子。
6、拉乌尔定律:一定温度时,溶液中溶剂的蒸气压pA与溶剂在溶液中的物质的量分数xA成正比,其比例是纯溶剂在该温度时的蒸气压pA(上标“*”表示纯物质)。即: *
pA?pAxA?pA?pA?p***AxB
(溶液蒸气压的降低与溶质在溶液中的摩尔分数成正比)
7、(1)理想液态混合物:在一定的温度和压力下液态混合物中任意一种物质在任意浓度下均遵守拉乌耳定律的液态混合物。
(2)理想液态混合物中物质的化学势:液态混合物与蒸气相达成平衡时,有:
?B(sln)??Bg(?)?B?g(?)RTpB*xB, ???B(l)?RTlnp
其中?B(l)??B(g)?RTln*?pBp*?
8、亨利定律:一定温度时,稀溶液中挥发性溶质的平衡分压与溶质在溶液中的摩尔分数成正比:pB?kxxB ,
pB是与溶液平衡的溶质蒸气的分压,xB是溶质在溶液中的摩尔分数,kx是比例常数,
称为亨利系数。其数值在一定温度下不仅与溶质性质有关,还有溶剂性质有关,可以大于
或小于纯溶质的饱和蒸汽压pB 。
9、理想稀溶液的定义:一定的温度和压力下,在一定的浓度范围内,溶剂遵守拉乌尔定律、溶质遵守亨利定律的溶液称为理想稀溶液。
10、不挥发性溶质理想稀溶液的依数性:
(1)凝固点降低:?Tf?*R(Tf)?fusHm
?*2?xB (?2fusHm与温度无关) =KfmB ,其中mB是溶液中溶质的质量摩尔浓度。 ?Kf是凝固点降低常数KR(Tf)M
?fusHm?*Af(MA是溶剂的摩尔质量,单位kg?mol?1)
6
(2)沸点升高:lnxA?
?vapH
R
?m
(
1Tb
?
1Tb
*
)
沸点升高常数Kb?
R(Tb)M?vapH
?m
*2
A
则?Tb?KbmB
(3)半透膜两边平衡时,纯溶剂的压力为p 、溶液的压力为p,则 p?p?? ,压力差?称为渗透压,
*
*
渗透压??cRT?MB?
?
WBRT?V1Tf
*
(4)求算活度:lnaA?
?fusHm
R
(?
1Tf
)?
?vapH
R
?m
(
1Tb
?
1Tb
)??*
?V
*m,A
RT
第三章 化学平衡
1、理想气体的化学反应:aA(g)?bB(g)???gG(g)?hH(g)
标准平衡常数K
?
?
(pGp)(pH
?
a
?g
p)
?
?h
(pAp)(pBp)
?
g
?
h
b
活度商Qa?
(pG'p)(pH'p)(pA'p)(pB'p)
?
?a?b
标准吉布斯函数变化?rGm 当Qa?K当Qa?K当Qa?K
?
??RTlnK
?
?rGm??rGm
?
?RTlnQa
时,?rGm?0,反应能够正向进行。 时,?rGm?0,反应能够逆向进行。 时,?rGm?0,反应达到平衡。。
?
?
2、平衡常数的表示法: (1)气相反应:K
?
?
(pGp)(pH
?
a
?g
p)
?
?h
(pAp)(pBp)
?B
b
?(?pB
?
?B
)(p)
????
(
???g?h?a?b
)
Kp??pB??(pxB)
???
?B
?(?xBB)p
??
?Kxp
??
Kx??xBB?Kpp Kx??xB
?B
?
?
(与温度、压力有关)=
?B
??(nBn总)B?(?nB
?
n)总
???
?Knn总
?
??
???
Kn?Kxn总
?
??
??
总结:K(2)液相反应:
?Kp(p)
????
?Kx(pp)?Kn(ppn总)
7
理想液态混合物:K
(3)复相反应: ???xB?B 理想稀溶液:K???(cBc)??B 非理想稀溶液:K???aB?B
3、(1)温度对平衡常数的影响:lnK
K??(2)(1)??rHm
R
??(1T1 ?1T2) (2)压力、惰性气体的影响:K??Kn(ppn总)??
第四章 多相平衡
1、相:系统中,物理及化学性质完全均一的部分。
气体:一个系统中,无论有多少气体,都只能形成一个气相。
液体:由于不同液体的相互溶解的程度不同,一个系统中可以有一个或两个液相,但不会超过三个。
固体:如果系统中的不同固体达到分子程度的均匀混合,形成固溶体,一种固溶
体是一个固相;否则,不论固体有多碎,系统中有多少固体,就有多少个
固相。
2、 物种数S:系统中所含的化学物质。
3、 组分数K:足以表示系统中各相组成所需要的最少独立物种数。
4、 独立化学平衡数R,独立溶度关系数R’
5、 K?S?R?R'
6、 自由度:在不引起旧相消失和新相形成的前提下,可以在一定范围内独立变动的强度性 质。
7、 相律:f?K???2(只考虑温度和压力)?为相数
普遍式:f?K???n
第五章 电化学
1、(1)原电池:正极是阴极(还原极);负极是阳极(氧化极)。
(2)电解池:正极是阳极(氧化极);负极是阴极(还原极)。
2、法拉第定律:当电流通过电解质溶液时,通过电极的电荷量与发生电极反应的物质的
量成正比:Q?nF,其中1F?96485C?mol
3、(1)溶液电阻R??1,n的数值就等于该离子的价态变化数。 ??lA? ,l为两电极间的距离,A为浸入溶液的电极面积,?为电阻率。
(2)电导率???l??1?G?? ?S?m?,G是倒数电导。 ??A?1
(3)摩尔电导率?m??cS?m?mol?2?1?
? 强电解质的摩尔电导率与物质的量溶度c
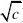
:?m??m(1?
?? ? 弱电解质的摩尔电导率(以HAc为例): ?m(HAc)??m
??H????Ac? ???m? ??m(HCl)??m
4、电导测定应用:
(1)求弱电解质的电离度?和电离平衡常数:???m?m?(NaA)c??m?(Na C)l
8
Kc? (2)求微溶盐的溶解度和溶度积: 饱和溶液的溶度:c? 溶解度:s?Mc 溶度积(AmBn):Ksp
n?
??c(A??
c?
2
1??
?
c?m
?m
?
2
(?
?
m
??
m
)
??
?m(盐)
?(盐)
???(H2O)?m(盐)
?
,
nmnm?
?)??mc???nc? )???c(B????
m
5、溶液中的离子的活度和活度系数: M
v?
Av??v?M
z?
?v?A
z?
(1)电解质的化学势可用各个离子的化学势之和表示:
??v????v???
?v?(??
?v???
??
?
?RTlna??)v??(?
?
v
?
?RT
v?
aln?
)
?v????RTlna??a?
???
?RTlna
?
(2)离子平均活度a?,与离子平均质量摩尔溶度m?和离子平均活度系数??的关系: a??? (3)对强电解质M
m
m
?
v?
Av?来说,令v?v??v?,定义离子平均活度a??a?a?
v
v?
v?
vv?v?
, 。
离子平均活度系数???????
(4)
,离子平均质量摩尔溶度m??m?
vv?
m?
v?
在稀溶液情况下,影响强电解质离子平均活度系数??的主要因素是浓度和离子价数,而且离子价数比浓度的影响更加显
著。溶液离子强度定义: I?
1
?m
2
B
B
zB (m是离子的质量摩尔浓度,z是离子价数,B是某种离子)
2
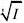
ln????A(温度和溶剂指定,A'为常数)
6、可将化学能转化为电能的装置叫电池,若此转化是以热力学可逆方式进行的,则称为“可逆电池”。在可逆电池中,系统吉布斯函
数的降低(?rGm)T'p,等于系统对外所做 的最大功W'r此时电池两极间的电势差可达最大值,称为该电池的电动势E,即:
(?rG
m
)T
'
p
?W'r??nFE
7、热力学意义上的可逆电池具备的两个条件:
(1)可逆电池放电时的反应与充电时的反应必须互为逆反应。 (2)可逆电池所通过的电流必须为无限小。 8、能斯特方程:
反应温度为T时,电池反应:aA?bB?gG?hH
9
方程:E?E
?
?
RTnF
ln
aGaHaAaB
?
ghb
a
(n是电极反应中得失电子数,aB是反应物质B的活度)
9、求算电池标准电动势:E
???rGm
?
nF
10、电动势E及其温度系数??E?T
?p与电池反应热力学量的关系:
?
???rGm???E???E?
??nF?S?nF?rm???? ?
?T?T?T??p??p??p
Sm?
??E?
nF?? ?rH
??T?p
?
定温条件,反应的可逆热效应:Qr?T?
r
??rGm?T?mS??rm
nF?E
??E?
n?? ??T?p
11、在任何温度下,H的标准摩尔生成吉布斯函数?fGm 标准摩尔熵Sm
?
?
、标准摩尔生成焓?fHm
?
及
均为零。
电极电势的表示:???
?
?
RTnF
ln
(a还原态)a(氧化态)
12、电极电势及其电池电动势的应用:
(1)判断反应趋势:电势越低,越易失去电子;电势越高,越易得到电子。 两个电极进行比较时,在?
判断。
?
?
?
?
值相差较大,或活度相近的情况下,可以用数据直接判断反应趋势,否则,均必须比较?值方可
(2)求化学反应的平衡常数:?rGm
??nFE??RTlnK ,则lnK
?
=
nFERT
?
(3)求微溶盐活度积:微溶盐活度积Ksp实质就是微溶盐溶解过程的平衡常数。 (4)求离子平均活度系数:测定一电池的电动势E,再由?
及离子平均活度系数??。
13、(1)当有电流通过电极时,发生的必然是不可逆的电极反应,此时的电极电势?i与可逆电极电势?r不同。
(2)电极在有电流通过时所表现的电极电势?i与可逆电极电势?r产生偏差的现象称为“电极的极化”;偏差的大小(绝对值)
称为“过电势”??
?
求得E
?
后,依据能斯特方程求算电池电解质溶液的离子平均活度a?
?i??r
(3)电极极化,阳极电势升高,阴极电势降低:
?i?阳极???r?? ; ?i?阴极???r??
第六章 化学动力学基本原理
1、反应速率的表示法:J?
d?dt
对于任意化学反应:aA?bB?gG?hH ,
10
其反应速率:J??
1dnAadt
??
1dnBbdt
?
?
1dnGgdt
?
1dnHhdt
8、 有许多的速率公式:r?k?A?
?
?B?
?
定义反应级数:n??????
3、对于基元反应:aA?bB?gG?hH ,
其速率公式:r?k?A?4、 速率常数k/(mol?dm
a
?B?
b
?1
?31?n
)?s
,n是反应级数。

5、 阿累尼乌斯经验公式:
dlnkdT
?
EaRT
2
?k?Ae
?EaRT
?1
?1
(Ea称为实验活化能,一般被看做与温度无关的常数,单位:J?mol或kJ?mol6、有效碰撞数q的计算:q?e
?EcRT
)
第七、八章 表面现象和分散系统
1、在一定的温度与压力下,对一定的液体来说,扩展表面所做的表面功?W'应与表面积dA成正比,以?表示比例系数:
?W'??dA
若扩展过程可逆:??(
?G?A
)T,p
?1
?可称为:表面吉布斯函数,表面能(J*m?2);表面张力(N*m)。
2、弯曲液面下的附加压力:?p?
2?r
(方向指向曲面球心,即无论凹凸液面,球内压力总是大于球外压力)。
11
曲率对蒸汽压的影响: 开尔文公式:lnpr'
p'?2?M
RTr?
pr'为饱和蒸汽压,p'为平面液体蒸汽压
3、毛细管现象:h?2?cos?
?gR(R为毛细管半径),完全润湿时:?=0.。
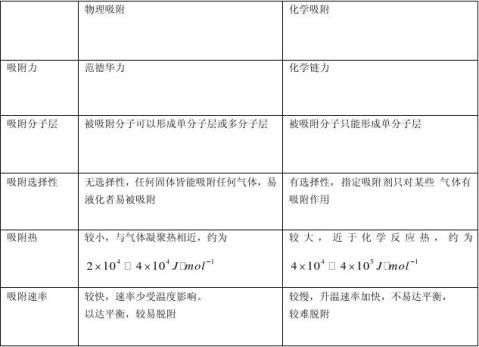
4、气体在固体表面的吸附:
(1)吸附等量式:???adsHm??lnp?(?adsHm是吸附热,为负;p为吸附质平衡分压) ??2?TRT??等量
(2)朗格缪尔等温式:a?k??
kbp1?bp(a为吸附量,)
第六章
1、设每种分布的微观状态数为tj ,那么系统的总微观状态数就等于各种分布的微观状态
数之和:???tj
?232、波尔兹曼定理:S?kln?(k?RL?1.38?10
3、斯特林近似:lnN!?NlnN?N
4、分子配分函数:
最概然分布方式:
) niN?gie??ikT??ikT?gei?ninj?giegje??i??jkT(?i为i级能量值,g为简并度) 12
-
物理化学总结
一、简史随着化学与物理学两个学科的发展,二者之间相互结合渗透并吸收其他学科(如计算机、数学等)的科研成果逐步形成比较成熟的现代的物…
-
物理化学各章节总结
物理化学每章总结第1章热力学第一定律及应用1系统环境及性质热力学中把研究的对象物质和空间称为系统与系统密切相关的其余物质和空间称为…
-
物理化学重点超强总结
第一章热力学第一定律1热力学三大系统1敞开系统有物质和能量交换2密闭系统无物质交换有能量交换3隔绝系统孤立系统无物质和能量交换2状…
-
物理化学(下)总结
物理化学下南京大学第五版总结第八章电解质溶液一基本概念与定义1离子迁移数t电解质溶液导电时溶液中的i离子运载的电流Ii与总电流之比…
-
物理化学学习小结
本学期,我们学习了物理化学这门课程,在这近半年的物理化学学习历程中,对于物理化学这门课程,我自己内心有了属于自己的深深地体会,在刚…
-
物理化学总结
第一章热一定律一基本概念系统与环境状态与状态函数广度性质与强度性质过程与途径热与功内能与焓二基本定律热力学第一定律UQW焦耳实验U…
-
物理化学总结
第二章热力学第一定律一基本概念系统与环境状态与状态函数广度性质与强度性质过程与途径热与功内能与焓二基本定律热力学第一定律UQW焦耳…
-
物理化学总总结
第一章热力学第一定律一基本概念系统与环境状态与状态函数广度性质与强度性质过程与途径热与功内能与焓二基本定律热力学第一定律UQW焦耳…
-
大学 物理化学 笔记总结
第一章物理化学的定义相变化物质在熔点沸点间的转化物理化学的基本组成1化学热力学方向限度2化学动力学速率与机理3结构化学物理化学的研…
-
物理化学重要概念公式总结
第一章热力学第一定律一基本概念系统与环境状态与状态函数广度性质与强度性质过程与途径热与功内能与焓二基本定律热力学第一定律UQW焦耳…
-
初三下学期物理化学知识点大总结
初三下学期物理化学知识点大总结.txt22真诚是美酒,年份越久越醇香浓型;真诚是焰火,在高处绽放才愈是美丽;真诚是鲜花,送之于人手…