八下物理第一章总结
八年级物理第七单元知识总结
重力
1.重力:由于地球的吸引而使物体受到的力
2.重力的大小:物体所受的重力与物体的质量成正比
G=mg g=9.8N/kg
3.重力的方向:竖直向下
4.重力的作用点:重心
力
1.力的三要素:
力的大小、方向、作用点都可以影响力的作用效果,称为力的三要素。
2.力是物体对物体的作用。
3.力的作用是相互的。
4.力的作用效果:
(1)可以使物体发生形变;
(2)可以改变物体的运动状态。
5.力的表示法。
弹力
一.弹簧测力计的使用方法:
1.使用前:
观察弹簧测力计的“0”刻线、量程和分度值
2.测量时:
要使弹簧测力计的受力方向沿轴线方向
3.观察时:
视线必须与刻度盘垂直
二.弹力:物体发生弹性形变时能产生力
物体发生的弹性形变越大,产生的弹力也越大。
拉力、压力等都属于弹力。
三.力的测量
工具:测力计,弹簧测力计是实验室常用的一种
原理:受到的拉力越大,弹簧伸长得越长
使用方法:观察 调零 读数
第二篇:八下科学第一章知识总结
第一章 粒子的模型与符号
§第1节 模型、符号的建立与作用
1、模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。用符号能简单明了地表示事物,还可避免由于事物外形不同和表达的文字语言不同而引起的混乱。
2、改变温度可以改变物质的状态,这是一种物理变化,这个物理变化的实质就是分子之间的空隙在变化。
§第2节 物质与微观粒子模型
1、原子的概念由英国科学家道尔顿提出,分子的概念由意大利科学家阿伏伽德罗提出。
2、在由分子构成的物质中,分子是保持物质化学性质的最小粒子,分子不一定能保持物质的物理性质。在由原子构成的物质中,原子是保持物质化学性质的最小粒子。
3、分子与原子的根本区别:在化学变化中,分子可分,原子不可再分(也可以说成“原子是化学变化中的最小微粒”)。
4、在化学变化中,分子种类一定改变,分子个数不一定改变,原子种类和个数都不变。
5、物质通常是由分子构成的,但也有些物质是直接由原子构成的。
?一切金属?由原子直接构成的物质氡) ?稀有气体/惰性气体(氦氖氩氪氙
?“石”偏旁的固体非金属(碘除外)?
6、①分子的结构决定性质;②分子的种类由原子的种类和数量决定;③构成分子的原子可以是同种原子,也可以是不同种原子;④如果构成物质的微粒原子空间排列不同,构成的物质也不同(同素异形体)。
同素异形体是指同种元素组成的不同形态的单质,如金刚石与石墨(由碳原子直接构成)、红磷与白磷(由磷原子直接构成),它们的物理性质虽不相同,但化学性质相似。
–107、原子半径一般在10米数量级,原子质量一般在10–26千克数量级。
§第3节 原子结构的模型
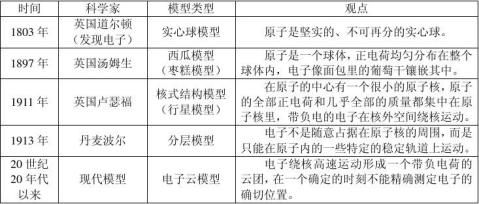
实验过程:用α粒子轰击金属箔。
①α粒子即氦的原子核,带正电荷。
②金属箔由黄金制造。原因:利用它的延展性使实验效果更明显。
3、研究原子核内部结构的方法:用高能量的粒子撞击、打碎核。
4、原子核由质子和中子构成,质子和中子又是由夸克构成的。
5、原子的结构:
??核外电子(带负电荷)? 原子?质子(带正电荷)??原子核???中子(不带电荷)?
一个质子所带电量等于一个电子所带电量等于1.6×10–19库仑(即所说的一个单位)。
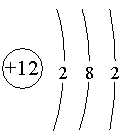
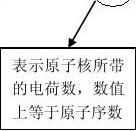
6、原子核所带的电荷数叫做核电荷数,在一个原子中,核电荷数等于质子数等于核外电子数。原子种类由质子数(核电荷数)决定。
7、原子结构示意图(以镁原子为例)。
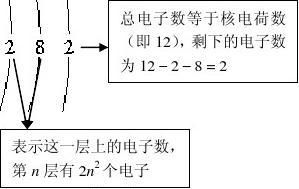
8、具有相同核电荷数(质子数)的一类原子总称为元素,它是用来描述物质组成的,其种类由质子数(核电荷数)决定。元素只能讲“种”,而不能讲“个”。
9、核内质子数相同、中子数不相同的同类原子统称为同位素。
???中子数相同(同种原子)??质子数相同??同种元素?元素 原子??中子数不同(同类原子)????质子数不同(不同种元素)??
元素是同位素原子的总称,同位素原子是同种元素的不同种原子。
a10、为区别同位素原子,用bX形式来区别,其中X表示其元素符号,a表示质子数与中
子数的总和,b表示核电荷数(质子数),也可以表示为X—a(或X用中文名称替代)。
11、同位素原子的应用。
氢有3种同位素原子(氕、氘、氚),后两者可以制造氢弹,
氧—18可以用来追踪,碳—14可以用来测定古董年代,铀—235可以用来造氢弹。
12、钠(Na)在氯气(Cl2)中燃烧的实验。
化学用品:①钠:常温常压下为银白色固态金属,常保存在煤油中。
②氯气:常温常压下为黄绿色的有毒气体。
实验现象:钠剧烈燃烧,产生白烟,反应结束后有白色固体生成。
实验实质:钠原子失去电子形成钠离子(Na+),氯离子得到电子形成氯离子(Cl–),带正电的钠离子与带负电的氯离子相吸引形成了电中性的氯化钠(NaCl)。
13、离子也是构成物质的基本粒子。离子是带电的原子或原子团,带正电的叫阳离子,带负电的叫阴离子。若物质由一种金属元素和一种非金属元素组成,那么它一般由离子构成。
14、得失电子的变化属于化学变化,原子团在化学反应前后结构相对稳定。
§第4节 组成物质的元素
1、人类已知的元素有110多种。 2、物质的分类:
?
?混合物
构成的物质/分子种类? 物质??????????
单质??纯净物?组成的元素种类???????
??化合物?混合物没有固定的沸点,可以用化学式表示的物质一定是纯净物。
3、元素的分类:
及汞)?金属元素(钅字旁的以
元素?
元素)?非金属元素(包括稀有
稀有气体(又称惰性气体)化学性质非常稳定,在通常情况下很难与其他元素或物质
发生化学反应,这类元素就叫稀有元素。在110多种元素中,金属元素占大多数。 4、元素的存在形态:
元素的存在形态
离态(单质中的元素?游
?合态(化合物中的元?化
)
素)
5、元素的分布:
①在地壳中:氧、硅、铝、铁。 ②在人体中:氧、碳、氢。 ③在海水中:氧、氢、氯、钠。
6、有机化合物主要由碳、氢、氧三种元素组成。人造元素是通过核反应制得的,放射性对人体有害,但也可以检查和治疗一些疾病。空气中含量最高的是氮,宇宙中含量最高的是氢。
§第5节 表示元素的符号
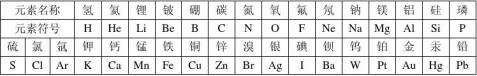
元素符号还可以表示这种物质。
3、元素周期表。
元素周期表中每一个横行叫做周期,每个周期中,按照金属元素—非金属元素—稀有元素排列,从左到右元素原子的核电荷数(原子序数)逐渐增加,金属的活动性逐渐减弱;每一个纵列叫做族,每个族中,元素的化学性质都很相似且最外层电子数相同。元素周期表内共有7个周期,18个族。
4、俄罗斯化学家门捷列夫制成了第一张元素周期表。
§第6节 表示物质的符号
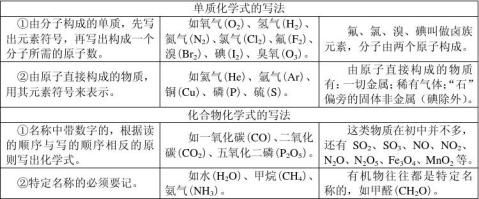
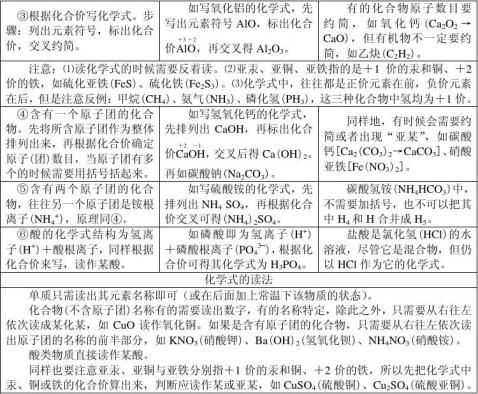
1、用元素符号来表示物质组成的式子叫做化学式。原子之间相互化合的数目用化合价来表示,化合价是元素的一种化学性质。化合物中所有元素化合价的代数和为0,单质中元素的化合价为0。
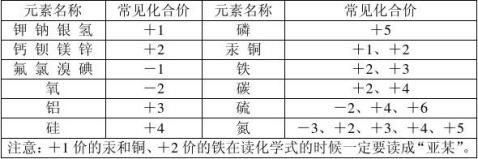
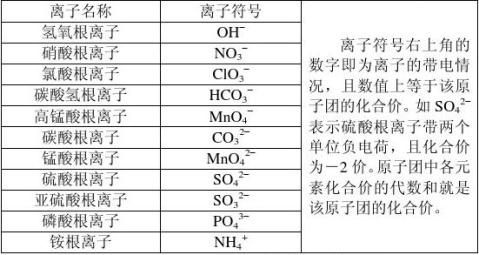
2常见的化合物中氢总是+1价,氧总是-2价;金属元素常显正价;非金属元素跟氧化合时常显正价,跟氢化合时常显负价;有些元素在不同的化合物里显不同的化合价,如CO和CO2中的碳元素,有些元素在不同的化合物里显相同的化合价,如CO2与H2O中的氧元素,同种元素在同一化合物中可能显不同的化合价,如硝酸铵(NH4NO3)中的氮元素依次显-3价和+5价。
3、离子的符号:在该离子元素符号右上角标出所带的电荷数,离子的带电情况由化合价决定,如+1价的钠离子就表示为Na+,氧离子为O2–(电荷1可以省略,且数字写在前面)。
4、由2种以上元素原子组成的离子叫做某某根离子。
5、化学式的写法与读法。
§第7节 元素符号表示的量
1(1.661×10–27kg)的比值叫做该原子的相对原子12
质量。相对原子质量是一个比值,没有单位。相对原子质量的比等于原子实际质量的比。
2、相对原子质量≈质子数+中子数。
3、一个分子中各原子的相对原子质量总和就是该分子的相对分子质量(也叫式量)。相对
1分子质量=该分子实际质量÷C—12原子质量的。 12
4、化学式表示的含义(以CO2为例)。
①表示二氧化碳气体;②表示二氧化碳由氧元素和碳元素组成;③表示一个二氧化碳 分子;④表示一个二氧化碳分子由两个氧原子和一个碳原子构成;⑤表示二氧化碳的相对分子质量为(12+2×16=)44。
5、元素质量比与质量分数的计算(以XaYb分子为例)。
①X与Y的质量比=(a·X的相对原子质量)︰(b·Y的相对原子质量);
②X的质量分数=(a·X)÷(aX + bY)×100%。
6、氮肥是含有氮元素的物质,如碳酸氢铵、硫酸铵、硝酸铵、尿素[CO(NH2)2]等。
7、其它公式(R表示某元素):
①混合物中R%=纯度×纯净物中R%(杂质中不含R元素);
②元素质量之比=元素质量分数之比。 1、某原子的质量与C—12原子质量的
-
物理第一章总结
1做平动物体:物体各点运动方向一致2位移和路程的关系:位移表示物体位置变化,路程表示物体运动轨迹的长度,位移是矢量,有大小和方向,…
-
高中物理第一章总结
高中物理第一章总结1、胡克定律:F=Kx(x为伸长量或压缩量,K为倔强系数,只与弹簧的原长、粗细和材料有关)2、重力:G=mg(g…
-
八下物理第一章总结
八年级物理第七单元知识总结重力1重力由于地球的吸引而使物体受到的力2重力的大小物体所受的重力与物体的质量成正比Gmgg98Nkg3…
-
高二物理第一章知识总结
第一章电场一基本知识点梳理1点电荷当本身线度比电荷间的距离小很多研究相互作用时该带电体的形状可忽略相当于一个带电的点叫点电荷自然界…
-
高中物理必修1第一章知识全面总结
第一章运动的描述考点一时刻与时间间隔的关系时间间隔能展示运动的一个过程时刻只能显示运动的一个瞬间对一些关于时间间隔和时刻的表述能够…
-
高一物理必修1第一章、第二章知识点总结及各知识点分析与答案
第一章知识点总结考点一:路程与位移的关系位移表示位置变化,用由初位置到末位置的有向线段表示,是矢量。路程是运动轨迹的长度,是标量。…
-
人教版初二物理第一章知识点总结
第一章《声现象》复习提纲一、声音的发生与传播1、课本P13图1.1-1的现象说明:也停止,该现象说明振动停止发声也停止。振动的物体…
-
物理第一章总结
1做平动物体:物体各点运动方向一致2位移和路程的关系:位移表示物体位置变化,路程表示物体运动轨迹的长度,位移是矢量,有大小和方向,…
-
物理选修3-1第一章知识点归纳
第一章静电场公式集1、最小的电荷量叫“元电荷”e=1.6*10-19C一个电子所带的电荷量为1e2、库仑定律F=kQq/r2k:静…
-
高一物理必修一_人教版_知识点总结修改[1]
物理必修一知识点总结任一时刻物体运动的位移物体运动速度的大小直线或切线的斜率大小图线向上倾斜表示物体沿正向作直线运动图线向下倾斜表…