高中数学选修4—4(坐标系与参数方程)知识点总结
坐标系与参数方程 知识点
1.平面直角坐标系中的坐标伸缩变换
设点P(x,y)是平面直角坐标系中的任意一点,在变换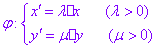 的作用下,点P(x,y)对应到点
的作用下,点P(x,y)对应到点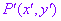 ,称
,称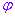 为平面直角坐标系中的坐标伸缩变换,简称伸缩变换.
为平面直角坐标系中的坐标伸缩变换,简称伸缩变换.
2.极坐标系的概念
(1)极坐标系
如图所示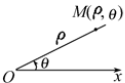 ,在平面内取一个定点
,在平面内取一个定点 ,叫做极点,自极点
,叫做极点,自极点 引一条射线
引一条射线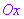 ,叫做极轴;再选定一个长度单位,一个角度单位(通常取弧度)及其正方向(通常取逆时针方向),这样就建立了一个极坐标系.
,叫做极轴;再选定一个长度单位,一个角度单位(通常取弧度)及其正方向(通常取逆时针方向),这样就建立了一个极坐标系.
注:极坐标系以角这一平面图形为几何背景,而平面直角坐标系以互相垂直的两条数轴为几何背景;平面直角坐标系内的点与坐标能建立一一对应的关系,而极坐标系则不可.但极坐标系和平面直角坐标系都是平面坐标系.
(2)极坐标
设M是平面内一点,极点 与点M的距离|OM|叫做点M的极径,记为
与点M的距离|OM|叫做点M的极径,记为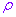 ;以极轴
;以极轴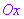 为始边,射线
为始边,射线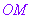 为终边的角
为终边的角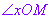 叫做点M的极角,记为
叫做点M的极角,记为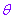 .有序数对
.有序数对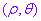 叫做点M的极坐标,记作
叫做点M的极坐标,记作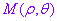 .
.
一般地,不作特殊说明时,我们认为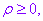
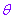 可取任意实数.
可取任意实数.
特别地,当点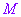 在极点时,它的极坐标为(0,
在极点时,它的极坐标为(0, 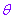 )(
)(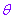 ∈R).和直角坐标不同,平面内一个点的极坐标有无数种表示.
∈R).和直角坐标不同,平面内一个点的极坐标有无数种表示.
如果规定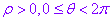 ,那么除极点外,平面内的点可用唯一的极坐标
,那么除极点外,平面内的点可用唯一的极坐标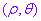 表示;同时,极坐标
表示;同时,极坐标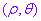 表示的点也是唯一确定的.
表示的点也是唯一确定的.
3.极坐标和直角坐标的互化
(1)互化背景:把直角坐标系的原点作为极点,x轴的正半轴作为极轴,并在两种坐标系中取相同的长度单位,如图所示:
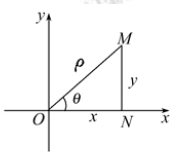
(2)互化公式:设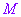 是坐标平面内任意一点,它的直角坐标是
是坐标平面内任意一点,它的直角坐标是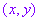 ,极坐标是
,极坐标是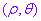 (
(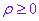 ),于是极坐标与直角坐标的互化公式如表:
),于是极坐标与直角坐标的互化公式如表:

在一般情况下,由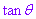 确定角时,可根据点
确定角时,可根据点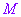 所在的象限最小正角.
所在的象限最小正角.
4.常见曲线的极坐标方程

注:由于平面上点的极坐标的表示形式不唯一,即 都表示同一点的坐标,这与点的直角坐标的唯一性明显不同.所以对于曲线上的点的极坐标的多种表示形式,只要求至少有一个能满足极坐标方程即可.例如对于极坐标方程
都表示同一点的坐标,这与点的直角坐标的唯一性明显不同.所以对于曲线上的点的极坐标的多种表示形式,只要求至少有一个能满足极坐标方程即可.例如对于极坐标方程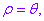 点
点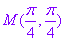 可以表示为
可以表示为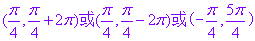 等多种形式,其中,只有
等多种形式,其中,只有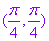 的极坐标满足方程
的极坐标满足方程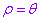 .
.
二、参数方程
1.参数方程的概念
一般地,在平面直角坐标系中,如果曲线上任意一点的坐标 都是某个变数
都是某个变数 的函数
的函数 ①,并且对于
①,并且对于 的每一个允许值,由方程组①所确定的点
的每一个允许值,由方程组①所确定的点 都在这条曲线上,那么方程①就叫做这条曲线的参数方程,联系变数
都在这条曲线上,那么方程①就叫做这条曲线的参数方程,联系变数 的变数
的变数 叫做参变数,简称参数,相对于参数方程而言,直接给出点的坐标间关系的方程叫做普通方程.
叫做参变数,简称参数,相对于参数方程而言,直接给出点的坐标间关系的方程叫做普通方程.
2.参数方程和普通方程的互化
(1)曲线的参数方程和普通方程是曲线方程的不同形式,一般地可以通过消去参数而从参数方程得到普通方程.
(2)如果知道变数 中的一个与参数
中的一个与参数 的关系,例如
的关系,例如 ,把它代入普通方程,求出另一个变数与参数的关系
,把它代入普通方程,求出另一个变数与参数的关系 ,那么
,那么 就是曲线的参数方程,在参数方程与普通方程的互化中,必须使
就是曲线的参数方程,在参数方程与普通方程的互化中,必须使 的取值范围保持一致.
的取值范围保持一致.
注:普通方程化为参数方程,参数方程的形式不一定唯一。应用参数方程解轨迹问题,关键在于适当地设参数,如果选用的参数不同,那么所求得的曲线的参数方程的形式也不同。
3.圆的参数
如图所示,设圆 的半径为
的半径为 ,点
,点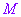 从初始位置
从初始位置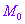 出发,按逆时针方向在圆
出发,按逆时针方向在圆 上作匀速圆周运动,设
上作匀速圆周运动,设 ,则
,则 。
。
这就是圆心在原点 ,半径为
,半径为 的圆的参数方程,其中
的圆的参数方程,其中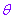 的几何意义是
的几何意义是 转过的角度。
转过的角度。
圆心为 ,半径为
,半径为 的圆的普通方程是
的圆的普通方程是 ,
,
它的参数方程为: 。
。
4.椭圆的参数方程
以坐标原点 为中心,焦点在
为中心,焦点在 轴上的椭圆的标准方程为
轴上的椭圆的标准方程为 其参数方程为
其参数方程为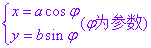 ,其中参数
,其中参数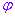 称为离心角;焦点在
称为离心角;焦点在 轴上的椭圆的标准方程是
轴上的椭圆的标准方程是 其参数方程为
其参数方程为 其中参数
其中参数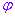 仍为离心角,通常规定参数
仍为离心角,通常规定参数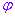 的范围为
的范围为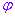 ∈[0,2
∈[0,2 )。
)。
注:椭圆的参数方程中,参数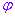 的几何意义为椭圆上任一点的离心角,要把它和这一点的旋转角
的几何意义为椭圆上任一点的离心角,要把它和这一点的旋转角 区分开来,除了在四个顶点处,离心角和旋转角数值可相等外(即在
区分开来,除了在四个顶点处,离心角和旋转角数值可相等外(即在 到
到 的范围内),在其他任何一点,两个角的数值都不相等。但当
的范围内),在其他任何一点,两个角的数值都不相等。但当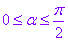 时,相应地也有
时,相应地也有 ,在其他象限内类似。
,在其他象限内类似。
5.双曲线的参数方程
以坐标原点 为中心,焦点在
为中心,焦点在 轴上的双曲线的标准议程为
轴上的双曲线的标准议程为 其参数方程为
其参数方程为 ,其中
,其中
焦点在 轴上的双曲线的标准方程是
轴上的双曲线的标准方程是 其参数方程为
其参数方程为
以上参数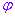 都是双曲线上任意一点的离心角。
都是双曲线上任意一点的离心角。
6.抛物线的参数方程
以坐标原点为顶点,开口向右的抛物线 的参数方程为
的参数方程为
7.直线的参数方程
经过点 ,倾斜角为
,倾斜角为 的直线
的直线 的普通方程是
的普通方程是 而过
而过 ,倾斜角为
,倾斜角为 的直线
的直线 的参数方程为
的参数方程为
 。
。
注:直线参数方程中参数的几何意义:过定点 ,倾斜角为
,倾斜角为 的直线
的直线 的参数方程为
的参数方程为
 ,其中
,其中 表示直线
表示直线 上以定点
上以定点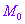 为起点,任一点
为起点,任一点 为终点的有向线段
为终点的有向线段 的数量,当点
的数量,当点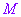 在
在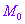 上方时,
上方时, >0;当点
>0;当点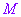 在
在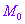 下方时,
下方时, <0;当点
<0;当点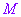 与
与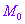 重合时,
重合时, =0。我们也可以把参数
=0。我们也可以把参数 理解为以
理解为以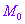 为原点,直线
为原点,直线 向上的方向为正方向的数轴上的点
向上的方向为正方向的数轴上的点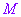 的坐标,其单位长度与原直角坐标系中的单位长度相同。
的坐标,其单位长度与原直角坐标系中的单位长度相同。
第二篇:高一化学必修一知识点及方程式总结
高一化学必修一知识点及方程式总结.txt如果不懂就说出来,如果懂了,就笑笑别说出来。贪婪是最真实的贫穷,满足是最真实的财富。幽默就是一个人想哭的时候还有笑的兴致。高一化学(必修1)各章知识要点归纳
第一章从实验学化学 第一节化学实验基本方法
一.化学实验安全
1. 遵守实验室规则。2. 了解安全措施。
(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。
(2)烫伤宜找医生处理。
(3)浓酸沾在皮肤上,用水冲净然后用稀NaHCO3溶液淋洗,然后请医生处理。
(4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
(5)钠、磷等失火宜用沙土扑盖。
(6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。
3. 掌握正确的操作方法。例如,掌握仪器和药品的使用、加热方法、气体收集方法等。
二.混合物的分离和提纯
1. 过滤和蒸发
实验1—1 粗盐的提纯
仪器 : 天平,烧杯,玻璃棒,漏斗,铁架台,铁圈步骤 :
步骤 现象
1.溶解:称取4克粗盐加到盛有12mL水的小烧杯中,用玻璃棒搅拌使氯化钠充分溶解 粗盐逐渐溶解,溶液浑浊。
2.过滤:组装好仪器,将1中所得到的混合物进行过滤。若滤液浑浊,要再次过滤,直到滤液澄清为止。 滤纸上有不溶物残留,溶液澄清。
3.蒸发:将过滤后的澄清溶液转入蒸发皿,加热,并用玻璃棒搅拌,防止液滴飞溅。当出现较多固体时停止加热,余热蒸干。 蒸发皿中产生了白色固体。
注意事项:(1)一贴,二低,三靠。
(2)蒸馏过程中用玻璃棒搅拌,防止液滴飞溅。
2. 蒸馏和萃取(1) 蒸馏
原理:利用沸点的不同,处去难挥发或不挥发的杂质。
实验1---3 从自来水制取蒸馏水
仪器:温度计,蒸馏烧瓶,石棉网,铁架台,酒精灯,冷凝管,牛角管,锥形瓶。 操作:连接好装置,通入冷凝水,开始加热。弃去开始蒸馏出的部分液体,用锥形瓶收集约10mL液体,停止加热。
现象: 随着加热,烧瓶中水温升高至100度后沸腾,锥形瓶中收集到蒸馏水。
注意事项:①温度计的水银球在蒸馏烧瓶的支管口处。②蒸馏烧瓶中放少量碎瓷片-----防液体暴沸。③冷凝管中冷却水从下口进,上口出。
④先打开冷凝水,再加热。⑤溶液不可蒸干。
(2)萃取
原理: 用一种溶把溶质从它与另一溶剂所组成的溶液里提取出来。
仪器: 分液漏斗, 烧杯
步骤:①检验分液漏斗是否漏水。
②量取10mL碘的饱和溶液倒入分液漏斗, 注入4mLCCl4,盖好瓶塞。
③用右手压住分液漏斗口部, 左手握住活塞部分, 把分液漏斗倒转过来用力振荡。
④将分液漏斗放在铁架台上,静置。
⑤待液体分层后, 将分液漏斗上的玻璃塞打开,从下端口放出下层溶液,从上端口倒出上层溶液.
注意事项:
A.检验分液漏斗是否漏水。
B.萃取剂: 互不相溶,不能反应。
C.上层溶液从上口倒出,下层溶液从下口放出。
三.离子检验
离子 所加试剂 现象 离子方程式
Cl- AgNO3,稀HNO3 产生白色沉淀 Cl-+Ag+=AgCl↓
SO42- Ba(NO3)2稀HNO3 白色沉淀 SO42-+Ba2+=BaSO4↓
四.除杂
1.原则:杂转纯、杂变沉、化为气、溶剂分。
2.注意:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。
第二节 化学计量在实验中的应用
一.物质的量的单位――摩尔
1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol):把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数
把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA
5.摩尔质量(M)
(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量。(2)单位:g/mol 或 g..mol-1
(3) 数值:等于该粒子的相对原子质量或相对分子质量。
6.物质的量=物质的质量/摩尔质量 ( n = m/M )
二.气体摩尔体积
1.气体摩尔体积(Vm)
(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积。
(2)单位:L/mol 或 m3/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm
3.(1)0℃ 101KPa , Vm = 22.4 L/mol
(2)25℃ 101KPa , Vm = 24.8 L/mol
三.物质的量在化学实验中的应用
1.物质的量浓度
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。(2)单位:mol/L , mol/m3
(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V
2.一定物质的量浓度的配制
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用物质的量浓度计算的方法,求出所需溶质的质量或体积,在烧杯中溶解并在容器内用溶剂稀释为规定的体积,就得欲配制的溶液。
(2)主要操作
A.检验是否漏水;B.配制溶液 ○1计算;○2称量;○3溶解;○4转移;○5洗涤;
○6定容;○7摇匀;○8贮存溶液。
注意事项:A. 选用与欲配制溶液体积相同的容量瓶。 B.使用前必须检查是否漏水。
C.不能在容量瓶内直接溶解。 D.溶解完的溶液等冷却至室温时再转移。 E.定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止。
3.溶液稀释
C(浓溶液)
-
高中数学选修知识点归纳
选修数学知识点1原命题若p则q逆命题若q则p否命题若p则q逆否命题若q则p2四种命题的真假性之间的关系1两个命题互为逆否命题它们有…
-
高二数学选修2-1知识点总结
高二数学上期末复习部分知识点概要20xx15高二数学选修21知识点1命题用语言符号或式子表达的可以判断真假的陈述句真命题判断为真的…
-
高中数学选修1-2知识点总结
知识点总结选修12知识点总结第一章统计案例1线性回归方程变量之间的两类关系函数关系与相关关系制作散点图判断线性相关关系线性回归方程…
-
高中数学选修2-2知识点总结(精华版)
数学选修22知识点总结一导数1函数的平均变化率为fx2fx1fx1xfx1yfxxx2x1x注1其中x是自变量的改变量可正可负可零…
-
高中数学选修1-1知识点总结
高中数学必修五公式第一章三角函数abc2RR为三角形外接圆半径一正弦定理sinAsinBsinCaa2RsinAsinA2Rb推论…
-
高中数学选修2-2知识点总结
导数及其应用一.导数概念的引入数学选修2-2知识点总结1.导数的物理意义:瞬时速率。一般的,函数y?f(x)在x?x0处的瞬时变化…
-
高中数学选修4—4知识点总结
坐标系与参数方程知识点1平面直角坐标系中的坐标伸缩变换xx设点Pxy是平面直角坐标系中的任意一点在变换yy0的作用0下点Pxy对应…
-
高二第二学期理科数学总结(选修2-2,2-3知识点)
第一备课网教案试题课件大全高二第二学期理科数学总结一导数1导数定义fx在点x0处的导数记作yxx0fx0limx0fx0xfx0x…
-
高中数学选修4-4知识点归纳
高中数学选修44知识点总结一选考内容坐标系与参数方程高考考试大纲要求1坐标系理解坐标系的作用了解在平面直角坐标系伸缩变换作用下平面…
-
高中数学人教版选修2-2导数及其应用知识点总结
六安一中东校区高二数学选修22期末复习导数及其应用知识点必记1函数的平均变化率为fx2fx1fx1xfx1yfxxx2x1x注1其…
-
高中数学人教版选修2-2导数及其应用知识点总结
数学选修2-2导数及其应用知识点必记1.函数的平均变化率是什么?答:平均变化率为f(x2)?f(x1)f(x1??x)?f(x1)…