分析化学实验 氢氧化钠溶液浓度的标定 实验报告
实 验 报 告
姓名: 班级: 同组人:
项目 氢氧化钠标准溶液浓度的标定 课程: 分析化学 学号:
一、实验目的
1、学会称量瓶、电子天平、滴定管等常用滴定仪器的准备和使用方法。
2、初步掌握滴定操作。
二、实验原理
标定碱溶液所用的基准物质有多种,本实验中介绍一种常用的。
用酸性基准物邻苯二甲酸氢钾(KHC8H404)在酚酞指示剂存在下标定NaOH标准溶液的浓度.
反应方程式为:
三、仪器和药品
仪器: 台天平(3个)、电子天平(3个)、称量瓶(3个)、称量纸、50mL碱式滴定管(1个)、20 mL移液管(2个)、250mL锥形瓶(3个)
试剂: 0.1%酚酞指示剂、0.lmol/LNaOH标准溶液、邻苯二甲酸氢钾(A.R)
四、内容及步骤
0.1mol/L NaOH标准溶液浓度的标定:
在分析天平上准确称取三份已在105一110°C烘过l小时以上的分析纯的邻苯二甲酸氢钾,每份0.4~0.5g(怎样计算?)放人250mL锥形瓶中,用50mL煮沸后刚刚冷却的蒸馏水使之溶解(如没有完全溶解,可稍微加热),冷却后加人一滴酚酞指示剂,用NaOH标准溶液滴定至呈微红色半分钟内不退,即为终点, 记下NaOH标准溶液的消耗用量(3份测定的平均偏差应小于0.2%,否则应重复测定),计算出NaOH标准溶液的浓度。
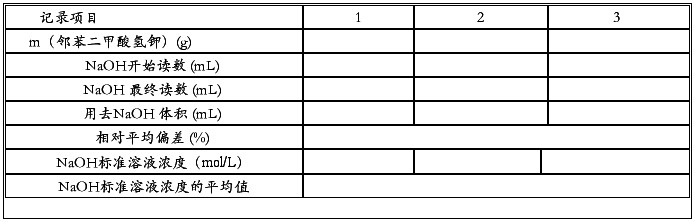
五、实验结果记录与计算
NaOH标准溶液浓度的标定:
六、思考题:
1.计算标定NaOH 溶液时,若均用20mL,所用的标准物质应为多少?
2.称入基准物质的锥形瓶,其内壁是否要预先干燥?为什么?
3、装NaOH溶液的瓶或漓定管不宜用玻塞,为什么?
教师评语:
年 月 日
第二篇:氢氧化钠浓度的标定
实验七:氢氧化钠浓度的标定
一.实验目的
1 练习分析天平的使用方法并掌握减量称量法
2 掌握滴定操作并学会正确判断终点;
3 学会配制和标定碱标准溶液的方法。
二.实验原理:
1、氢氧化钠标准溶液不能准确配制的原因;
NaOH易吸湿,不是基准物质,故不能准确配制NaOH标准溶液,需用邻苯二甲酸氢钾标定,属于强碱滴定弱酸。
2、标定氢氧化钠溶液的工作基准试剂,滴定反应到达化学计量点时溶液的pH值;
工作基准试剂是:邻苯二甲酸氢钾。
C6H4COOHCOOK + NaOH → C6H4COONaCOOK + H2O
计量点时pH=9.0
3、选用何种指示剂,终点时的颜色;
选用酚酞作指示剂,终点是溶液由无色变为淡红色,且0.5min内不退色。
如何选择指示剂?
强碱滴定强酸时,随着NaOH溶液的加入,溶液pH值发生变化,以pH对NaOH的加入量作图得滴定曲线,计量点前后NaOH溶液由不足到过量0.02mL(0.1%);
溶液pH的突然变化称滴定突跃,突跃的pH范围称滴定突跃范围;
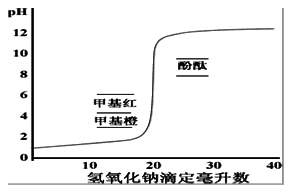
酸碱指示剂、指示剂的变色范围 酸碱指示剂本身是弱酸或弱碱:HIn = H+ + In-,HIn与In-有不同的颜色,pH=pKa(HIn)+lg[In-]/[HIn],当[In-] =[HIn],pH=pKa为理论变色点;[In-]/[HIn]≤ 0.1看到酸色,≥10,看到碱色,变色范围的pH=pKa±1,但实际观测到的与理论计算有差,因人眼对各种颜色的敏感度不同,加上两种颜色互相掩盖,影响观察。如酚酞pKa=9.1,变色pH范围为8.0~9.6。不同的人的观察结果也不同。
指示剂的选择 使指示剂的理论变色点处于滴定突跃范围。
4、计算公式
C(NaOH)= m(KHC8H4O4) = m(KHC8H4O4)
M(KHC8H4O4)V(NaOH) 204.22* V(NaOH)
三.主要仪器与试剂
主要仪器:电子天平,分析天平,250m烧杯(4个),表面皿(4个),滴定管,称量瓶,玻璃棒,干燥器,量筒。
主要试剂:NaOH(S)、邻苯二甲酸氢钾、酚酞
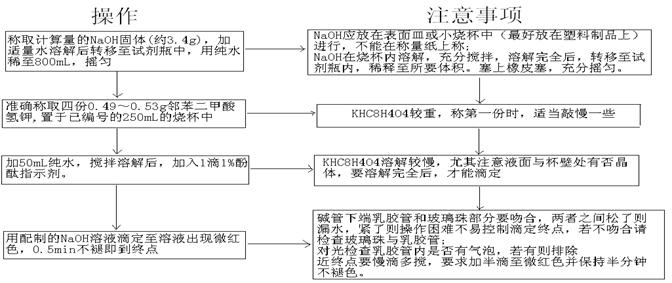
四.操作步骤:
五.实验结果及分析
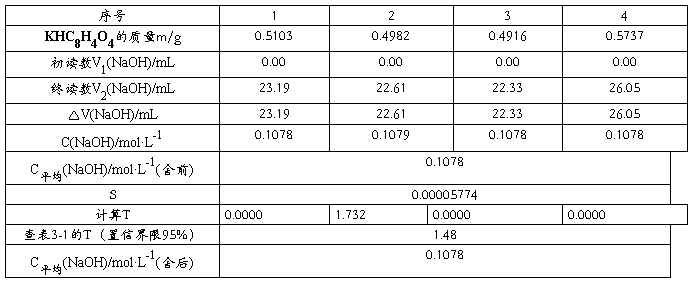
用到的计算公式:
1. C(NaOH)= m(KHC8H4O4) = m(KHC8H4O4)
M(KHC8H4O4)V(NaOH) 204.22* V(NaOH)
2.平均值的计算: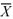 =(X1+X2+X3+……+Xn)/n
=(X1+X2+X3+……+Xn)/n
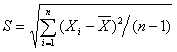 3.标准偏差计算:
3.标准偏差计算:
4:统计量计算式为:Tn=(Xn-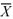 ) / S
) / S
六.问题及思考题
★思考题
1.计算配置500mL 0.1mol·L-1氢氧化钠溶液所需要氢氧化钠固体质量,如何称取固体氢氧化钠?
答:m = 500×10-3×0.1×40 = 2 g
因氢氧化钠有腐蚀性,所以不能在称盘或称量纸上直接称量,需放在已知质量的小烧杯内或表面皿上称量。若用表面皿称量,需先将氢氧化钠固体转移到烧杯中再溶解
2 盛氢氧化钠溶液的试剂瓶应用何种质地的塞子,塞子如何洗净?怎样选择合适的塞子?
答: ①用橡皮塞。因氢氧化钠与玻璃的成分之一SiO2作用会使塞子与瓶口粘结而打不开。橡皮塞耐碱腐蚀,但易被酸侵蚀,它与有机液体、有机蒸气接触容易发生溶胀,引起有机溶剂污染。②橡皮塞在使用前可以用洗涤剂或去污粉刷洗,若仍洗不干净,则将塞子放在6mol·L-1氢氧化钠溶液中加热,小火煮沸一段时间后,再用自来水冲洗干净,纯水荡洗后备用。
塞子的大小要与瓶口大小相匹配。塞子伸入瓶颈部分不得少于塞子本身长度的1/3,也不能多于2/3。
3. 计算标定0.1 mol·L-1的氢氧化钠溶液所需要的邻苯二甲酸氢钾的质量。
答:0.1×25×10-3×204.22 = 0.51g
(假设滴定用的氢氧化钠约25mL)
4.滴定中酚酞的用量对实验结果是否有影响?
答:有影响。指示剂用量太多了,变色不敏锐,而且指示剂本身也是弱酸或弱碱,会消耗一些滴定剂,带来误差。
5.下列操作是的是否正确:
①每次洗涤液从吸管的上端倒出;
②为了加速溶液的流出,用洗耳球把吸管内溶液吹出;
③吸取溶液时,吸管末端伸入溶液太多,转移溶液时,任其临空流下。
答:以上操作均不正确
①从上端到处时,溶液会沾在管口,不便于食指按住管口的移液操作,要是待测液还会带来移液量的误差。
②吸管要是没有“吹”或“快”字,是不能吹的,吸管的容量本来就没有计算管尖的那滴液体的体积,要是吹下,会使移取的液体体积偏大。
③吸管伸入液面下过多,则管外沾附的溶液也多,会使它带到接受溶液的容器中,使移液量增多。
临空流下速度慢,而且容易溅出。
★问题:
1.以酚酞为指示剂标定氢氧化钠溶液时,终点为微红色,0.5 min不褪色,如果经过较长的时间后微红色慢慢褪去,为什么?
答: 在放置的过程中,溶液吸收了空气中的二氧化碳,使pH值降低,红色褪去。
2.草酸(H2C2O4·2H2O)能否用来标定氢氧化钠?
答:工作基准试剂草酸可以标定氢氧化钠溶液。草酸(H2C2O4·2H2O)在相对湿度为5~95%时不会风化而失水,将草酸保存在磨口试剂瓶中即可。草酸固体状态比较稳定,但溶液状态的稳定性较差,空气能使草酸慢慢氧化,光线以及Mn2+的存在能促使其氧化,草酸的水溶液久置能自动分解放出CO2和CO,故草酸溶液不能长期保存
草酸是二元酸,由于两个解离常数值接近,不能分步滴定,只能一步滴定。
七.注意事项与讨论:
除邻苯二甲酸氢钾外,还有工作基准试剂可以标定氢氧化钠溶液吗?
答:工作基准试剂草酸可以标定氢氧化钠溶液。
草酸(H2C2O4·2H2O)在相对湿度为5~95%时不会风化而失水,将草酸保存在磨口试剂瓶中即可。草酸固体状态比较稳定,但溶液状态的稳定性较差,空气能使草酸慢慢氧化,光线以及Mn2+的存在能促使其氧化,草酸的水溶液久置能自动分解放出CO2和CO,故草酸溶液不能长期保存。
草酸是二元酸,由于两个解离常数值接近,不能分步滴定,只能一步滴定。
怎样溶解邻苯二甲酸氢钾?
答:邻苯二甲酸氢钾溶解速度比较慢,还会浮在水面上,尤其是接近液面的杯壁处。因此称好试样回到实验室后,分别在四个烧杯中,洗杯壁后加50mL纯水,放入玻棒,搅拌后,盖好表面皿,然后准备滴定管,使样品有足够的溶解时间。
在滴定前,先检查一号烧杯内试样溶解情况,特别注意接近液面的烧杯壁处,如还有未溶解的试样,则搅拌直至完全溶解,当滴定完第一份试样后,再检查二号烧杯内试样的溶解情况,搅拌全溶后滴定。依次重复至全部滴定好。
在邻苯二甲酸氢钾溶液中,加入1滴酚酞溶液后,为什么局部会出现白色浑浊?
答:酚酞是有机物质,在水中的溶解度小,因此1%酚酞溶液是将1g酚酞溶于100mL90%乙醇中配制成的(严格地讲酚酞的质量浓度应该称为
10g·L-1)。当1滴酚酞乙醇溶液加到水溶液中后,酚酞由于溶解度降低而析出,局部出现白色浑浊,一经搅拌,酚酞又分散到溶液中溶解,白色浑浊消失。
洗涤碱管时,为什么要将乳胶管连同细嘴玻璃管取下?
答:因乳胶管内有玻璃珠,两者结合起旋塞的作用,阻止溶液流出,因此取下乳胶管,可减少滴定管刷刷洗时的阻力。
为什么终点的微红色在30s后会褪去?
答:在放置的过程中,溶液吸收了空气中的二氧化碳,使pH值降低,红色褪去。
带进天平室的物品:
4个250mL烧杯编号盖上表面皿(不放玻棒);干燥器;称量瓶与纸带(放干燥器内);记录笔、实验报告本。
减量法称量的要点?
Ø 称出称量瓶质量,按去皮键TAR,倾倒试样后称量,所示质量是“—”号;
Ø 再按去皮键称取第二份试样;
Ø 本实验连续称取四份试样。
Ø 注意事项(减量法称量的注意点)
Ø 盛有试样的称量瓶除放天平盘、干净的纸或表面皿上,或用纸带拿在手中外,不得放其它地方(为什么);
Ø 纸带放洁净、干燥的地方;请保存好以便以后再用;
Ø 取出或套上纸带时,不要碰到称量瓶口
Ø 要在承接容器的上方打开(或盖上)瓶盖,以免使粘附在瓶口、瓶盖上的试样失落在容器外,粘在瓶口的试样应尽量敲入烧杯或称量瓶内;
Ø 若倒入试样量不够时可重复再倒,但要求2~3次内倒至规定量(为什么)。如倒入量大大超过,弃去,洗净烧杯后重称。
怎样溶解试样?
答:⑴取下表面皿,用洗瓶吹洗烧杯壁,将杯壁上可能有的粉末试样洗至杯底,放入玻棒。
⑵用量筒取50mL纯水,沿玻棒(玻棒下端要靠杯壁)或沿杯壁缓缓加入到烧杯中。现烧杯上均有容量刻度,但体积数不准,不要使用。
⑶用玻棒不断搅拌使所有的固体溶解,但不碰杯壁以免发出响声。注意已放入的玻棒不能离开烧杯,更不能放在烧杯以外的地方,以免烧杯中的试样损失。
注意事项
Ø 量筒量取纯水,沿杯壁加入,或玻棒引入,玻棒下端紧靠杯壁;每只烧杯内放一根玻棒,放入后不再取出;
Ø 搅拌时不碰杯壁以免发出响声;
Ø 试样完全溶解后再滴定,重做时更要做到此点。
滴定过程中,如何控制好滴定的速度?
Ø 答: ⑴滴定开始时,可快。由于离终点远,滴落点颜色无明显变化,此时的滴定速度为10mL/min,即每秒3~4滴,呈“见滴成线”,但不能成“水线”,以免溶液溅出。
⑵滴落点颜色有变化或消失慢时,滴定放慢。随着终点的接近,改为滴1滴搅几下(一滴多搅),或控制滴加速度为加1滴,经搅拌后溶液颜色稳定,下1滴正好滴下。
⑶近终点 :先洗玻棒、杯壁,微移旋塞,使溶液悬在下口形成半滴,用玻棒下端靠下(注意玻棒只能接触液滴,不要接触管尖),快速搅动溶液。
为什么近终点时要洗杯壁,洗涤水的量要不要控制?
答: ⑴滴定过程中,可能有溶液溅在杯壁,因此近终点时要洗杯壁。
⑵只能用少量水洗杯壁。在盐酸标准溶液的标定中,变色点pH=3.9,因纯水pH=6,多加洗涤水,会多消耗盐酸,从而引进误差。因此终点时加少量纯水,对终点没有影响;加多了不行。
▲示教:
碱式滴定管的使用,着重讲解:
洗涤;乳胶管和玻璃珠部分的配合; 挤压方法、部位;
乳胶管内和末端玻璃管内气泡的排除
◆标定四份即通过的同学,再标定二份HAc溶液的浓度。
-
现代实验分析报告
水泥中MgOCaOAl2O3Fe2O3含量的测定一实验目的1学习复杂物质分析的方法2掌握尿素均匀沉淀法二实验原理本实验采用硅酸盐水…
-
实验结果分析报告
1亚硝酸钠测定结果标准液质量与吸光度表亚硝酸钠标准液质量000123457510125吸光度0002600430068005701…
-
实验报告 范本
研究生实验报告范本实验课程实验名称实验地点学生姓名学号指导教师范本实验时间年月日一实验目的熟悉电阻型气体传感器结构及工作原理进行基…
-
程序分析实验报告
程序分析第二次实验报告13091372代树理开发环境语言java编译器myeclipse操作系统windowsXP另外使用的ANT…
-
实验报告(相关分析)
经济分析方法与手段实验分析报告附件一1陶瓷产量与城镇住宅建筑面积的相关分析散点图2与新增医疗卫生机构面积的关系3与新增办公楼面积的…
-
哈工大数值分析上机实验报告 20xx年
实验报告一题目Gauss列主元消去法摘要求解线性方程组的方法很多主要分为直接法和间接法本实验运用直接法的Guass消去法并采用选主…
- 数值分析实验报告1
-
西安交大编译原理语法分析器实验报告
编译原理课内实验报告学生姓名石磊专业班级计算机26学号2120xx5140所在学院电信学院提交日期20xx122一实验目的1强化对…
-
数据分析实验报告
数据分析课程实验报告学院理学院专业信息与计算科学班级姓名学号一实验题目所做实验属于哪一部分的内容例如一元线形回归及其在SPSS中的…
-
实验15 光亮镀锌及化学镀镍实验报告
光亮镀锌及化学镀镍1实验目的11学习和实践氯化钾光亮镀锌的实验室基本操作流程了解电镀的基本原理和工艺12学习并掌握化学镀镍的原理及…
-
无机与分析化学实验总结
无机与分析化学实验总结一个学期的化学实验了,通过十几个化学实验,我收获很多。我最喜欢做的是结晶的试验,看着从溶液中析出的各种形状的…