20xx届高三化学选修三第二章分子结构与性质第三节分子的性质能力达标练习题
一、选择题
1、以碳原子为中心与两个氯原子及两个碘原子相结合形成CCl2I2分子,以下判断正确的是
A.CCl2I2分子是非极性分子 B.CCl2I2分子含有π键 C.CCl2I2分子是手性分子 D.CCl2I2的沸点高于CCl4 2、水晶的主要成分为氧化物,该氧化物为
A.A12O3 B. CuO C.Fe2O3 D. SiO2
3、下列化合物按其晶体的熔点由高到低排列正确的是( ) A.SiO2 CsCl CBr4 CF4 B.SiO2 CsCl CF4 CBr4 C.CsCl SiO2 CBr4 CF4 D.CF4 CBr4 CsCl SiO2
4、已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是


A.G是最活泼的非金属单质 B.L的稳定性小于E
C.E能使紫色石蕊试液变蓝色 D.M化学性质比较稳定
5、下列物质的晶体属于分子晶体的是
A. Si CO2
B.
1
C. NaCl D. Cu
6、下列各组分子中,都属于含有极性键的非极性分子的一组是( )
A.CO2、H2O B.C2H4、CH4 C.Cl2、C2H2 D.NH3、HCl
7、下列各组中的分子,全部是以极性键形成非极性分子的是
A.H2、N2、Cl2 B.CH4、NH3、H2O
C.HCl、NO、Br2 D.CO2、CS2、CCl4
8、氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,
有关叙述正确的是:
A.氯化硼液态时能导电而固态时不导电
B.氯化硼加到水中使溶液的pH升高
C.氯化硼遇水蒸气会产生白烟
D.氯化硼分子呈正三角形,属非极性分子
9、在乙烯分子(C2H4)中既有σ键又有π键,它们分别是:
A.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
B.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
C.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 10、
下列推断正确的是:
A.BF3是三角锥形分子
B.右图中两个分子的关系是手性分子
2
C.苯分子中C原子均是sp2杂化,每个碳原子有1个参与杂化的2p轨道,共有6个原子共面
D. CH4分子的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成
4个C-H σ键
11、下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间构型也为四面体形的是:
A.PH3 B.OF2 C.
H3O+ D.NH4+ 12、下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是: ①H2O ②NH3 ③F- ④CN- ⑤CO
A.①② B.①②③④⑤
C.①②③ D.①②④
二、非选择题
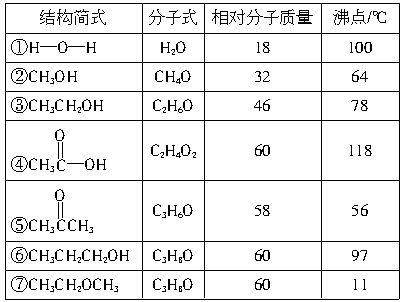
13、自然界中往往存在许多有趣也十分有意义的现象,下表列出了若干化合物的结构简式、分子式、相对分子质量和沸点,从它们的沸点看,可以说明哪些问题?
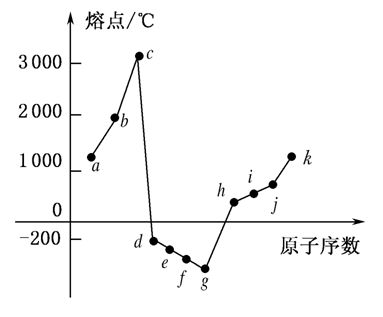
14、在1~18号元素中,部分连续元素单质的熔点情况如下图所示,试回答: 3
(1)c点代表的单质可以是________,其熔点高的主要原因是____________________________。
(2)d所属的晶体类型是________。
15、以下6种物质中选取序号填空(仅填序号,可重复选填)。
①二氧化碳 ②硫化氢 ③氯化铵
④氢氧化钾 ⑤甲醛 ⑥乙醇
(1)含有非极性键的是________;
(2)含有配位键的是________;
(3)既含有σ键又含有π键的是________;
(4)分子的立体结构呈平面三角形的是________;
(5)属于非极性分子的是________;
(6)属于离子化合物的是________。
16、氮可以形成多种离子,如N3-、NH2-、N3-、NH4+、N2H5+、N2H6+等。已知N2H5+的形成过程类似于NH4+的形成过程,N2H5+在碱性溶液中将生成电中性的分子和
水。试写出:
(1)该电中性分子的化学式: ;
4
(2)N2H5+的电子式: ;
(3)1 mol N3-共有 mol 电子;
(4)写出两种非金属氧化物跟N3-电子数相同的物质的化学
式 、 。
17、A、B、C、D、E五种元素的原子序数依次增大,且均小于18;A原子的最外
层比B原子的最外层少2个电子,A原子的最外层电子数是次外层电子数的两倍;A、B、C三种元素能结合成化合物C2AB3,1molC2AB3中共有52mol电子;
D元素的单质0.5mol与酸全部反应时,有9.03×1023个电子转移,在B与D组成的化合物中D的质量分数为52.94%,D原子核内有14个中子;每个E原子与氢原子化合时只生成一个共价单键。
试填写下列空白:
(1)写出这五种元素的元素符号:A____________,B_________,C_________,D__________,E_________。
(2)A与B组成的最高价化合物属于__________分子(填“极性”或“非极性”)。
(3)C在B中燃烧生成的化合物中含有的化学键有_______键和_______键(填“离子”、“极性”或“非极性”)。
(4)A、B、C结合组成的化合物的化学式是______。
参考答案
1、D
2、D
3、A [物质熔点的高低与晶体的类型有关,一般来说:原子晶体>离子晶体>分子晶体,即SiO2>CsCl>CBr4、CF4。当晶体的类型相同时,原子晶体与原子半径有关;离子晶体与离子的半径和离子所带的电荷数有关;分子晶体当组成和结构 5
相似时,与相对分子质量的大小有关,一般来说,相对分子质量大的熔点高,即CBr4>CF4。]
4、B
5、B
6、B
7、D
8、D
9、C
10、D
11、D
12、B
13、①、②、③、④、⑥化合物分子间都有氢键,所以其沸点较⑤、⑦高;②、
③、⑥为同系物,相对分子质量越大,沸点越高;④、⑥、⑦化合物的相对分子质量相同,因④能形成双分子
⑦无氢键,沸点低于⑥。
【试题分析】 ,所以沸点较高,
对于本题,我们除了要考虑同系物的沸点的比较,以及相对分子质量相同的有机物沸点的比较外,还要考虑氢键。综合考虑不难得出答案。
14、解析 由图分析c点的熔点在3 000 ℃以上,而相邻的d点的熔点很低,可推知c元素为碳元素,其单质可能为原子晶体或混合型晶体。由此可知a-k依次为Be、B、C、N2、O2、F2、Ne、Na、Mg、Al、Si。c单质为金刚石,也可能
是石墨(混合型晶体),金刚石是原子晶体,碳碳键键能很大,熔点很高(石墨是混合型晶体,但在每层内,碳与碳以极强的共价键相结合,故熔点很高)。而d单质熔点为0 ℃,常温下为气体,是非金属单质,因此是分子晶体。
答案 (1)金刚石或石墨 金刚石是原子晶体,晶体中存在C—C共价键,键能很大,因此熔点很高,石墨为混合型晶体,同一层内存在C—C共价键,共价键键能比金刚石中C—C的键能还大,熔点比金刚石还要高
6
(2)分子晶体
15、 (1)⑥
(2)③
(3)①⑤
(4)⑤
(5)①
(6)③④
16、(1)化学式: N2H4 ;式:
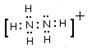
;
(3)有 22 mol 电子; 式 CO2 、 N2O 。 17、(1)C;O;Na;Al;Cl
(2)非极性
(3)离子;非极性
(4)Na2CO3
2)(4)子化学7 (电
8
-
化学选修四第二章知识点归纳
第二章化学反应速率和化学平衡一化学反应速率1化学反应速率v定义用来衡量化学反应的快慢单位时间内反应物或生成物的物质的量的变化表示方…
-
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡
第二章化学反应速率和化学平衡一化学反应速率课标要求1掌握化学反应速率的含义及其计算2了解测定化学反应速率的实验方法要点精讲1化学反…
-
高中化学选修4知识点归纳总结
高中化学选修4知识点归纳总结第一章化学反应与能量一焓变反应热1反应热一定条件下一定物质的量的反应物之间完全反应所放出或吸收的热量2…
-
选修4第二章《化学反应速率和化学平衡》知识点归纳
第二章化学反应速率和化学平衡一化学反应速率1化学反应速率v定义用来衡量化学反应的快慢单位时间内反应物或生成物的物质的量的变化表示方…
-
人教版高中化学选修4第二章《化学反应速率和化学平衡》知识点归纳
第二章化学反应速率和化学平衡一化学反应速率1化学反应速率v定义用来衡量化学反应的快慢单位时间内反应物或生成物的物质的量的变化表示方…
-
农行职工第三季度工作总结
个人工作述职转眼间20xx年第三季度的工作即将结束了,为了更好的完成今后的各项工作,现将前一阶段的工作做一下简要的总结与回顾,如有…
-
农行PL分行20xx前三季度工作总结
农行PL分行20xx前三季度工作总结前三季度农行认真贯彻上级行的工作会议精神和总体工作部署紧紧抓住总行46112战略带来的大好机遇…
-
某某支行关于安全保卫“三化三达标”工作验收的申报
某某支行关于安全保卫三化三达标工作验收的申报某某分行根据某某发20xxXXX号文件精神我行深入贯彻省市分行围绕中心强化管理忠诚履职…
-
江西万载20xx届高三化学必修二第一章物质结构元素周期律第三节化学键能力达标练习题
一选择题1下列叙述正确的是A酸性氧化物和碱性氧化物都是电解质B将NaOH溶液逐滴加入FeCl3溶液可制备FeOH3胶体C电化学腐蚀…
-
20xx届高三化学选修三第一章物质的结构与性质第二节原子结构与元素的性质能力达标练习题
一选择题1X和Y两元素的阳离子具有相同的电子层结构X元素的阳离子半径大于Y元素的阳离子半径Y与Z两元素的原子核外电子层数相同Z元素…
-
初三化学上学期教学工作总结
20xx-20xx学年度第一学期初三化学教学工作总结今年我担任初三的化学教学工作,化学是初三新开的学科,是学生跨入化学科学殿堂的启…