20xx届高三化学选修三第一章物质的结构与性质第二节原子结构与元素的性质能力达标练习题
一、选择题
1、X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Y与Z两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径,X、Y、Z元素原子序数的关系是( )
A.X>Y>Z B.Y>X>Z
C.Z>X>Y D.Z>Y>X
2、下列各项中表达正确的是( )
A.F-的结构示意图:
B.H2O分子的球棍模型:

3、下列叙述不正确的是( )
A.原子核外每层最多容纳的电子数为2n2个(n为电子层)
B.同一原子核外的M层上的电子数一定比L层上的电子数多
C.如果原子只有一个电子层,该原子的质子数不超过2个
D.1~18号元素,每层电子数都满足2n2个电子的元素只有2种
4、
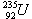
是重要的工业原料,铀浓缩一直为国际社会关注。下列有关的说法正确的是
A.原子核中含有92个中子 B 原子核外有143个电子
C.与互为同位素 D 与为同一核素 1
5、下列原子结构模型与科学家对应不正确的一项是
A.阿伏加德罗的原子学说
B.汤姆生的“葡萄干面包式”原子结构模型
C.卢瑟福的带核原子结构模型
D.玻尔的核外电子在一定轨道上运动的观点
6、下列表达方式错误的是 ( )
A.
式
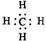
B.甲烷的电子
C.硫离子的核外电子排布式 1s22s22p63s23p6 D.碳-12原子构成
C
7、下列有关化学用语表示不正确的是 ( )
A.P原子的结构示意图:
B.NaCl的电子式为:
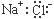
C.HCN分子的结构式:H—C≡N
D.含78个中子的碘的放射性核素:
8、230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
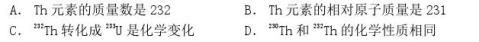
2
9、19xx年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是( )
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
10、科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氮原子构成的分子。下列有关这两种粒子的说法不正确的是
A.“四中子” 粒子不显电性
B.被称为零号元素是因为该粒子不含质子
C.相同质量的N2和N4所含原子个数比为1∶2
D.第二种粒子的化学式为N4,与N2互为同素异形体
11、下列有关化学用语表示不正确的是( )
A.氧的原子结构示意图:
B.Na2O2的电子式:Na+2-Na+
C.HClO的结构式:H—O—Cl
D.中子数为16的硫离子: S2-
12、不具有放射性的同位素称之为稳定同位素,稳定同位素分析法近20年来在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,213151834H、C、N、O、S等常用作环境分析指示物。下列有关说法正确的是( )
A.34S原子核内中子数为16
B.1HO和1HO的相对分子质量不同
3
C.13C和15N原子核内的质子数相差2
D.2H+结合OH-的能力比1H+的更强
二、非选择题
13、阅读下面一段文字,回答有关问题:
中国科学院近代物理研究所利用重离子加速器提供的丰中子束氧-18轰击天然铀靶,使用奇异的多核子转移反应,在“可裂变核区”合成了重质量丰中子新核素镤-239,这在世界上尚属首次。镤-239是中科院近代物理研究所在质量数大于170的重质量丰中子区合成的第四个新核素。这一成果填补了核素图上又一个空白,为重质量丰中子区的核结构和天文物理研究提供了很有价值的信息。
(1)氧-18原子中质子数是 ,中子数是 ,核外电子数是 ,有 个电子层,最外层有 个电子,最常见化合价为 。
(2)0.2mol氧-18原子的质量是 。
(3)铀元素有 种核素,其中 是制造原子弹的原料。
(4)在“镤-239是中科院近代物理研究所在质量数大于170的重质量丰中子区合成的第四个新核素”这句话中,质量数的含义是 ,核素的含义是 。
14、有V、W、X、Y、Z 五种元素,它们的核电荷数依次增大,且都小于20,其中X、Z 是金属元素;V和Z元素原子的最外层都只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此推知(填元素符号),V ,W ,X ,Y ,Z 。由这些元素组成的一种结晶水合物的化学式为 , 俗称 。
15、A+、B、C+、D 和Q、R六种微粒,它们都含有氢原子,且微粒中都含有10个电子;A+和B在加热时反应生成Q气体和R液体;R在常温下发生很弱电离生成C+ 和B;Q在低温液态时有极微弱电离生成A+和D。
(1)写出A+、B的化学式:A+ B
(2)写出A+和B加热反应的离子方程式
4
(3)写出Q在低温液态时电离的方程式
16、用A2+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是 、B元素是 、C元素是 (用元素符号表示)
(2)D是由两种元素组成的双原子分子,其分子式是
(3)E是所以含有18电子的微粒中氧化能力最强的分子,其分子式是
(4)F是由两种元素组成的三原子分子,其分子式是 电子式是
(5)G分子中含有4个原子,其分子式是
(6)H分子中含有8个原子,其分子式是
17、有几种元素的微粒的最外电子层结构如右图所示:
(1)若该微粒呈电中性,这种微粒的符号是____。
(2)若该微粒的盐溶液能使溴水退色,并出现浑浊,这种微粒的符号是_______。
(3)若该微粒的氧化性甚弱,但得到电子后变为原子,原子的还原性很强,这种微粒的符号是______。
(4)若该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是______。
参考答案
1、解析 分析题意可知,X、Y、Z在同一周期,从左至右的位置为X、Y、Z。 答案 D
2、解析 H2O分子的空间构型为折线形;NaCl的电子式为Na+-;C2H2的结构式
为HCCH。
答案 A
5
3、解析 当M为最外层时可能的电子数为1~8,而此时的L层电子数为8个,B项不正确。
答案 B
4、C
5、A
6、B
7、B
8、考点:
核素;质量数与质子数、中子数之间的相互关系.
专题:
原子组成与结构专题.
分析:
A.Th元素有2种核素;
B.元素的相对原子质量,是按各种天然同位素原子所占的一定百分比算出来的平均值;
C.化学变化的最小微粒是原子;
D.同位素的化学性质几乎相同.
解答:
解:A.Th元素有2种核素,230Th和232Th的质量数分别是230,232,故A错误;
B.不知道各种天然同位素的含量无法求出,故B错误;
C.化学变化是生成新物质的变化,原子不变,而c项的原子发生变化,故C错误;
D.同位素的物理性质可以不同,但化学性质几乎相同,故D正确.
故选D.
点评:
6
本题考查核素、同位素的性质,难度中等,注意元素的相对原子质量是按各种天然同位素原子所占的一定百分比算出来的平均值.
9、A
10、C
11、解析 氧的原子结构示意图应为
答案
A ,A错。
12、答案 B
解析 34S中子数为18,A项错;1HO相对分子质量为18,1HO相对分子质量为20,B项正确;13C和15N核内质子数分别为6和7,相差1,C项错;2H+和1+H化学性质相同,D项错。
13、答案:(1)8,10,8,2,6,-2;(2)3.6g;(3)3,铀-235;(4)原子中质子数和中子数之和,具有确定数目质子和确定数目中子的一种原子。
解析:原子中质子数和中子数之和称为质量数,原子的相对原子质量近似等于该原子的质量数;具有一定数目质子和一定数目中子的一种原子称为核素。氧-18是指具有8个质子和10个中子、质量数为18的氧原子。铀元素有铀-234、铀-235、铀-238三种核素,其中铀-235是制造原子弹的原料和核反应堆的燃料。
14、H O Al S K KAl(SO4)2?12H2O 明矾
15、 ⑴NH4+ OH ⑵ NH4+ + OH
⑶2 NH3
NH3↑+H2O NH4+ + NH2 7
16、⑴Ca Cl S ⑵HCl ⑶F2 ⑷H2S

⑸PH3 ⑹CH3CH3 17、(1)Ar
(2)S2-
(3)K+
(4)Cl-
8
9
-
【强烈推荐】高一化学必修一第一章总结
第一章从实验学化学一、常见物质的分离、提纯和鉴别1.常用的物理方法——根据物质的物理性质上差异来分离。混合物的物理分离方法i、蒸发…
-
高一化学必修一知识点总结
新课标化学必修一1学习方法2研究一种物质的性质的程序3观察法4金属钠的物理性质5金属与水的反应第三章金属及其化合物1金属的化学性质…
-
高一化学必修一第一章知识总结
高一化学必修一第一章知识总结11化学实验基本方法111化学实验安全A常见危险化学品爆炸品KClO3KMnO4KNO3易燃气体H2C…
-
高一化学必修一第一章总结
平凡的人听从命运只有强者才是自己的主宰1平凡的人听从命运只有强者才是自己的主宰2平凡的人听从命运只有强者才是自己的主宰3平凡的人听…
-
高中化学鲁科版必修一第一章总结
化学第一章章末总结现象钠浮在水面上密度比水小熔化为银白色小球反应放热熔点低在水面上四处游动反应放出气体伴有嘶嘶响声气体与水摩擦滴有…
-
农行职工第三季度工作总结
个人工作述职转眼间20xx年第三季度的工作即将结束了,为了更好的完成今后的各项工作,现将前一阶段的工作做一下简要的总结与回顾,如有…
-
农行PL分行20xx前三季度工作总结
农行PL分行20xx前三季度工作总结前三季度农行认真贯彻上级行的工作会议精神和总体工作部署紧紧抓住总行46112战略带来的大好机遇…
-
某某支行关于安全保卫“三化三达标”工作验收的申报
某某支行关于安全保卫三化三达标工作验收的申报某某分行根据某某发20xxXXX号文件精神我行深入贯彻省市分行围绕中心强化管理忠诚履职…
-
20xx届高三化学选修三第二章分子结构与性质第三节分子的性质能力达标练习题
一选择题1以碳原子为中心与两个氯原子及两个碘原子相结合形成CCl2I2分子以下判断正确的是ACCl2I2分子是非极性分子BCCl2…
-
江西万载20xx届高三化学必修二第一章物质结构元素周期律第三节化学键能力达标练习题
一选择题1下列叙述正确的是A酸性氧化物和碱性氧化物都是电解质B将NaOH溶液逐滴加入FeCl3溶液可制备FeOH3胶体C电化学腐蚀…