医疗器械风险管理报告(20xx)
风险管理报告
编制人:
批准人:
批准日期:
目 录
第一章 综 述....................................................................................................................... 1
第二章 风险管理评审输入................................................................................................ 5
第三章 风险管理评审........................................................................................................ 7
第四章 风险管理评审结论................................................................................................ 8
附件1..................................................................................................................................... 9
附件2................................................................................................................................... 11
附件3................................................................................................................................... 12
附件4................................................................................................................................... 15
第一章综述
1、产品简介
各原材料均按企业标准YZB/国 0195—2007和相关标准GB 18457—2001 制造医疗器械用不锈钢针管、GB 15811—2001 一次性使用无菌注射针、YY/T 0243—2003 一次性使用无菌注射器用活塞、YY/T 0242—2007 医用输液、输血、注射器用聚丙烯专用料等检验合格后投入使用。产品和各组配件均按YY/T0287:2003idtISO13485:2003和《一次性使用无菌医疗器械产品(注、输器具)生产实施细则(20##年修订)》的规定在符合YY0033:2000《无菌医疗器具生产管理规范》规定的10万级洁净区内生产。
产品外形图如下:
2、风险管理计划和实施情况简述
于20##年开始策划立项。立项的同时。我们针对该产品进行了风险管理活动的策划,制定了风险管理计划。
该风险管理计划确定了的风险可接受准则,对产品设计开发阶段(包括试生产阶段)的风险管理活动、风险管理活动有关人员的职责和权限以及生产和生产后信息的获得方法的评审要求进行了安排。
公司组成了风险管理小组,确定了该项目的风险管理负责人。确保该项目的风险管理活动按照风险管理计划有效的执行。
在产品的设计和项目开发阶段,风险管理小组共进行了一次风险管理评审,形成了相关的风险管理文档。
3、此次风险管理评审目的
本次风险管理的评审目的是通过对产品在上市前各阶段风险管理活动进行总体评价,确保风险管理计划已经圆满地完成,并且通过对该产品的风险分析、风险评价和风险控制,以及综合剩余风险的可接受性评价,和对生产和生产后信息获得方法的评审,证实对产品的风险已进行了有效管理,并且控制在可接受范围内。
4、风险管理评审小组成员及其职责

第二章风险管理评审输入
1、风险可接受准则
风险管理小组对公司《风险管理控制程序》中制定的风险评价/风险可接受准则进行了评价,认为一在风险管理活动中所依据的风险可接受准则仍保持原有的标准。
1.1 损害的严重度水平

1.2 损害发生的概率等级

1.3 风险评价准则

说明:A:可接受的风险;
R:合理可行降低(ALARP)的风险;
U:不经过风险/收益分析即判定为不可接受的风险。
2、风险管理文档
1)风险管理计划;
2)安全性特征问题清单及可能危害分析表;
3)初始危害判断及初始风险控制措施表;
4)风险评价、风险控制措施的实施和验证以及剩余风险评价记录。
3、相关文件和记录
3.1 风险管理控制程序 文件编号: 版本号:B
3.2 产品设计开发文档(主要包括设计图纸、工艺、DFMEA、PFMEA)
3.3 相关法规:《医疗器械注册管理办法》
3.4 相关标准 :GB 9706.1︰2007 医用电器设备 第1部分 安全通用要求
YY/T 0316︰2008 医疗器械 风险管理对医疗器械的要求
第三章 风险管理评审
1、风险管理计划完成情况
评审小组对风险管理计划的完成情况逐一进行了检查,通过对相关风险管理文档的检查,认为风险管理计划已基本实施。见《风险管理文档》。
2、综合剩余风险可接受评审
评审小组对所有剩余风险进行了综合分析,考虑所有单个剩余风险共同影响下的作用,评审结果认为:产品综合剩余风险可接受,以下为具体评价方面:
1)单个风险的风险控制是否有相互矛盾的要求?
结论:尚未发现现有风险控制有相互矛盾的情况。
2)警告的评审(包括警告是否过多?)
结论:警告的提示清晰,符合规范。
3)说明书的评审(包括是否有矛盾的地方,是否难以遵守)
结论:产品说明书符合 10 号令及产品专用安全标准要求,相关产品安全方面的描述清晰易懂,易于使用者阅读。
4)和类似产品进行比较
结论:
5)评审小组结论
结论:风险管理评审小组在分析了以上方面后,一致评价,本产品的综合剩余风险可接受。
3、关于生产和生产后信息
生产和生产后信息获取方法参见《质量信息反馈控制程序》(文件编号: 版本号:B),评审组对《质量信息反馈控制程序》中的生产和生产后信息获取方式的适宜性和有效性进行了评价,认为: 该方法是适宜和有效的,一生产和生产后信息的获取可按照《质量信息反馈控制程序》的要求获得,该项目风险管理负责人对得到的生产和生产后信息进行管理,必要时,风险管理小组开展活动实施动态风险管理。由于本产品尚未正式生产,一旦正式生产,将对生产中的各类风险情况进行收集,并再次进行分析、评价、控制,更新风险管理报告内容。
4、评审通过的风险管理文档
《安全特征问题清单及可能的危害》(见附件1),该附件为产品设计开发之除对产品的预期用途和与安全性有关的特性以及可能危害的分析的记录。
《初始危害判定和初始风险控制措施》(见附件2),该附件是对正常和故障状态下的合理可预见的危害事件序列及其可能引起的危害处境、可能的损害和采取初步控制措施的记录。
《风险评价、风险控制措施及剩余风险评价记录表》(见附件3),该附件是对风险评价、风险控制措施的实施、验证及其剩余风险评价的记录。
第四章 风险管理评审结论
风险管理评审小组经过对试生产的产品的评审,以及以检查风险管理文档的方式对风险管理过程的评审,认为:
- 风险管理计划已被适当地实施;
- 综合剩余风险是可接受的;
- 已有适当方法获得相关生产和生产后信息;
-全部剩余风险处于风险可接受准则的可接受范围内,且受益超过风险。
同意批准申报注册。
签 名:
日 期:
附 录 1
安全特征问题清单及可能的危害,该清单依据 YY/T0316-2008 标准附录C 的问题清单和附录E.1危害示例,补充了有关产品的特有的安全性问题。

附 录2
初始危害分析(PHA),包括可预见的事件序列、危害处境和可发生的损害以及采取的初步控制措施。

附 录3
1.风险评价、风险控制措施及剩余风险评价记录表

2.设计开发过程中,运用FMEA、PFMEA,对于与产品安全性相关的失效模式,按风险管理流程,进行风险分析、风险评价和风险控制,
制造过程中的FMEA 举例
工艺流程图如下: # # * *
合格供方评定→原材料进货检验→注塑→印刷→组装→单包装(吸塑包装)→大包装→灭菌→解析入库
↑
粘针
注:#为关键工序,*为特殊工序

第二篇:风险管理报告YYT 0316-20xx 模板
风险管理报告
产品名称
文件编号:
批准人:
批准日期:
公司名称
目 录
第一章 综 述.... 1
第二章 风险管理评审输入.... 7
第三章 风险管理评审.... 9
第四章 风险管理评审结论.... 11
附件1. 12
附件2. 15
附件3. 17
第一章综述
1、产品简介
1.1、工作原理
1.2、产品功能
1.3、产品组成
1.4、技术参数
2、风险管理计划和实施情况简述
于 开始策划立项。立项的同时。我们针对该产品进行了风险管理活动的策划,制定了风险管理计划。
该风险管理计划确定了的风险可接受准则,对产品设计开发阶段(包括试生产阶段)的风险管理活动、风险管理活动有关人员的职责和权限以及生产和生产后信息的获得方法的评审要求进行了安排。
公司组成了风险管理小组,确定了该项目的风险管理负责人。确保该项目的风险管理活动按照风险管理计划有效的执行。
在产品的设计和项目开发阶段,风险管理小组共进行了一次风险管理评审,形成了相关的风险管理文档。
3、此次风险管理评审目的
本次风险管理的评审目的是通过对产品在上市前各阶段风险管理活动进行总体评价,确保风险管理计划已经圆满地完成,并且通过对该产品的风险分析、风险评价和风险控制,以及综合剩余风险的可接受性评价,和对生产和生产后信息获得方法的评审,证实对产品的风险已进行了有效管理,并且控制在可接受范围内。
4、风险管理评审小组成员及其职责

第二章风险管理评审输入
1、风险可接受准则
风险管理小组对公司《风险管理控制程序》中制定的风险评价/风险可接受准则进行了评价,认为一在风险管理活动中所依据的风险可接受准则仍保持原有的标准。
1.1 损害的严重度水平

1.2 损害发生的概率等级

1.3 风险评价准则

说明:A:可接受的风险;
R:合理可行降低(ALARP)的风险;
U:不经过风险/收益分析即判定为不可接受的风险。
2、风险管理文档
1)风险管理计划;
2)安全性特征问题清单及可能危害分析表;
3)初始危害判断及初始风险控制措施表;
4)风险评价、风险控制措施的实施和验证以及剩余风险评价记录。
3、相关文件和记录
3.1 风险管理控制程序 质量手册 附录二
3.2 产品设计开发文档(主要包括设计图纸、工艺、DFMEA、PFMEA)
3.3 相关法规:《医疗器械注册管理办法》
3.4 相关标准 :
产品标准
GB 4793.1-2007 医用电器设备 第1部分 安全通用要求
YY/T 0316-2008 医疗器械 风险管理对医疗器械的要求
第三章 风险管理评审
1、风险管理计划完成情况
评审小组对风险管理计划的完成情况逐一进行了检查,通过对相关风险管理文档的检查,认为风险管理计划已基本实施。见《风险管理文档》。
2、综合剩余风险可接受评审
评审小组对所有剩余风险进行了综合分析,考虑所有单个剩余风险共同影响下的作用,评审结果认为:产品综合剩余风险可接受,以下为具体评价方面:
1)单个风险的风险控制是否有相互矛盾的要求?
结论:尚未发现现有风险控制有相互矛盾的情况。
2)警告的评审(包括警告是否过多?)
结论:警告的提示清晰,符合规范。
3)说明书的评审(包括是否有矛盾的地方,是否难以遵守)
结论:产品说明书符合 10 号令及产品专用安全标准要求,相关产品安全方面的描述清晰易懂,易于使用者阅读。
4)和类似产品进行比较
结论:通过与山东新华公司压力蒸汽灭菌器、瑞典洁定蒸汽灭菌器进行性能、功能比较分析,认为产品与目前市场上反映较好的这两款机型从性能指标到功能及临床使用上是相同的。
5)评审小组结论
结论:风险管理评审小组在分析了以上方面后,一致评价,本产品的综合剩余风险可接受。
3、关于生产和生产后信息
3.1 生产和生产后的风险管理
公司建立收集和评审医疗器械信息的系统时,尤其应当考虑:
生产和生产后信息获取方法参见质量手册,改进控制程序,评审组对改进控制程序中的生产和生产后信息获取方式的适宜性和有效性进行了评价,认为: 该方法是适宜和有效的,生产和生产后信息的获取可按照改进控制程序的要求获得,该项目风险管理负责人对得到的生产和生产后信息进行管理,必要时,风险管理小组开展活动实施动态风险管理。由于本产品尚未正式生产,一旦正式生产,将对生产中的各类风险情况进行收集,并再次进行分析、评价、控制,更新风险管理报告内容。
4、评审通过的风险管理文档
《安全特征问题清单及可能的危害》(见附件1),该附件为产品设计开发之除对产品的预期用途和与安全性有关的特性以及可能危害的分析的记录。
《初始危害判定和初始风险控制措施》(见附件2),该附件是对正常和故障状态下的合理可预见的危害事件序列及其可能引起的危害处境、可能的损害和采取初步控制措施的记录。
《风险评价、风险控制措施及剩余风险评价记录表》(见附件3),该附件是对风险评价、风险控制措施的实施、验证及其剩余风险评价的记录。
第四章 风险管理评审结论
风险管理评审小组经过对试生产的产品的评审,以及以检查风险管理文档的方式对风险管理过程的评审,认为:
- 风险管理计划已被适当地实施;
- 综合剩余风险是可接受的;
- 已有适当方法获得相关生产和生产后信息;
-全部剩余风险处于风险可接受准则的可接受范围内,且受益超过风险。
同意批准申报注册。
签 名:
日 期:
附 录 1
安全特征问题清单及可能的危害,该清单依据 YY/T0316-2008 标准附录C 的问题清单和附录E.1危害示例,补充了有关产品的特有的安全性问题。

附 录2
初始危害分析(PHA),包括可预见的事件序列、危害处境和可发生的损害以及采取的初步控制措施。
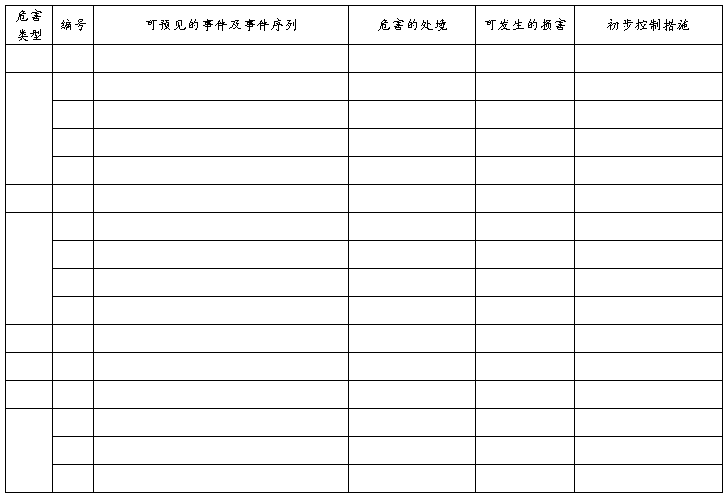
附 录3
1.风险评价、风险控制措施及剩余风险评价记录表

2.设计开发过程中,运用FMEA、PFMEA,对于与产品安全性相关的失效模式,按风险管理流程,进行风险分析、风险评价和风险控制,
制造过程中的FMEA 举例
工艺流程图如下:
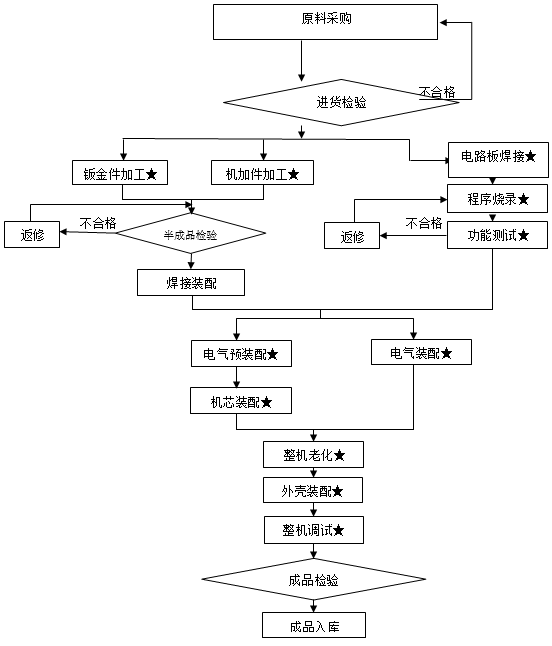
★为关键控制点
-
医疗器械风险分析报告
安全风险分析报告依据YY031620xx医疗器械风险管理对医疗器械的应用单位名称医疗器械有限公司产品名称医用纱棉块申报日期20xx…
-
医疗器械风险管理报告格式
医疗器械风险管理报告格式一正相关法1前言本文是对XXXX进行风险管理的报告报告中对所有的可能危害以及每一个危害产生的原因进行了判定…
-
医疗器械风险管理报告(注册版)
医疗器械风险管理报告XXXXX调整仪批准批准日期Xxxxx医疗器械科技有限公司目录第一章综述1第二章风险管理评审输入2第三章风险管…
-
医疗器械风险管理报告
医疗器械风险管理报告有源医疗器械医疗器械风险管理报告XXX型XX诊断仪文件编号批准人批准日期AAAA医疗器械有限公司1医疗器械风险…
-
医疗器械产品风险分析报告范例
无线心电和体温监测仪产品风险分析报告中科康馨电子技术北京有限公司20xx年11月理疗仪产品风险分析报告1一产品预期用途预期目的和与…
- 医疗器械风险管理计划
-
医疗器械产品风险分析报告范例
产品风险分析报告广州市XX医疗器械有限公司20XX年6月一、产品预期用途/预期目的和与安全性有关的特征的判定按照《YY/T0316…
-
医疗器械产品风险分析报告范例
无线心电和体温监测仪产品风险分析报告中科康馨电子技术北京有限公司20xx年11月理疗仪产品风险分析报告1一产品预期用途预期目的和与…
-
医疗器械产品--安全风险分析报告
血清碱性磷酸酶测定试剂盒ALP安全风险分析报告1总则血清碱性磷酸酶测定试剂盒以下简称ALP测试盒是一种临床检验体外诊断化学试剂中酶…
-
医疗器械风险分析报告
安全风险分析报告依据YY031620xx医疗器械风险管理对医疗器械的应用单位名称医疗器械有限公司产品名称医用纱棉块申报日期20xx…
-
20xx年度中央企业全面风险管理报告(模板)
20xx年度中央企业全面风险管理报告(模板)一、20xx年度企业全面风险管理工作回顾(一)企业全面风险管理工作计划完成情况。1、简…