医疗器械不良事件报告表
医疗器械不良事件报告表
报告日期: 年 月 日 编 码:£ £ £ £ £ £ £ £ £ £ £
报告来源:£ 生产企业 £ 经营企业 £ 使用单位 单位名称:
联系地址: 邮 编: 联系电话:

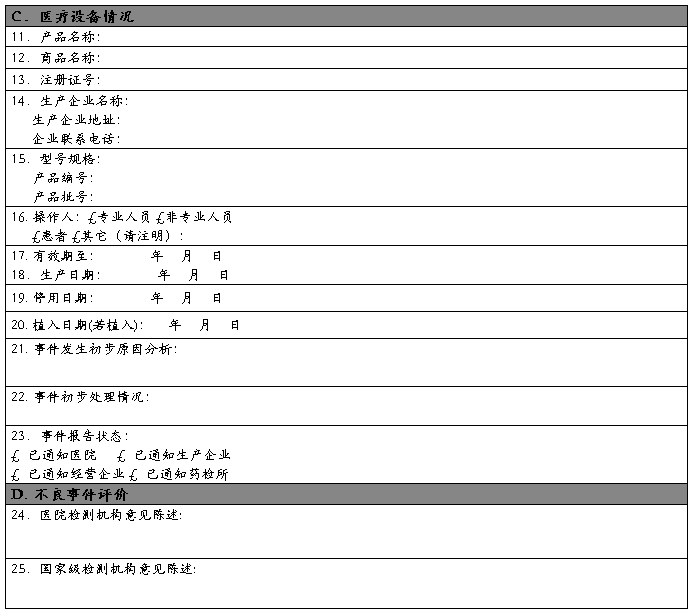
报告人签名: 涿州市医院设备科
第二篇:可疑医疗器械不良事件报告表(北京)(
国家食品药品监督管理局监制
可疑医疗器械不良事件报告表
报告日期: 年 月 日
报告来源:? 生产企业 ? 经营企业 ? 使用单位 单位名称:
联系地址: 邮编: 联系电话: 编码:? ? ? ? ? ? ? ? ? ? ?
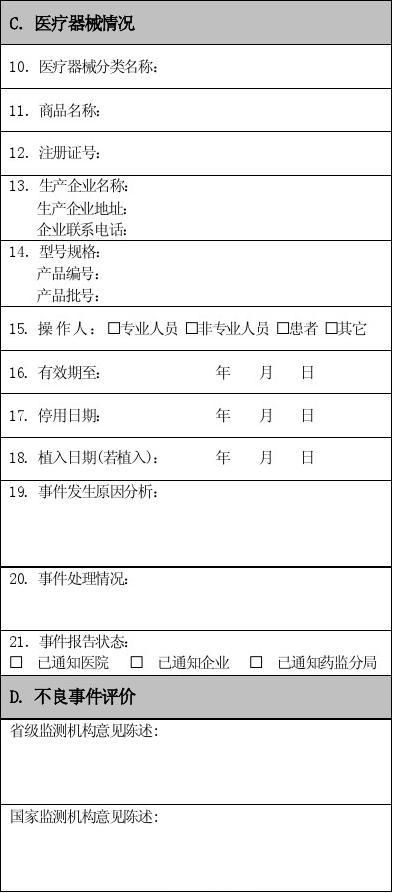

报告人签名:
可疑医疗器械不良事件报告表填写说明
一、 医疗器械不良事件定义:
获准上市的、合格的医疗器械在正常使用情况下,发生的或可能发生的任何与医疗器械预期使用效果无关的有害事件。
二、 报告范围:
需要医疗器械生产企业、经营企业、使用单位提供的可疑医疗器械不良事件报告是死亡和严重伤害报告。其中,严重伤害指①危及生命;②导致机体功能的永久性伤害或者机体结构的永久性损伤;③必须采取医疗措施才能避免上述永久性伤害或损伤。“永久性”是对身体结构或功能的不可逆的伤害,不包括小的伤害或损害。
三、 报告原则:
1、 基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与所使用医疗器械有关,需要按可疑医疗器械不良事件报告。
2、 濒临事件原则:
有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者或医务人员死亡或严重伤害,则也需要报告。
3、 可疑即报原则:
在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。这些事件可以是与使用医疗器械有关的,也可以是不能除外与医疗器械有关的事件。
四、 免除报告规则:
1、 使用者在应用前能够发现医疗器械有缺陷;
2、 完全是患者因素导致了不良事件发生;
3、 事件发生仅仅是因为器械超过有效期限;
4、 事件发生时,医疗器械预先设计的安全保护措施正常工作,并不会对患者造成伤害。
注意事项:1、请务必填写清楚您的联系方式、产品名称和生产企业名称
2、进口产品在生产企业联系方式一栏请填写境内代理企业联系方式
3、如有问题请与北京市药品不良反应监测中心联系
联系地址:北京市朝阳区管庄乡1号 100024
联系电话:010-65476895
e-mail: bjqxjck@126.com
北京市药品不良反应监测中心
-
医疗器械不良事件报告表
医疗器械不良事件报告表报告日期年月日报告来源生产企业经营企业使用单位单位名称单位盖章联系地址邮编联系电话编码报告人签名可疑医疗器械…
-
医疗器械不良反应报告表格和例子 (1)
附件1国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期年月日编码报告来源生产企业经营企业使用单位单位名称联系地址邮编联系…
-
医疗器械不良事件报告表
医疗器械不良事件报告表报告日期年月日编码报告来源生产企业经营企业使用单位单位名称联系地址邮编联系电话报告人医师技师护士其他报告人签…
-
医疗器械不良事件报告表
一填写内容一定要完整器械或设备名称一定要用包装上的包装名称二医疗器械不良事件上报范围合格的医疗器械在正常使用情况下发生的或可能发生…
-
可疑医疗器械不良事件报告表
附件1可疑医疗器械不良事件报告表报告日期年月日编码报告来源生产企业经营企业使用单位单位名称联系地址邮编联系电话报告人医师技师护士其…
-
上海市医疗器械不良事件年度汇总报告表
附件3上海市医疗器械不良事件年度汇总报告表报告时间年月日编码1报告人省级监测技术机构接收日期国家监测技术机构接收日期生产企业签章弗…
-
医疗器械不良事件报告表填写要求
医疗器械不良事件报告表填写要求主要内容第一部分可疑医疗器械不良事件报告表第二部分医疗器械不良事件补充报告表第三部分医疗器械不良事件…
-
医疗器械生产不良事件监测工作指南20xx.9
医疗器械生产企业不良事件监测工作指南一应履行的责任和义务1医疗器械安全有效的责任人2医疗器械不良事件的报告主体之一3建立并履行本企…
-
6.9.4.1医疗器械临床使用安全事件监测管理制度、报告制度及报告表
医疗器械临床使用安全事件监测管理制度为加强医院医疗器械不良反应监测管理工作依据国家医疗器械监督管理条例医疗器械不良反应事件监测和再…
-
20xx年医院医疗器械不良事件分析报告
20xx年医院医疗器械不良事件分析报告20xx年我院共收到各科室可疑医疗器械不良事件报告9例从医疗器械不良事件涉及范围特征来看主要…
-
医疗器械不良事件分析总结
医疗器械不良事件分析总结20xx年医疗器械不良事件报告工作在全院临床及相关科室共同努力下,取得一定成果和进步。今年共计收到临床科室…