医疗器械不良反应报告表格和例子 (1)
附件1: 国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期: 年 月 日 编 码:£ £ £ £ £ £ £ £ £ £ £
报告来源:£ 生产企业 £ 经营企业 £ 使用单位 单位名称:
联系地址: 邮 编: 联系电话:
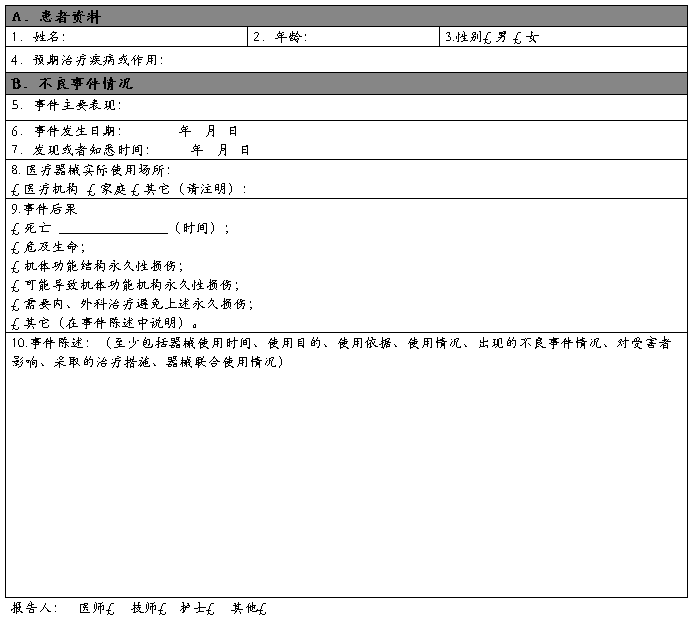

报告人签名:
例子:
附件1: 国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期:20##年10月25日 编 码:£ £ £ £ £ £ £ £ £ £ £
报告来源:£ 生产企业 £ 经营企业 £ √使用单位 单位名称:按实际填写
联系地址: 按实际填写 邮 编: 联系电话:

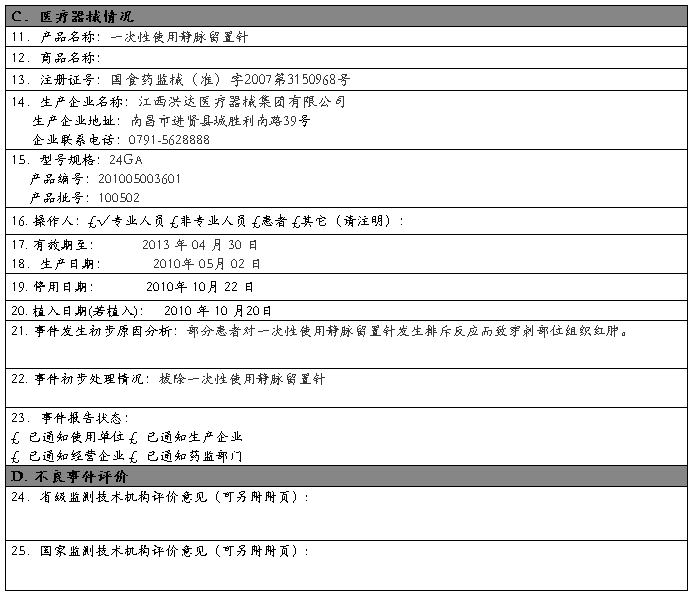
报告人签名:
例子2
附件1: 国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期: 20## 年 10 月 8日 编 码:£ £ £ £ £ £ £ £ £ £ £
报告来源:£ 生产企业 £ 经营企业 £√ 使用单位 单位名称:
联系地址: 邮 编: 联系电话:


报告人签名:
第二篇:药品、医疗器械不良反应事件报告报表
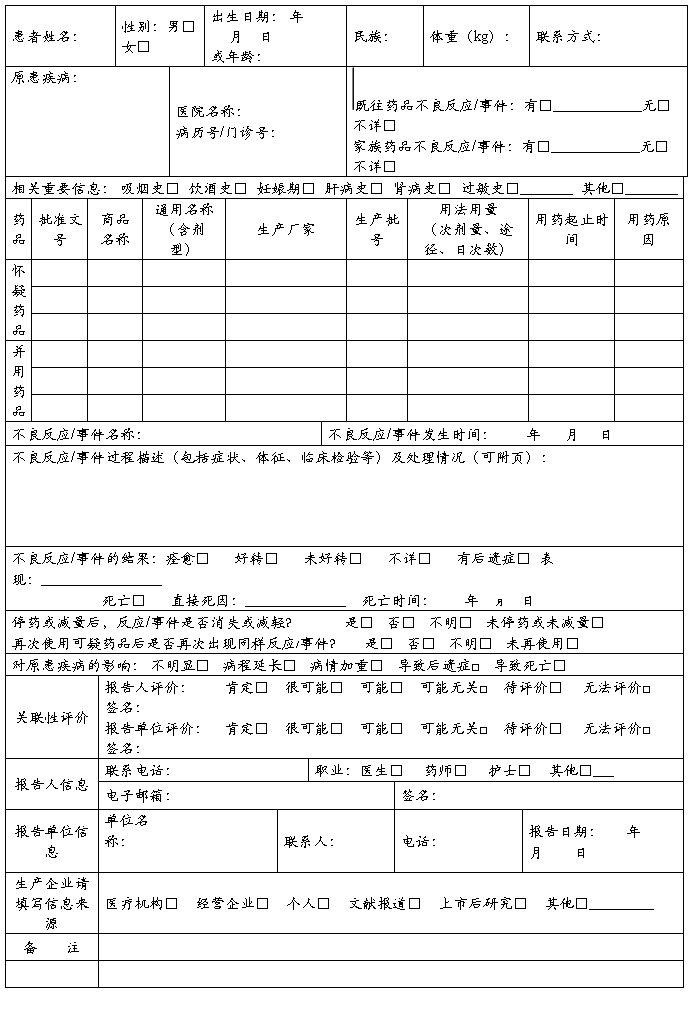
附录一 药 品 不 良 反 应 / 事 件 报 告 表
首次报告□ 跟踪报告□ 编码:
报告类型:新的□ 严重□ 一般□ 报告单位类别:医疗机构□ 经营企业□ 生产企业□ 个人□ 其他□
附录二、《可疑医疗器械不良事件报告表》及填写要求
可疑医疗器械不良事件报告表
报告日期: 年 月 日 编 码:£ £ £ £ £ £ £ £ £ £
报告来源:£ 生产企业 £ 经营企业 £ 使用单位 单位名称:
联系地址: 邮 编: 联系电话:

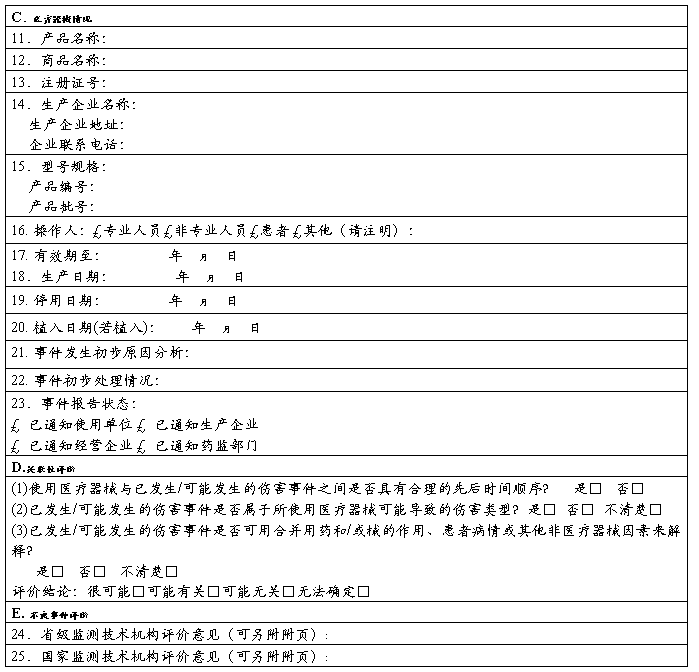
报告人签名: 国家食品药品监督管理局制
-
器械不良反应报告表
可疑医疗器械不良事件报告表报告日期年月日编码报告来源生产企业经营企业使用单位单位名称联系地址邮编联系电话报告人医师技师护士其他报告…
-
器械不良反应报告表
附件1可疑医疗器械不良事件报告表及填写要求可疑医疗器械不良事件报告表报告日期年月日编码报告来源生产企业经营企业使用单位单位名称联系…
- 医疗器械不良反应报告表
-
可疑器械不良反应登记表
附表一国家食品药品监督管理局监制可疑医疗器械不良事件报告表报告日期年月日报告来源生产企业经营企业使用单位单位名称联系地址邮编联系电…
-
药品、器械不良反应报告表及说明
附表1药品不良反应事件报告表首次报告跟踪报告编码报告类型新的严重一般报告单位类别医疗机构经营企业生产企业个人其他严重药品不良反应是…
-
药品不良反应和医疗器械不良事件监测与报告制度
药品不良反应和医疗器械不良事件监测与报告制度一药品不良反应定义上市药品在正常用法用量情况下出现的与用药目的无关的或意外的有害反应包…
-
医疗器械临床使用安全事件监测管理制度、报告制度及报告表
医疗器械临床使用安全事件监测管理制度为加强医院医疗器械不良反应监测管理工作依据国家医疗器械监督管理条例医疗器械不良反应事件监测和再…
-
6.9.4.1医疗器械临床使用安全事件监测管理制度、报告制度及报告表
医疗器械临床使用安全事件监测管理制度为加强医院医疗器械不良反应监测管理工作依据国家医疗器械监督管理条例医疗器械不良反应事件监测和再…
-
可疑医疗器械不良事件报告表和例子word正常版
附件1国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期年月日编码报告来源生产企业经营企业使用单位单位名称联系地址邮编联系…
-
医疗器械不良事件监测年度报告(20xx年度)
国家医疗器械不良事件监测年度报告20xx年度一全国医疗器械不良事件报告总体情况20xx年全国医疗器械不良事件监测工作继续稳步发展全…
-
医疗器械不良事件报告表填写要求
医疗器械不良事件报告表填写要求主要内容第一部分可疑医疗器械不良事件报告表第二部分医疗器械不良事件补充报告表第三部分医疗器械不良事件…