细胞生物学实验报告
细胞生物学实验报告
叶绿体的分离、纯化与荧光观察
【实验目的】
⒈通过植物细胞叶绿体的分离与纯化,了解细胞器分离与纯化的原理和方法。
⒉熟悉荧光显微镜的使用方法,观察叶绿体的自发荧光和间接荧光。
【实验原理】
⒈叶绿体是植物细胞所特有的能量转换细胞器,叶绿体是植物细胞所特有的能量转换细胞器,光合作用就是在叶绿体中进行。由于具有这一重要功能,所以它一直是细胞生物学、遗传学和分子生物学的重要研究对象。叶绿体是植物细胞中较大的一种的细胞器,利用低速离心即可分离集中进行各种研究。
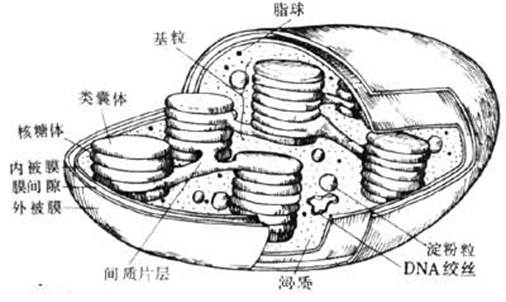
叶绿体结构模式图
组织细胞的破碎方法很多,包括机械法(研磨法、 匀浆法、胶体磨法)和非机械法(超声波法、有机溶法、溶胀法、酶解法)。除了某些细胞外的多肽激素和某些蛋白质与酶以外,对于细胞内或多细胞生物组织中的各种生物大分子的分离纯化,都需要事先将细胞和组织破碎,使生物大分子充分释放到溶液中,并不丢失生物活性。不同的生物体或同一生物体的不同部位的组织,其细胞破碎的难易不一,使用的方法也不相同。
⒉细胞器分离的过程包括两个主要阶段:碎细胞和细胞组分的分离。将组织匀浆后悬浮在等渗介质中进行离心,差速离心和密度梯度离心是分离亚细胞组分的常用方法。
⑴差速离心
①原理:一个颗粒在离心场中的沉降速率取决于颗粒的大小、形状和密度,也同离心力以及悬浮介质的粘度有关。在一给定的离心场中,同一时间内,密度和大小不同的颗粒其沉降速率不同。依次增加离心力和离心时间,就能够使非均一悬浮液中的颗粒按其大小、密度先后分批沉降在离心管底部,分批收集即可获得各种亚细胞组分。
②事例:叶绿体的分离应在等渗溶液(0.35mol/L 氯化钠或 0.4mol/L 蔗糖溶液)中进行,以免渗透压的改变使叶绿体受到损伤。将匀浆液在1000r/min 的条件下离心 2min,以去除其中的组织残渣和一些未被破碎的完整细胞。然后,在 3000r/min 的条件下离心 5min,即可获得沉淀的叶绿体(混有部分细胞核)。分离过程最好在 0~5℃的条件下进行;如果在室温下,要迅速分离和观察。
③特点:介质密度均一,速度由高到低,逐级离心。
④用途:分离大小相差悬殊的细胞和细胞器。
⑤沉降顺序:核——线粒体——溶酶体与过氧化物酶体——内质网与高基体——核蛋白体。
差速离心可将细胞器初步分离,常需进一步通过密度梯度离心再行分离纯化。
⑵密度梯度离心
①原理:用一定的介质在离心管内形成连续的密度梯度,将细胞悬浮液或匀浆置于介质的顶部,通过离心力的作用使细胞或细胞器分层、分离,最后不同密度的细胞或细胞器位于与自身密度相同的沉降区带中。
②分类
速度沉降——分离密度相近而大小不同的物体。
等密度沉降——分离密度不同的物体。
⒊荧光的概念
①光致发光:某些物质在照射下,吸收光能进入激发态,当从激发态回到基态时,可以以电磁辐射的形式释放出吸收的光能,这种现象称为“光致发光”。紫外辐射、可见光及红外辐射均可引起光致发光,如磷光与荧光。
②荧光:在光致发光中,如果一定波长的短波光(如紫外光)照射某种物质,这种物质吸收光能后进入激发态,并且立即退激发在极短的时间内能发射出比照射光波更长的光(如可见光) ,这种光就称为荧光。一旦停止入射光,发光现象也随之立即消失。荧光分为自发荧光或诱发荧光(次生荧光、续发荧光、间接荧光)。某些物质受激发光照射后可直接发出荧光,如叶绿素、血红素的火红色荧光或木质素的黄色荧光的等,称为自发荧光(直接荧光)。某些物质本身不发荧光,但它经荧光染料染色后,再通过紫外线照射同样也能发出荧光,这样荧光称为诱发荧光,如叶绿体被咩啶橙染色后可发桔红色荧光。
⒋染色剂
吖啶橙是一种与 DNA 和 RNA 都能结合的荧光染料,在紫外线或蓝光(330~485nm)激发下,DNA可被激发出 530nm 的荧光发射峰(细胞核发亮绿 色荧光),RNA 可被激发出 640nm 的荧光发射峰(核仁和胞质 RNA 发桔红色荧 光)。产生两种不同荧光是由于吖啶橙与双链 DNA 和单链 DNA 或 RNA 的结合方 式和结合量不同而决定的。DNA 是高度聚合物,它与 DNA 结合是潜入双链之间, 结合量相对少;而与单链 DNA 或 RNA 的结合则由静电吸引堆积在磷酸根上,结合量相对多些。我们推测,叶绿体的次生荧光的来由,大部分来自叶绿体的吸附作用,极少部分来自于叶绿体中的RNA。
【实验用品】
⒈材料
新鲜菠菜
⒉仪器
普通或高速离心机、电子天平、荧光显微镜、剪刀、研钵、移液管、漏斗、滴管、10ml离心管。
⒊试剂
⑴0.35mol/L 的 NaCl 等渗溶液。
⑵0.01% 吖啶橙(acridine orange)——称取 0.1g 吖啶橙加蒸馏水 100ml 做母液,储存于棕色瓶,置 4℃冰箱保存。临用前取 1mL 母液加 1/15mol/L 磷酸缓冲液(pH 4.8)9mL。
【实验步骤】
⒈选取新鲜嫩绿的菠菜叶,去叶梗及其粗脉,洗净擦干,称取 30g 放于 150ml 0.35mol/L的 NaCl 溶液中。
⒉将叶片和溶液同时装入组织捣碎机中,均将 3—5 分钟,然后在 5000r/min 的条件下离心。
⒊将匀浆用纱布(6 层)过滤于 500ml 烧杯中。
⒋取滤液 4ml 在 1000r/min 的条件下离心 2min。
⒌取上清液在 3000r/min 的条件下离心 5 分钟(沉淀即为叶绿体和细胞核的混合物)。
⒍将沉淀用 2ml 0.35mol/L 氯化钠溶液配成悬浮液。
⒎取悬液 1 滴滴片,加上盖玻片后即可观察。
【实验结果】
⒈结果
⑴在普通光学显微镜下,叶绿体为橄榄形,呈现绿色。(图1)
⑵在荧光显微镜下,选用 B(blue)激发滤片,B 双色镜和 O530(orange)阻断滤片的条件下,叶绿体发出火红色荧光。(图2)
⑶加入吖啶橙染色后,叶绿体可发出桔红色荧光,而其中混有的细胞核则发绿色荧色。(图3)
⒉图像




图1普通显微镜下观察 图2 自发荧光 图3次生荧光 图4保卫细胞
【分析与讨论】
⒈结果分析
⑴在光学显微镜下观察叶绿体时,不但能观察到正常的绿色橄榄型,还能看到 一些形状较小,且不规则的碎片。造成这种现象的原因是因为在离心过程中,离心不纯造成了叶绿体沉降物中混有了其他组织的碎片。
⑵叶绿体在荧光显微镜下观察可看到火红色的自发荧光,且为点状。这是因为叶绿体自身在悬液中的分布呈点状,而且其内的叶绿素在经激发光波照射后,可放出火红色的自发荧光,而悬液其它组分没有此反应。
⑶叶绿体荧光染色后在荧光显微镜下观察,可以看到其呈现出的桔红色的斑块状,在此之外,其空白处背景色为绿色。这是因为叶绿体吸附吖啶橙后发出了桔红色的次生荧光,而绿色则是由叶绿体悬液中混有细胞核以及其内的 DNA 和 RNA,在吸附吖啶橙后经荧光反应,呈绿色。
⒉注意事项
⑴叶绿体的分离在等渗溶液中进行,以免渗透压的改变使叶绿体受到损伤。
⑵分离过程最好在 0~5℃的条件下进行;如果在室温下,要迅速分离和观察。
 ⑶离心机使用时要平衡。
⑶离心机使用时要平衡。
⑷荧光显微镜的使用
?荧光显微镜镜检要在光线尽量暗的环境下进行;
?使用荧光显微镜时要注意不要直接观察激发光源,保护眼睛;
?凡是荧光染料都有一定毒性,请做好保护;
?利用荧光显微镜对可发荧光的物质进行检测时,将受到许多因素的影响, 如温度、光、淬灭剂等;
?按 starter 按钮 3—5 秒以启动激发光源,但不能超过 5 秒;
?启动 2—3 分钟后方可稳定; 荧光显微镜外观图
 ?启动 15 分钟内不得关闭电源;
?启动 15 分钟内不得关闭电源;
?一旦关闭电源,3 分钟内不得重新启动,用完后关闭 main switch;
?在荧光观察时应抓紧时间,有必要时立即拍照;
?观察时要选择相对应的激发滤片、阻断滤片和双色滤片;
?放置样品,要先在普通目镜下选好要观察的视野;
?在制作荧光显微标本时最好使用无荧光载片、盖片和无荧光油;
?贡灯开启后 15min 内不要关闭;
?试验结束,切断电源。
荧光显微镜光路图
【相关链接】
共聚焦荧光显微镜


共聚焦荧光显微镜成像的基本原理图 共聚焦荧光显微镜光路示意图
双光子激光荧光扫描显微镜


单光子、双光子或多光子激发的基本原理 单光子和双光子激发的比较

共聚焦和双光子显微镜基本光路示意图的比较
第二篇:细胞生物学实验报告——凝血
细胞生物学实验报告——植物凝集素介导的细胞凝集反应
山东大学细胞生物学实验报告
植物凝集素介导的红细胞凝集反应
姜政 2012/10/6
实验目的:
观察凝血的过程和凝血后红细胞的聚集状态,理解细胞间凝集反应与细胞膜表面结构的关系,了解植物凝集素使红细胞凝集的基本原理和凝集素的应用领域。
实验原理:
凝集素(Lectins)是一种能与细胞膜表面糖蛋
白寡糖链特异性结合的蛋白质,多数含糖,广泛存
在于植物提取物、动物组织、各种微生物包括病毒
中,其中以植物凝集素(Phytohemagglutinin,PHA)
分离到的种类最多。植物凝集素在植物体内主要参
与防卫机制[1],识别入侵微生物和愈合伤口,在豆
类植物中,凝集素还与植物与特定固氮菌形成共生
有关[2];在体外,凝集素最典型的效应是引起细胞
凝集。通常认为,凝集素介导细胞凝集的基本原理
是:可溶性凝集素分子能与细胞膜表面的糖蛋白寡
糖链特异性结合,使不同细胞的糖蛋白通过凝集素
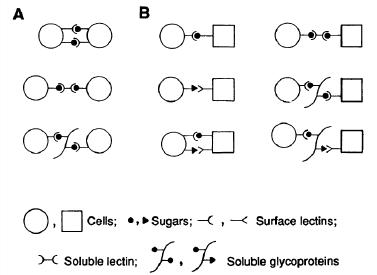
分子彼此连结,进而引起细胞间凝集(图1)。
红细胞膜表面有大量糖蛋白,其中一些糖蛋白图1. 凝集素介导的细胞与分子或细胞间相互作用模具有特异性,比如人类A型红细胞表面的α-N-乙型(引自Chapman and Hall 1989)。 酰-D-半乳糖胺和O型红细胞表面的α-L-海藻糖就A. 同种细胞间相互作用。B. 不同种细胞间相互作分别决定了人类的A血型和O血型[3]。本实验就用。在本实验中,土豆块茎凝集素介导的红细胞凝是利用植物凝集素与红细胞表面糖蛋白受体的特集属于A类中由上至下数第二种类型,即凝集素可异性结合实现红细胞凝集。 溶,可以同时与两个红细胞表面的糖蛋白寡糖链结土豆块茎凝集素(potato tuber lectin)是一种合,在两个红细胞之间形成连接。 能结合几丁质的富含羟脯氨酸的糖蛋白,单体分子
量约50, 000,包含至少三个不同的结构域,其中富含胱氨酸的区域与麦胚凝集素(wheat germ agglutinin,WGA)等几丁质结合蛋白具有同源性[1, 4]。土豆凝集素含有50%(质量分数)的糖组分,其中90%是阿拉伯糖,另有少量半乳糖;最丰富的氨基酸是羟脯氨酸,其次是半胱氨酸。土豆凝集素在水溶液中主要以单体形式存在,能与细胞膜寡糖链上的N-乙酰葡萄糖胺特异性结合[5],这是其具有凝集活性的主要原因。
鉴于凝集素对糖蛋白的特异性结合,凝集素常被用于糖蛋白的分离、纯化,此外,一些凝集素还可诱导细胞分裂。在临床医学领域,凝集素被广泛应用于血型鉴定,疾病诊断(如凝集素芯片)等。比如在动物体内,巨噬细胞表面凝集素对半乳糖和N-乙酰半乳糖胺的特异性结合使得巨噬细胞能特异性地区分肿瘤细胞和正常细胞并杀死肿瘤细胞[2],利用巨噬细胞表面凝集素可以筛选肿瘤细胞。
材料、试剂:
兔血红细胞,土豆块茎粗提液(含土豆凝集素),PBS缓冲液,生理盐水
实验方法:
制备2%家兔红细胞悬液,与土豆块茎粗提液各一滴在双凹载玻片上混合,轻轻摇晃使细胞悬液与土豆提取液充分混匀,观察凝集情况。另以生理盐水在同一玻片上作阴性对照。
1
细胞生物学实验报告——植物凝集素介导的细胞凝集反应
实验结果:
实验组 对照组
注:d图对照组棘形红细胞是由实验中生理盐水水分蒸发形成高渗溶液造成的。
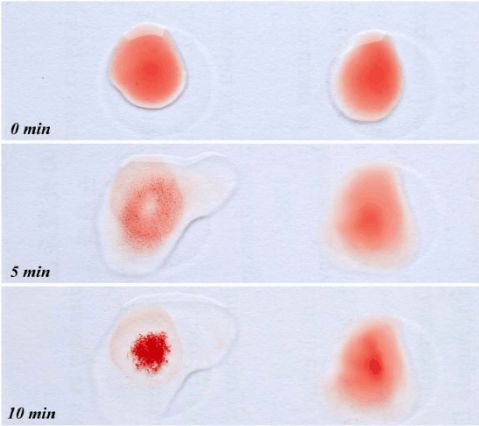
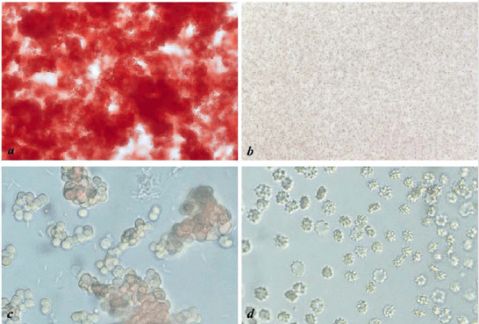
图2. 土豆块茎粗提液与2%红细胞悬液等体积混合后红细胞的凝集现象。 在3-5min时,实验组混合液中开始出现微小砂状凝集颗粒,8-10min时,小颗粒逐渐聚集形成较大的颗粒,此时凝集颗粒不再聚集,颗粒周围液体变为无色澄清。实验过程中以生理盐水与2%红细胞悬液等体积混合的对照组没有发生凝集现象。 图3. 凝集红细胞与对照组红细胞的聚集状态及形态。 a.实验组发生完全凝集时红细胞的聚集状态(100×) b.对照组红细胞均匀散布(100×) c.实验组发生完全凝集时红细胞的聚集形态(400×) d.对照组红细胞均匀散布(400×) 2
细胞生物学实验报告——植物凝集素介导的细胞凝集反应
讨论:
在植物凝集素介导的哺乳动物红细胞的凝集中,最常见的凝集素受体是具有N-乙酰葡萄糖胺残基的糖蛋白寡糖链。比如人类红细胞上一种能与植物凝集素强烈结合的寡糖链的结构是:2个甘露糖和一个N-乙酰葡萄糖胺构成与蛋白质丝氨酸残基相连的核心糖,核心糖之上有半乳糖-β-N-乙酰葡萄糖胺和唾液酸-半乳糖-β-N-乙酰葡萄糖胺两个非还原性末端分支[6]。
多数情况下,可溶性凝集素与配体寡糖链的连接通过氢键相互作用,在其它情况下也存在疏水相互作用,静电相互作用和金属离子配位等连接方式[7]。虽然氢键键能比共价键键能弱很多,但由于红细胞表面的凝集素受体数量很大,细胞之间仍然能够形成牢固结合。比如扁豆凝集素(lens culinaris agglutinin,LCA)能与红细胞表面糖蛋白寡糖链上的N-乙酰葡萄糖胺和甘露糖特异性结合,而人类单个红细胞表面的扁豆凝集素受体分子数量大约为500, 000个[8],这是为什么扁豆凝集素分子与其受体并未形成共价键却能引起红细胞大面积聚集的原因。
从实验过程来看,等体积土豆块茎提取液与2%红细胞悬液混合后,红细胞并没有马上发生肉眼可辨的凝集,明显凝集颗粒的出现大概需要3-5min,而完全凝集需要将近10min(图2),这可能与红细胞的碰撞频率(摇动玻片的频率)有关。一旦形成小型凝集颗粒,这些小颗粒会有凝集成大颗粒的趋势,而较大的凝集颗粒已经具有一定的形状和棱角,所以,受氢键数量和强度的限制,最终形成的凝集颗粒不会太大。
影响植物凝集素介导的红细胞凝集的因素除了凝集素的数量,还有红细胞的代谢状态、形状变化、表面膜电荷等。具有正常盘状形态、ATP代谢正常的红细胞易于发生凝集[9]。
参考文献:
1. Anthony K. Allen, G. Paul Bolwell, David S. Brown, Christopher Sidebottom, Anton R. Slabas. Potato Lectin: a Three-domain Glycoprotein with Novel Hydroxyproline-containing Sequence Similarities to Wheat-germ Agglutinin. Int. J. Biochem. Cell Biol, Vol. 28, 1285-1291, 1996.
2. Nathan Sharon, Halina Lis. Lectins as Cell Recognition Molecules. Science, Vol. 246, 227-234, 1989.
3. Nathan Sharon and Halina Lis. History of lectins: from hemagglutinins to biological recognition molecules. Glycobiology, Vol. 14, 53R–62R, 2004.
4. Anthony K. Allen and Albert Neuberger. The Purification and Properties of the Lectin from Potato Tubers, a Hydroxyproline-Containing Glycoprotein. The Journal of Biological Chemistry, Vol. 135, 307-314, 1973.
5. Anthony K. Allen, Nila N. Desai, Albert Neuberger and J. Michael Creeth. Properties of Potato Lectin and the Nature of its Glycoprotein Linkages. Biochem. J, Vol. 171, 665-674, 1978.
6. Rosalind Kornfeld, Stuart Kornfeld. The Structure of a Phytohemagglutinin Receptor Site from Human Erythrocytes. The Journal of Biological Chemistry, Vol. 245, 2536-2545, 1970.
7. Nathan Sharon. Lectins: Carbohydrate-specific Reagents and Biological Recognition Molecules. The Journal of Biological Chemistry, Vol. 282, 2753–2764, 2007.
8. Stuart Kornfeld, John Rogers, Walter Gregory. The Nature of the Cell Surface Receptor Site for Lens czdinaris Phytohemagglutinin. The Journal of Biological Chemistry, Vol. 246, 6581-6586, 1971.
9. Judith A. Singer, Martin Morrison. Mechanism of the modulation of the phytohemagglutinin-P agglutination of the human erythrocyte by metabolic state. Biochimica et Biophysica Acta - Biomembranes, Vol. 506, 202–210, 1978. 3
-
细胞生物学综合性实验报告
本科学生实验报告学号姓名学院生命科学学院专业班级11级生物科学C班实验课程名称细胞生物学实验指导教师及职称吴暇玉开课时间20xx至…
-
细胞生物学实验报告
染色体标本的制备及观察泮力菁20xx0014009120xx级生物基地同组者商倩倩实验目的1掌握染色体标本制作的方法2认识不同生物…
-
细胞生物学实验报告
细胞生物学实验报告细胞生物学实验报告叶绿体的分离纯化与荧光观察实验目的通过植物细胞叶绿体的分离与纯化了解细胞器分离与纯化的原理和方…
-
细胞生物学综合实验报告
本科学生实验报告姓名学院生命科学学院专业班级10B班实验课程名称人类淋巴细胞株的培养指导教师及职称许琳峰开课时间20xx至20xx…
-
细胞生物学实验报告
细胞生物学实验报告细胞生物学实验报告小鼠脾细胞原代培养姓名杜旭学号20xx00230155系年级20xx级临七一班同组者赵伟日期2…
-
山东大学细胞生物学实验报告
山东大学细胞生物学实验报告姓名高超年级20xx级生科三班学号20xx00140020实验名称苏丹染色观察小鼠脂肪同组者樊晓航王昊明…
-
细胞生物学实验五——细胞膜的通透性实验 山东大学实验报告
细胞生物学实验五细胞膜的通透性实验13生物基地20xx00140059刘洋20xx0429同组者吕赞一实验目的1了解溶血现象及其发…
-
细胞生物学综合性实验报告
本科学生实验报告学号姓名学院生命科学学院专业班级11级生物科学C班实验课程名称细胞生物学实验指导教师及职称吴暇玉开课时间20xx至…
- 观察植物细胞生物实验报告单
-
细胞生物学实验报告
染色体标本的制备及观察泮力菁20xx0014009120xx级生物基地同组者商倩倩实验目的1掌握染色体标本制作的方法2认识不同生物…