20xx年10月碱滴定酸实验报告
碱滴定酸实验报告
制作人:赵勇 时间:20##年10月16日
1. 实验目的:用0.1mol/L的NaOH溶液利用滴定法测出未知浓度的HCI溶液的物质的量浓度。
2. 实验成员:蚱蜢
3. 实验原理:酸碱中和反应(NaOH+HCI=NaCI+H2O)
4. 实验用品:仪器:50mL的碱式滴定管1支、滴定管架、烧杯4个、20mL的移液管1支、锥形瓶3个、胶头滴管1支
药品:0.1mol/L的NaOH溶液、酚酞指示剂
5. 实验步骤:*碱式滴定管中装入清水至零刻度,然后固定在滴定管架上2分钟,看是否漏水
*检完漏再用清水洗滴定管两遍。再用蒸馏水洗一遍(管壁成水膜),最后用0.1mol/L的NaOH标准溶液润洗两遍(每次装1/3的量洗)。(倒液时上口稍向下并对准水槽,遍转遍慢倒)最后装入0.1mol/L的NaOH标准溶液,挤压水泡,调零,固定在滴定架上。(挤水泡时胶头倾斜45度,挤玻璃球的稍上方)
*润洗移液管两次(右手拿管,食指按住上口,注意不要碰壁插入装有蒸馏水的烧瓶,用耳球把水吸到管的1/3—1/2,洗完后要用吸水纸吸走管头和管壁的水),再开始用标准液润洗两次,再移液至锥形瓶中,(准备三个烧杯,第一个烧杯装0.1mol/L的NaOH标准溶液,把第一个烧杯的溶液倒入一部分进第二个烧杯中,再开始用移液管吸取第二个烧杯的0.1mol/L的NaOH标准溶液进行润洗,把管内的润洗夜放入第三个烧杯中‘管要垂直拿,管口碰烧杯壁,烧杯呈45度角’两次后再装第一个烧杯的液体至刻度以上,取下耳球用食指调,注意要深色线与刻度线平齐,最后还要把管口的液体碰掉)在锥形瓶中滴入3滴酚酞。
*进行滴定,(滴定液不能呈线状,左手拿瓶,右手滴)直至锥形瓶内的液体呈现微粉红色(遍滴遍摇匀,碰壁为半滴),且在30秒后都不褪色,最后记录数据。
*滴定实验再重复两次。
6. 实验数据:每次用20mL的HCI溶液

7.数据处理:nNaOH=cNaOH*v=0.1mol/L*(6.26mL/1000)=6.26*10-4mol
根据NaOH与HCI的化学方程式可得:
nNaOH=nHCI=6.26*10-4mol
cHCI= nHCI/v=6.26*10-4mol/0.02L=0.0313mol/L
7.实验结论:该HCI溶液的物质的量浓度为0.0313mol/L
8.评价:
老师的评价:
第二篇:实验报告二
三氯化六氨合钴(Ⅲ)的制备及组成测定
一 实验目的:
1 了解氧化还原反应的相关知识。
2 了解从二价钴盐制备三氯化六氨合钴的方法。
3 掌握配位化合物理论及平衡方面的知识。
4 了解固相催化的原理及特点。
5 掌握用酸碱滴定法测定样品中氨含量的原理和方法。
6 掌握用沉淀滴定法测定样品中氯含量的原理和方法。
7 掌握用碘量法测定样品中钴含量的原理和方法。
8 训练无机合成、滴定分析的基本操作,掌握确定组成和化学式的原理和方法。
二 实验内容:
(一) 三氯化六氨合钴的制备
1 实验原理:
在通常情况下,二价钴盐较三价钴盐稳定的多,而在许多场合它们的配合状态下却正相反,三价钴反而比二价钴稳定。因此,通常采用空气或者氧化剂氧化二价钴的方法,来制备三价钴的配合物。
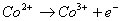
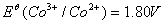
[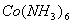 ]
]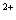
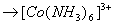
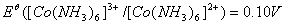
氯化钴(Ⅲ)的氨合物有许多种,主要有三氯化六氨合钴(橙黄色晶体)、三氯化一水五氨合钴(砖红色晶体)、二氯化一氯五氨合钴(紫红色晶体)等。
本次实验三氯化六氨合钴的制备条件是:以活性炭为催化剂,用氧化剂氧化有氨剂——氯化铵存在的氯化钴溶液。反应式为:
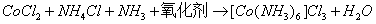
所得产品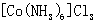 为橙黄色单斜晶体。
为橙黄色单斜晶体。
2 实验仪器及试剂:
仪器:锥形瓶(250mL),铁架台,药匙,滴管,表面皿,量筒,电炉,玻璃棒,移液管,洗瓶,温度计,恒温水浴锅,烘箱,抽滤瓶,布氏漏斗,抽滤装置,分析天平,普通电子天平
试剂:NH4Cl,CoCl2·6H2O,NH3·H2O,H2O2,HCl,活性炭,冰,乙醇,去离子水
3 实验步骤:
在锥形瓶中,将4.0gNH4Cl溶于8.4mL水中,加热至沸。加6.0gCoCl2·6H2O晶体,溶解后,稍冷却,加0.4g活性炭,摇动锥形瓶,使其混合均匀。用流水冷却后,加入13.5mL浓氨水,再冷却至283K以下,用滴管逐滴加入13.5mL5%H2O2溶液,水浴加热至323~333K,保持20分钟并不断摇锥形瓶。然后用冰浴冷却至273K左右,马上减压过滤。直接把沉淀溶于50mL沸水中(水中含1.7mL浓盐酸),趁热抽滤,在滤液中慢慢加入6.7mL浓盐酸,有大量橘黄色晶体析出,用冰浴冷却后,马上抽滤。用5mL乙醇洗涤,吸干。晶体在水浴上干燥,称重,计算产率。
4 实验数据处理:
得到的产品:m产品=4.987g
称取mCoCl2·6H2O=6.0g
理论产品质量: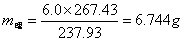
产率=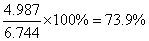
(二) 三氯化六氨合钴组成的测定
1 氯的测定
(1) 实验原理:
在中性或弱碱性溶液中,以K2CrO4作指示剂,用硝酸银标准溶液滴定Cl-
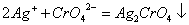 (砖红色)
(砖红色) 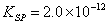
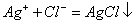 (白色)
(白色) 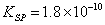
由于AgCl溶解度比Ag2CrO4小,根据分布沉淀原理。溶液中首先析出AgCl沉淀,化学计量点附近,由于Ag+浓度增加,与CrO42-生成砖红色Ag2CrO4沉淀指示滴定终点。
(2) 实验仪器和试剂:
仪器:容量瓶(100mL),锥形瓶(250mL),酸式滴定管,玻璃棒,烧杯,移液管
试剂:AgNO3溶液,NaCl,2.5%K2CrO4溶液
(3) 实验步骤:
① 准确称取0.4g左右的样品,溶解在250mL容量瓶中,用移液管移取25mL于锥形瓶中,加入0.5mL2.5%K2CrO4溶液作为指示剂。
② 用氯化钠溶液标定硝酸银溶液后,用硝酸银标准溶液滴定样品溶液至出现砖红色不再消失为终点。
③ 根据消耗的硝酸银溶液的量,计算氯的含量。
(1) 实验数据处理:
标定AgNO3 :
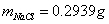
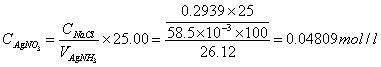
两组平均值:

数据记录

氯的百分含量:
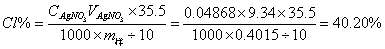
1mol样品中氯的物质的量=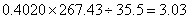
2 氨的测定
(1) 实验原理:
第一步氨气释放
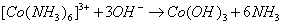
第二步硼酸吸收氨气
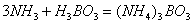
第三步盐酸滴定硼酸铵

(2) 实验仪器和试剂:
仪器:锥形瓶(250mL),容量瓶(250mL),分析天平,烧杯,量筒,玻璃棒,药匙,移液管,量筒,凯氏定氮仪,酸式滴定管,电炉
试剂:盐酸,无水碳酸钠,甲基红-溴甲酚绿,硼酸溶液
(3) 实验步骤:
① 准确称取0.2g左右的试样,放入250mL锥形瓶中加30mL水溶解,放在凯式定氮仪上操作。
② 用碳酸钠溶液标定盐酸后,用标准浓度的盐酸溶液滴定硼酸至颜色由蓝绿色变成浅粉色。
③ 将锥形瓶放在电炉上加热,沸腾1min后,冷却至室温再继续滴定至浅粉色。③根据消耗的HCl的量,计算氨的含量。
(4) 实验数据处理:
标定HCl: 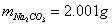 g
g 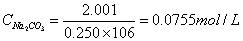

滴定样品:
数据记录

样品中 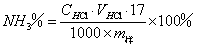
即 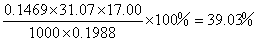
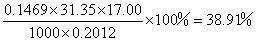
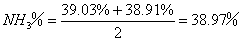
1mol样品中NH3的物质的量=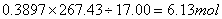
3 钴的测定
(1) 实验原理:
第一步氨气释放
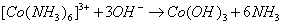
第二步碘的还原
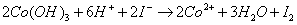
第三步碘量法测定
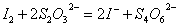
(2) 实验仪器和试剂:
仪器:碘量瓶(250mL),容量瓶(250mL),烧杯,量筒,玻璃棒,药匙,量筒,碱式滴定管,电炉,分析天平,移液管
试剂:KI固体,6mol/LHCl溶液,10%NaOH溶液,Na2S2O3固体,0.5%淀粉溶液,K2Cr2O7固体
(3) 实验步骤:
① 准确称取0.17~0.22g试样两份放于碘量瓶,分别加20mL水溶解,再加入3mL10%NaOH加热有棕黑色沉淀产生,沸后小火加热5min。
② 取下稍冷,加50mL水,用流水冷至室温。加入0.5gKI及5mL6mol/L盐酸,摇动使之溶解,在暗处放置5min。
③ 用K2Cr2O7溶液标定Na2S2O3溶液后,用Na2S2O3标准溶液滴定。当溶液颜色呈浅黄时加2mL0.5%的淀粉溶液,滴到蓝色消失呈淡红色即为终点。
④ 根据消耗的Na2S2O3溶液的量,计算钴的含量。
(4) 实验数据处理:
标定Na2S2O3溶液:
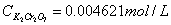
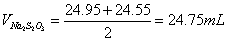
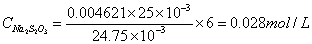
滴定样品:
数据记录

样品中 
即 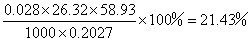
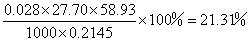
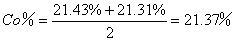
1mol样品中钴的物质的量=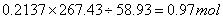
三 测定结果汇总
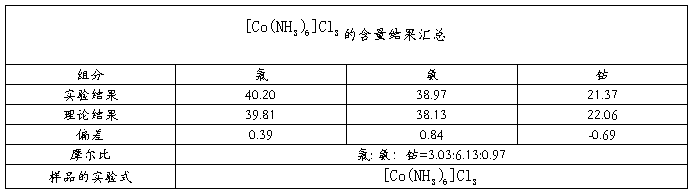
四、结果讨论与误差分析
1、样品产率低,原因有:
①氯化铵加热时过度和温水浴时会释放出氨气,导致产率的下降。
②冷水浴时不够完全,有部分固体没有析出或晶体析出后再溶解。
③抽滤时滤纸会粘附一部分,导致损失。
④在反应搅拌与产品烘干时,都会导致损失。
⑤加入的活性炭没有充分研磨,颗粒太大,催化效果差⑥过滤时速度太慢
2、通过对组分测定,氨、钴的含量偏高,氯的含量比较低。原因有:
①氨的测定中,滴定终点判断有偏差,导致实验数据的误差。
②钴的测定中,加淀粉时的黄色判断有点晚。
③钴的测定中,滴定管最后产生个小气泡,使Na2S2O3滴定的体积偏小,影响实验。
④氯的测定中,滴定终点不好把握,在没有达到终点时即停止滴定,导致
误差较大。
⑤产品中可能有其他物质,比如二氯化五氨合钴。
⑥在读数时存在误差。配制标准溶液的过程中存在误差,导致滴定不准确,影响结果的计算。
五、注意事项
1、三氯化六氨合钴的制备:
① CoCl2·6H2O溶解后加入活性炭冷却不能太慢,因为氯化铵在溶液中加热后会有氨气放出,活性炭在使前一定要充分研磨以提供较大的比表面积。
②加H2O2前必须降温处理,一是防止其分解,二是使反应温和的进行。
③加H2O2时要逐滴加入,不可太快,因为溶液中的物质会与H2O2反应,会使反应太剧烈,会产生爆炸。
④两次冰浴冷却要充分,有助于沉淀的析出,提高产率。
⑤趁热吸滤后加入6.7mL浓HCl是用同离子效应增加产率,若浓HCl加入过多,会因稀释作用而产生盐效应而使溶解度加大,从而降低产率。
2、三氯化六氨合钴组分的测定:
①分析天平称得质量要≥0.2g,因为分析天平的精确度为0.0001g,一次实验要称两次,误差为0.0002g,要求误差≤1‰,所以要大于0.2g。
②滴定管快滴定完时,要把悬浮的液体刮锥形瓶,减小误差。
③碘量瓶要用磨口塞子,防止碘的升华。
④碘量法测定钴,在碘量瓶中加入KI固体和HCl后应立即将碘量瓶转移至暗处。
 ⑤Cl的测定中,加入后产生砖红色,30秒不变色就为终点。
⑤Cl的测定中,加入后产生砖红色,30秒不变色就为终点。
六、思考题
1、氯化铵在制备三氯化六胺合钴中的作用是提供碱性环境,与氨水形成缓冲溶液。
2、活性炭的作用是催化剂,用来吸附反应物,提供大的比表面积。
3、逐滴加入是为了使活性炭充分吸附过氧化氢,使反应更加完全。
4、用冰浴冷却更有利于沉淀析出,提高产率。
5、趁热抽滤的作用是为了防止晶体析出,提高产率。此处应注意先加水再加浓盐酸,防止出现危险。
6、加浓盐酸是为了抑制产物水解,是运用了同离子效应的原理。当生成晶核的过程中,慢慢加入更有利于形成又大又好的晶体。
7、应注意趁热过滤的步骤影响产品质量和产率。
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
酸碱中和滴定实验预习报告
酸碱中和滴定和溶液配制实验预习报告实验原理c标V标c待V待实验目的1通过中和滴定实验掌握中和滴定实验操作方法2通过中和滴定实验理解…
-
滴定法实验总结报告
蒸馏后碱滴定法1原理亚硫酸盐在酸性条件下用碱中和加热亚硫酸盐被过氧化氢吸收用碱中和并滴定至终点根据消耗标液用量计算其含量H2O2H…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…
-
分析化学实验报告(武汉大学第五版)
分析化学实验报告陈峻贵州大学矿业学院贵州花溪550025摘要熟悉电子天平的原理和使用规则同时可以学习电子天平的基本操作和常用称量方…
-
分析化学实验 碱度的测定 实验报告
实验报告姓名班级同组人项目碱度的测定课程分析化学学号一实验目的1掌握酸碱滴定法测定碱度的原理和方法2掌握碱度测定结果的计算3熟练滴…
-
分析化学实验 过氧化氢含量的测定 实验报告
实验报告姓名班级同组人项目过氧化氢含量的测定课程分析化学学号一实验目的1了解高锰酸钾标准溶液的配制方法和保存条件2掌握以Na2C2…