空气、食品接触面微生物检验方法、检验标准
空气、食品接触面微生物检验方法、检验标准
1、 目的:
检测生产车间空气、操作人员手部、与食品有直接接触面的机械设备的微生物指标,生产区域环境当中病原微生物的监控,达到规定标准,以控制食品成品的质量。
2、 参照标准:
中华人民共和国国家标准《一次性使用卫生用品卫生标准》GB15979-1995、《HACCP原理与实施》、中华人民共和国国家标准《公共场所空气微生物检验方法细菌总数测定》GB/T 18204.1-2000、中华人民共和国进出口商品检验行业标准SN 0169-92/SN 0172-92/ SN 0170-92、 出入境检验检疫局二000四年《出入食品微生物检验培训教材》中《出入食品生产厂卫生细菌检验方法》、日本东京冷冻食品检验方法。
3、 采样与检测方法:
3.1空气的采样与测试方法
3.1.1样品采集:
(1)取样频率:
a)车间转换不同卫生要求的产品时,在加工前进行采样,以便了解车间卫生清扫消毒情况。 b)全厂统一放长假后,车间生产前,进行采样。
c)产品检验结果超内控标准时,应及时对车间进行采样,如有检验不合格点,整改后再进行采样检验。
d)实验性新产品,按客户规定频率采样检验。
e)正常生产状态的采样,每周一次。
(2)采样方法
在动态下进行,室内面积不超过30 m2,在对角线上设里、中、外三点,里、外点位置距墙1 m;室内面积超过30 m2,设东、西、南、北、中五点,周围4点距墙1 m。采样时,将含平板计数琼脂培养基的平板(直径9 cm)置采样点(约桌面高度),并避开空调、门窗等空气流通处,打开平皿盖,使平板在空气中暴露5 min。采样后必须尽快对样品进行相应指标的检测,送检时间不得超过6h,若样品保存于0~4℃条件时,送检时间不得超过24h。
3.1.2菌落培养:
(1)在采样前将准备好的平板计数琼脂培养基平板置37℃±1℃ 培养24 h,取出检查有无污染,将污染培养基剔除。
(2)将已采集样品的培养基在6 h内送实验室,细菌总数于37℃±1℃培养48h观察结果,计数平板上细菌菌落数。
(3)菌落计算:
a) 记录平均菌落数,用“个/皿”来报告结果。用肉眼直接计数,标记或在菌落计数器上点计,然后用5~10倍放大镜检查,不可遗漏。
b) 若培养皿上有2个或2个以上的菌落重叠,可分辨时仍以2 个或2个以上菌落计数。
3.2工作台(机械器具)表面与工人手表面采样与测试方法:
3.2.1样品采集:
(1)取样频率:
a)车间转换不同卫生要求的产品时,在加工前进行擦拭检验,以便了解车间卫生清扫消毒情况。
b)全厂统一放长假后,车间生产前,进行全面擦拭检验。
c)产品检验结果超内控标准时,应及时对车间可疑处进行擦拭,如有检验不合格点,整改后再进行擦拭检验。
d)实验新产品,按客户规定擦拭频率擦拭检验。
e)对工作表面消毒产生怀疑时,进行擦拭检验。
f)正常生产状态的擦拭,每周一次。
(2) 采样方法:
a) 工作台(机械器具):用浸有灭菌生理盐水的棉签在被检物体表面(取与食品直接接触或有一定影响的表面)取25cm2 的面积,在其内涂抹10次,然后剪去手接触部分棉棒,将棉签放入含10mL灭菌生理盐水的采样管内送检。
b) 工人手:被检人五指并拢,用浸湿生理盐水的棉签在右手指曲面,从指尖到指端来回涂擦10次,然后剪去手接触部分棉棒,将棉签放入含10mL灭菌生理盐水的采样管内送检。
(3)采样注意事项:
擦拭时棉签要随时转动,保证擦拭的准确性。对每个擦拭点应详细记录所在分场的具体位置、擦拭时间及所擦拭环节的消毒时间
3.2.2 细菌?大肠菌群的检测培养:
样液稀释:将放有棉棒的试管充分振摇。此液为1:10稀释液。如污染严重,可十倍递增稀释,吸取1ml 1:10样液加9ml无菌生理盐水中,混匀,此液为1:100稀释液。
3.2.2.1 细菌总数:
(1)以无菌操作,选择1~2个稀释度各取1ml样液分别注入到无菌平皿内,每个稀释度做两个平皿(平行样),将已融化冷至45℃左右的平板计数琼脂培养基倾入平皿,每皿约15ml,充分混合。
(2)待琼脂凝固后,将平皿翻转,置36℃±1℃ 培养48 h后计数。
(3)结果报告:报告每25cm2食品接触面中或每只手的菌落数
3.2.2.2大肠菌群:
(1)平板法:
a) 以无菌操作,选择1~2个稀释度各取1ml样液分别注入到无菌平皿内,每个稀释度做两个平皿(平行样),将已融化冷至45℃左右的去氧胆酸盐琼脂培养基倾入平皿,每皿约15ml,充分混合。待琼脂凝固后,再覆盖一层培养基,约3-5 ml。
b) 待琼脂凝固后,将平皿翻转,置36℃±1℃ 培养24h后计数。
c) 结果计算: 以平板上出现紫红色菌落的个数乘以稀释倍数得出。
d) 结果报告:报告每25cm2食品接触面中或每只手的菌落数
(2)试管法:
a) 以无菌操作,选择3个稀释度各取1ml样液分别接种到BGLB肉汤培养基中,每个稀释度接种三管。
b) 置BGLB肉汤管于36℃±1℃培养48±2h。记录所有BGLB肉汤管的产气管数。
c) 结果报告:按BGLB肉汤管产气管数,查MPN表报告每25cm2食品接触面中或每只手的大肠菌群值。
3.2.3 金黄色葡萄球菌检测
(1)定性检测
a) 取1ml 稀释液注入灭菌的平皿内,倾注15-20ml的B-P培养基,(或是吸取0.1稀释液,用L棒涂布于表面干燥的B-P琼脂平板),放进36±1℃的恒温箱内培养48±2小时。 b) 从每个平板上至少挑取1个可疑金黄色葡萄球菌的菌落作血浆凝固酶实验。
c) 结果报告:B-P琼脂平板的可疑菌落作血浆凝固酶实验为阳性,即报告手(工器具)上有金黄色葡萄球菌存在。
(2)定量检测
a) 以无菌操作,选择3个稀释度各取1ml样液分别接种到含10﹪氯化钠胰蛋白胨大豆肉汤
培养基中,每个稀释度接种三管。
b) 置肉汤管于36±1℃的恒温箱内培养48小时。划线接种于表面干燥的B-P琼脂平板,置36℃±1℃ 培养45~48小时。
c) 从B-P琼脂平板上,挑取典型或可疑金黄色葡萄球菌菌落接种肉汤培养基,36℃±1℃培养20~24小时。
d) 取肉汤培养物做血浆凝固酶试验,记录试验结果。
e) 报告结果:根据凝固酶试验结果,查MPN表报告每25 cm2食品接触面中或每只手的金黄色葡萄球菌值。
3.3工厂环境中病原体的检测计划与方法
检测计划:为了保证食品安全,工厂应该对生产环境中的病原微生物进行检测和评估,检测项目包括李斯特菌,沙门氏菌等病原体微生物,化验室应该按照一定的计划对生产场所环境中的病原体进行检测,其中包括地面、下水道、 排水沟、墙壁、天花板、设备框架、运输的支架,冷藏装置、速冻机、传送带、设备的螺丝、维修工具等部位。当某个点检测到病员微生物时,应该对环境中的相似点加大检测频率;在把所有的预定点检测完后,应该对环境中的病原微生物的存在状况进行全面评估,在下一次环境检测循环过程中加强检测容易出现病原体的环境点,达到持续改进的目的。
检测频率: 每月两次,每次每个区域至少选取5个检测点,分别进行检测。
3.3.1 环境李斯特菌的检测方法(3MTM PetrifilmTM 环境李斯特菌的测试片)
3.3.1.1 用涂抹棒,海绵或者其他采样设备收集环境样本。
3.3.1.2 将收集的样本添加10毫升灭菌的缓冲蛋白胨水,将样本与缓冲蛋白胨混合1分钟,将样品置于室温(20-30℃)1小时,最久不超过1.5小时,以修复损伤的李斯特菌。
3.3.1.3 将测试片放在平坦处,掀起上层膜。
3.3.1.4 用移液器垂直滴加3毫升样品到下层膜中央,将上层膜缓慢盖下,以免产生气泡。
3.3.1.5 轻轻将塑料压板放在位于接种区上层膜上,不要压,扭转或者滑动压板。提起压板等至少十分钟,以使胶体凝固。
3.3.1.6 将测试片透明面朝上,可叠放至十片,在37℃±1℃培养26-30小时,可以用标准菌落记数器或者其他光学放大器判读,不要记数圆形轮廓上的菌落,因为他们不受选择性培养基的影响。
3.3.1.7 对于定性检测,根据紫红色菌落是否存在,结果记为检出或者未检出。
3.3.2 环境中沙门氏菌的检测方法
3.3.2.1采样地点: 选取采样点时因尽量选取微生物容易滋生的地方
冷冻车间 FD车间
东区初加工 传递窗口表面、排水沟、
排水沟出口、墙壁、地面 卸料间 墙壁、墙角、地面、天花板、
物料车表面
东区精加工 地面、墙壁、墙角、排水沟、
排水沟出口、速动机链条、天花板 暂存间 墙壁、地面、天花板、墙角、墙缝 西区初加工 传递窗口表面、地面、墙壁、
排水沟、排水沟出口 挑选间 墙壁、地面、天花板、墙角、垫板
西区精加工 地面、墙壁、墙角、排水沟、排水沟出口、速动机链条、天花板 包装室 墙壁、地面、天花板、金探传送带表面、落地料存放处
3.3.2.2 操作步骤
3.3.2.2.1采样应在生产开始后进行,用已浸润过的棉拭在选定的被测表面旋转涂抹约100cm2的面积,然后将棉拭放回涂抹试管并盖紧。
3.3.2.2.2将样品带回实验室,每5个点混合成一个样品, 登记编号,按照SN0170-92标准及时检测,若有阳性结果出现,应逐步对所混合的每个点分别检测。
第二篇:食品微生物之检验方法-阪崎肠杆菌之检验
附件
食品微生物之檢驗方法-阪崎腸桿菌之檢驗
1
2 適用範圍〆本方法適用於一般食品及奶粉中阪崎腸桿菌之檢驗。 檢驗方法〆
2.1 工作環境〆工作平台須寬敞、潔淨、光線良好,操作平台光度為100呎燭光以上,密閉室內換
氣良好,儘可能沒有灰塵及流動空氣。每15分鐘落菌數不得超過15 CFU/培養皿。
2.2
2.2.1
2.2.2
2.2.3
2.2.4
2.2.5
2.2.6 器具及材料〆 乾熱滅菌器。 高壓滅菌釜。 攪拌均質器(Blender)或鐵胃(Stomacher)〆適用於無菌操作者。 天平〆可稱量到2000 g者,靈敏度為0.1 g々可稱量到120 g者,靈敏度為1 mg。 冰箱〆能維持5 ± 3℃者。 吸管或吸管尖〆已滅菌,1 mL吸管應有0.01 mL之刻度々5 mL及10 mL吸管應有0.1 mL
之刻度。
2.2.7
2.2.8 吸管輔助器(Pipette aid)或微量分注器。 稀釋瓶〆160 mL,玻璃、聚乙烯(polyethylene)、鐵弗龍(Teflon)或其他能耐121℃濕熱滅
菌20分鐘以上之塑膠材質,附螺旋蓋。
2.2.9 培養皿〆已滅菌,內徑約9 cm,深度約15 mm,底皿之內外面應平坦,無氣泡、刮傷或其
他缺點。
2.2.10 增菌用容器〆附螺旋蓋之125 mL、250 mL、2 L三角錐瓶或廣口瓶々玻璃、聚乙烯、鐵弗龍
或其他能耐121℃濕熱滅菌20分鐘以上之塑膠材質。
2.2.11
2.2.12
2.2.13
2.2.14 pH測定儀。 培養箱〆能維持內部溫度在± 1℃以內者。 溫度計〆量測溫度範圍1~55℃,最小刻度0.1℃。 水浴〆加蓋,具水流循環系統,能維持水溫溫差在 ± 0.2℃以內者。
2.2.15
2.2.16
2.2.17 接種針及接種環(直徑約3 mm)〆鎳鉻合金、鉑銥或鉻線材質,或可拋棄式者。 曲玻棒〆可滅菌者,直徑3~4 mm,塗抹區域45~55 mm。 試管〆10 × 100 mm,13 × 100 mm,13 × 120 mm,15 × 150 mm,16 × 150 mm試管,或
其他適用者。
2.2.18
2.2.19
2.2.20
2.2.21
2.2.22
2.2.23
2.2.24
2.2.25 旋渦混合器(Vortex mixer)。 顯微鏡〆能放大至1000倍以上之一般光學顯微鏡。 載玻片及蓋玻片〆適用於染色及鏡檢用。 研缽、杵。 藥勺、剪刀、小刀、鑷子〆可滅菌。 濾紙及褐色試藥瓶。 無菌濾膜〆孔徑0.45 μm或以下之親水性醋酸纖維膜。 杜蘭發酵管(Durham fermentation tube)〆外徑9 × 22 mm或其他適用者。
2.2.26 試藥〆氯化鈉、硫酸月桂酸鈉(sodium lauryl sulfate)、膽鹽No. 3(bile salts No. 3)、中性
紅(neutral red)、結晶紫(crystal violet)、檸檬酸鐵銨(ferric ammonium citrate)、去氧膽酸鈉(sodium desoxycholate)、硫代硫酸鈉(sodium thiosulfate)、草酸銨(ammonium oxalate)、碘化鉀、碘、沙黃O(safranin O)、對-二甲胺基苯甲醛(p-dimethyl aminobenzaldehyde)、四甲基對位苯二胺鹽酸鹽(N,N,N',N'-tetramethyl -ρ-phenylenediamine?2HCl)、磷酸二氫鈉(NaH2PO4?H2O)、硝基苯哌喃半乳糖苷(o-nitrophenyl-β-D-galactopyranoside, ONPG)、5-溴-4-氯-3-吲哚-α-D-哌喃葡萄糖苷(5-bromo-4-chloro-3-indolyl-α-D-glucopyranoside)、亮綠(brilliant green)、酚紅(phenol red)、溴甲酚紫(bromcresol purple)、溴麝香草藍(bromthymol blue)、肌酸(creatine)、甲基紅(methyl red)、α-萘酚(α-naphthol)、氫氧化鉀、95%乙醇、無水乙醇、戊醇(amyl alcohol)或異戊醇(isoamyl alcohol)、乳糖、蔗糖、半乳糖醇(dulcitol)、核糖醇(adonitol)、棉子糖(raffinose)、山梨醇(sorbitol)、阿拉伯糖醇(D-arabitol)、氰化鉀、氫氧化鈉、L-離胺酸(L-lysine)、L-鳥胺酸(L-ornithine)、L-精胺酸(L-arginine)、礦物油或液態石蠟油(paraffin oil)及鹽酸等均採用化學試藥級。
2.2.27 試劑〆
2.2.27.1 無菌蒸餾水〆
蒸餾水900 mL、90 mL、9 mL,分裝於增菌容器或試管中,以121℃滅菌15分鐘。
2.2.27.2 0.85%生理食鹽水〆
取氯化鈉8.5 g溶於1000 mL蒸餾水中,分裝於試管內,以121℃滅菌15分鐘。
2.2.27.3 柯瓦克氏試劑(Kovacs’ reagent)〆
取對-二甲胺基苯甲醛5 g溶於戊醇或異戊醇75 mL中,再徐徐加入鹽酸25 mL,混
合均勻後應呈黃色並須保存於4℃冰箱中。
2.2.27.4 甲基紅指示劑(Methyl red indicator)〆
取甲基紅0.1 g溶於95%乙醇300 mL後,再加蒸餾水使成500 mL。
2.2.27.5 歐普氏試劑(Voges-Proskauer test reagents, VP reagents)〆
溶液A〆取α-萘酚5 g溶於無水乙醇100 mL中。
溶液B〆取氫氧化鉀40 g溶於蒸餾水中,並使成100 mL。
2.2.27.6 0.5%氰化鉀溶液(0.5% potassium cyanide solution)〆
取氰化鉀0.5 g溶於無菌蒸餾水100 mL中(氰化鉀為劇毒物質,本操作務必在抽氣
櫃內進行)。
2.2.27.7 礦物油或液態石蠟油〆
取礦物油或液態石蠟油20~50 mL,裝入有蓋容器中約1/2滿,以121℃滅菌30分鐘。
2.2.27.8 革蘭氏染色液(Gram stain solution)〆
2.2.27.8.1 哈克氏(Hucker’s)結晶紫液(初染劑)〆
溶液A〆取結晶紫2 g溶於95%乙醇20 mL中。
溶液B〆取草酸銨0.8 g溶於蒸餾水80 mL中。
將溶液A與溶液B混合,靜置24小時後以濾紙過濾,取濾液作為初染劑。
2.2.27.8.2 革蘭氏碘液(媒染劑)〆
取碘化鉀2 g及碘1 g置於研砵中,經研磨5~10秒鐘後,加蒸餾水1 mL研磨,次加蒸餾
水5 mL研磨,再加蒸餾水10 mL,研磨至碘化鉀和碘完全溶於水中,將此溶液注入褐色瓶中,再以適量蒸餾水洗滌研砵及杵後,併入洗液,加蒸餾水使成300 mL。
2.2.27.8.3 哈克氏複染液(複染劑)〆
取沙黃O 2.5 g溶於95%乙醇100 mL中,供作複染原液。使用時,取原液10 mL加蒸餾水
90 mL,作為複染液。
註〆革蘭氏染色液因放久可能失效,因此若購買成品時,要注意其保存期限,若自行配製者應
檢查其染色效果。
2.2.27.9 氧化酶試劑(Oxidase reagent)〆
取四甲基對位苯二胺鹽酸鹽1 g溶於蒸餾水100 mL後,貯存於褐色瓶,並置入冰箱中,
使用期限以不超過1星期為宜。
2.2.27.10 1 M磷酸二氫鈉溶液〆
取磷酸二氫鈉6.9 g溶於蒸餾水45 mL中,徐徐注入30%氫氧化鈉溶液約3 mL,
調整pH值為7.0,續加入蒸餾水使成50 mL,貯存於4℃冰箱中備用。
2.2.27.11 硝基苯哌喃半乳糖試劑(ONPG reagent)〆
取硝基苯哌喃半乳糖80 mg溶於37℃蒸餾水15 mL中,再加入1 M磷酸二氫鈉溶
液5 mL,即為0.0133 M硝基苯哌喃半乳糖試劑,貯存於4℃冰箱中,使用時須加溫至
37℃。
2.2.28 培養基〆
2.2.28.1 蛋白腖緩衝液(Buffered peptone water, BPW)
蛋白腖(peptone) 10 g
氯化鈉(NaCl) 5 g
磷酸氫二鈉(Na2HPO4) 3.5 g
磷酸二氫鉀(KH2PO4) 1.5 g
蒸餾水 1000 mL
攪拌加熱溶解後,以121℃滅菌15分鐘,最終pH值為7.2 ± 0.2。
2.2.28.2 加鹽硫酸月桂酸胰化蛋白
胰化蛋白
培養液(Lauryl tryptose broth with 2% NaCl, 2% NaCl-LST) (tryptose) 20 g
5 g 乳糖(lactose)
磷酸二氫鉀(KH2PO4) 2.75 g
磷酸氫二鉀(K2HPO4) 2.75 g
氯化鈉(NaCl) 20 g
硫酸月桂酸鈉(sodium lauryl sulfate)
蒸餾水 1000 mL 0.1 g
加熱溶解後,分取10 mL注入裝有杜蘭發酵管之試管內,以121℃滅菌15分鐘,最終
pH值為6.8 ± 0.2。
2.2.28.3 紫紅膽鹽葡萄糖培養基(Violet red bile glucose agar, VRBG)
酵母抽出液(yeast extract) 3 g
蛋白腖(peptone) 7 g
氯化鈉(NaCl) 5 g
膽鹽No. 3(bile salts No. 3) 1.5 g
乳糖(lactose) 10 g
0.03 g 中性紅(neutral red)
結晶紫(crystal violet) 0.002 g
洋菜(agar) 15 g
葡萄糖(glucose) 10 g
蒸餾水 1000 mL
加熱至沸騰溶解,注意不可加熱過度。於45~50℃水浴中冷卻,最終pH值為7.4 ±
0.2。每培養皿注入約20 mL,凝固後確定表面乾燥後使用。配製後之培養基應放置於2~8℃冰箱中保存,但須於一個月內使用完畢。
2.2.28.4 阪崎腸桿菌培養基(Enterobacter sakazakii agar, ESA)
胰化蛋白腖(tryptone) 15 g
大豆蛋白腖(soya peptone) 5.0 g
氯化鈉(NaCl) 5.0 g
檸檬酸鐵銨(ferric ammonium citrate)
去氧膽酸鈉(sodium desoxycholate)
硫代硫酸鈉(Na2S2O3〃5H2O) 1.0 g 1.0 g 1.0 g
5-溴-4-氯-3-吲哚-α-D-哌喃葡萄糖苷
(5-bromo-4-chloro-3-indolyl-α-D-glucopyranoside)
洋菜(agar) 15 g
蒸餾水 1000 mL 0.1 g
攪拌加熱溶解後,以121℃,滅菌15分鐘,最終pH值為7.3 ± 0.2。冷卻至50℃,
每培養皿注入約20 mL,凝固後確定表面乾燥後使用。
2.2.28.5 腸內細菌科增菌培養液(Enterobacteriaceae enrichment broth, EE broth)
蛋白腖(peptone) 10 g
葡萄糖(glucose) 5 g
磷酸氫二鈉(Na2HPO4) 8 g
磷酸二氫鉀(KH2PO4) 2 g
牛膽鹽(ox-gall) 20 g
亮綠(brilliant green) 0.015 g
蒸餾水 1000 mL
加熱至沸騰溶解,注意不可加熱過度,最終pH值為7.2 ± 0.2。取90 mL注入約125
mL已滅菌之附蓋三角錐瓶或廣口瓶中,配置後之培養液應放置於2~8℃冰箱中保存,但須於一個月內使用完畢。
2.2.28.6 胰化酪蛋白大豆培養基(Trypticase soy agar, TSA)
胰化酪蛋白腖(trypticase peptone) 15.0 g
植物蛋白腖(phytone peptone)
氯化鈉(NaCl) 5.0 g 5.0 g
洋菜(agar) 15 g
蒸餾水 1000 mL
平板培養基配製方法〆攪拌加熱溶解後,以121℃滅菌15分鐘,最終pH值為7.3 ±
0.2。冷卻至50℃,每培養皿注入約20 mL,凝固後確定表面乾燥後使用々斜面培養基配製方法〆加熱溶解後,分取約5 mL注入試管,以121℃滅菌15分鐘,最終pH值為7.3 ± 0.2。滅菌後作成斜面培養基,斜面長度約4~5 cm,斜面底部之深度約2~3 cm。
2.2.28.7 尿素培養液(Urea broth)
尿素(urea) 20 g
酵母抽出物(yeast extract) 0.1 g
磷酸氫二鉀(K2HPO4) 9.1 g
磷酸氫二鈉(Na2HPO4) 9.5 g
酚紅(phenol red) 0.01 g
蒸餾水 1000 mL
溶解後,經孔徑0.45 μm濾膜過濾後,分取1.5~3 mL濾液,注入已滅菌之試管中,
最終pH值為6.8 ± 0.2。
2.2.28.8 運動性試驗培養基(Motility test medium)
牛肉抽出物(beef extract)
蛋白腖(peptone) 10 g
氯化鈉(NaCl) 5 g
洋菜(agar) 4 g
蒸餾水 1000 mL 3 g
加熱溶解後,分取約8 mL注入附有螺旋蓋試管中,以121℃滅菌15分鐘,最終pH
值為7.4 ± 0.2。
2.2.28.9 氰化鉀培養液(Potassium cyanide broth)
聚蛋白腖(polypeptone) 3 g
氯化鈉(NaCl) 5 g
磷酸二氫鉀(KH2PO4) 0.225 g
磷酸氫二鈉(Na2HPO4) 5.64 g
蒸餾水 1000 mL
溶解後,以121℃滅菌15分鐘,最終pH值為7.6 ± 0.2。冷卻後於抽氣櫃內以吸管
輔助器配合無菌操作,加入0.5%氰化鉀溶液15 mL,混合均勻,分取1~1.5 mL注入已滅菌之試管中,貯存於冰箱備用,貯存期限不得超過兩週(操作氰化鉀溶液時,需戴手套且不可用口吸取)。
2.2.28.10 胰化蛋白腖培養液(Tryptone broth)
胰化蛋白腖(tryptone)或胰化酪蛋白腖(trypticase)
蒸餾水 1000 mL 10 g
溶解後,分取約5 mL注入試管內,以121℃滅菌15分鐘,最終pH值為6.9 ± 0.2。
2.2.28.11 MR-VP培養液(MR-VP broth)
蛋白腖緩衝液粉末(buffered peptone-water powder) 7 g
葡萄糖(glucose) 5 g
磷酸氫二鉀(K2HPO4) 5 g
蒸餾水 1000 mL
溶解後,分取約10 mL注入試管中,以118~121℃滅菌15分鐘,最終pH值為6.9 ±
0.2。
2.2.28.12 溴甲酚紫培養液(Bromcresol purple broth)
蛋白腖(peptone) 10 g
牛肉抽出物(beef extract)
氯化鈉(NaCl) 5 g
溴甲酚紫(bromcresol purple) 0.04 g
蒸餾水 1000 mL 3 g
溶解後,分取約2.5 mL注入試管內,以121℃滅菌10分鐘,最終pH值為7.0 ± 0.2。
冷卻後,每管加入經0.2 μm孔徑濾膜過濾除菌之50%(w/v)蔗糖溶液0.278 ± 0.002 mL,使培養液中該糖之最終濃度為5%(w/v)。含半乳糖醇、核糖醇、棉子糖、山梨醇及阿拉伯糖醇之溴甲酚紫培養液配製方法亦同。
2.2.28.13 脫羧酶基礎培養液(Decarboxylase basal medium)
蛋白腖(peptone) 5 g
酵母抽出物(yeast extract) 3 g
葡萄糖(glucose) 1 g
溴甲酚紫(bromcresol purple) 0.02 g
蒸餾水 1000 mL
加熱攪拌溶解後,取L-離胺酸5 g溶解於上述之培養液中,混合均勻,分取適量注入
試管內,以121℃滅菌10分鐘,最終pH值為6.5 ± 0.2,使成離胺酸脫羧酶培養液。含L-精胺酸及L-鳥胺酸之脫羧酶培養液配製方法亦同。對照組之配製,除脫羧酶基礎培養液外,不需添加任何物質。
2.2.28.14 辛蒙斯檸檬酸鹽培養基(Simmons citrate agar)
氯化鈉(NaCl) 5 g
檸檬酸鈉(Na3C6H5O7) 2 g
磷酸氫二鉀(K2HPO4) 1 g
磷酸二氫銨(NH4H2PO4)
硫酸鎂(MgSO4) 0.2 g
溴麝香草藍(bromthymol blue)
洋菜(agar) 15 g
蒸餾水 1000 mL 0.08 g 1 g
加熱溶解後,分取約5 mL注入試管中,以121℃滅菌15分鐘,最終pH值為6.8 ± 0.2。
滅菌後作成斜面培養基,此斜面長度約4~5 cm,斜面底部深度約2~3 cm。
2.3 檢液之調製〆
2.3.1 奶粉檢體(包括嬰兒配方奶粉、特殊營養配方奶粉、幼童專用奶粉及成人奶粉)〆用振搖方
式,使充分均勻混合後,以已滅菌之藥勺或其他方便使用之用具,取100 g、10 g及1 g,分別加入內含預熱至45℃之無菌蒸餾水900 mL、90 mL及9 mL之2 L、250 mL及125 mL三角錐瓶中(三重複)。以上三角錐瓶得以其他耐濕熱滅菌之塑膠材質容器或玻璃試管替代,唯檢液體積以不超過容器總容量二分之一為原則。充分混合均勻,即為三階三瓶(管)之10倍稀釋檢液,於35℃培養18~24小時,供作檢液。因檢液於增菌培養過程可能產氣,故不可緊鎖螺旋瓶蓋(或試管蓋),宜維持鬆動但不脫落狀態。
2.3.2 液態食品檢體〆充分均勻混合後,取100 mL、10 mL及1 mL,分別加入內含900 mL、90 mL
及9 mL已滅菌之蛋白腖緩衝液。充分混合均勻,即為三階三瓶(管)之10倍稀釋檢液,於35℃培養18~24小時,供作檢液。
2.3.3
2.3.3.1 環境檢體或塗抹物檢體〆 環境檢體〆取1 g置於含2% NaCl-LST培養液10 mL之試管內,於44℃培養18~24小
時,供作檢液。
2.3.3.2 塗抺物檢體〆將塗抹棒之頭部置於已滅菌試管內,以無菌操作折(剪)斷塗抹物木柄,
添加蛋白腖緩衝液5 mL後,將試管蓋旋緊,於10秒內來回叩擊手心使其劇烈振盪(振
盪幅度需達15公分)50次,或以旋渦混合器充分振盪至塗抹物頭部之棉絮鬆開。取溶出
液1 mL置於含2% NaCl-LST培養液10 mL之試管內,於44℃培養18~24小時,供作檢
液。
或將塗抹棒之頭部置於含2% NaCl-LST培養液10 mL之試管內,以無菌操作折(剪)
斷塗抹物木柄,於44℃培養18~24小時,供作檢液。
2.4
2.4.1 鑑別試驗〆 選擇性增菌培養〆吸取2.3節之檢液10 mL,加入內盛有腸內細菌科增菌培養液90 mL之160
mL稀釋瓶中。混合均勻後於35℃培養18~24小時。
2.4.2 分離培養〆
2.4.2.1 方法一〆自2.4.1節之腸內細菌科增菌培養液中取一接種環量,在VRBG及ESA培養基表
面劃線後(二重複),於35℃培養18~24小時,觀察所形成菌落之形態。阪崎腸桿菌在
VRBG培養基上的典型菌落為外緣規則平整,呈淡粉紅色或紫紅色,外緣通常伴有紫紅
色之膽酸(bile acids)類物質沉殿環生成々阪崎腸桿菌在ESA培養基上的典型菌落為外
緣規則平整,呈綠色。自VRBG及ESA培養基上鉤取可疑菌落,劃線於TSA平板培養基,於35℃培養18~24小時後,進行下列初步生化試驗。
2.4.2.2 方法二〆自2.4.1節之腸內細菌科增菌培養液中吸取1 mL量,加入內盛有生理食鹽水9 mL
之試管中,進行系列稀釋,使增菌培養液稀釋至原來的10~10倍。每一管(含未稀釋-4-6
之培養液)分別以無菌吸管吸取0.1 mL量,以曲玻棒均勻塗於VRBG及ESA培養基上,於35℃培養18~24小時。自VRBG及ESA培養基上鉤取可疑菌落,劃線於TSA平板培
養基,於35℃培養18~24小時後,進行下列初步生化試驗。
2.4.3 混合菌株(Mixed culture)之純化〆將VRBG及ESA培養基上之未純化菌株,以四區劃法,
劃於VRBG或ESA培養基,於35℃培養18~24小時後,鉤取典型菌落,劃線於TSA平
板培養基,於35℃培養18~24小時後,進行下列初步生化試驗。
2.5
2.5.1 鑑定試驗〆 初步生化試驗〆
2.5.1.1 氧化酶試驗(Oxidase test)〆以無菌接種針挑取可疑菌株,塗抹於含有氧化酶試劑之濾紙
表面。10~15秒後變為深紫色者為正反應,否則為負反應,阪崎腸桿菌為氧化酶負反應。
2.5.1.2 黃色色素產生試驗(Yellow pigment production test)〆以無菌接種針挑取TSA平板培養基
上可疑菌株至少5株,分別劃於TSA斜面培養基上,以25℃培養48~72小時,觀察菌株
產生色素之情形。有黃色色素產生者為正反應,否則為負反應,阪崎腸桿菌為正反應。
2.5.1.3 尿素酶試驗(Urease test)〆以無菌接種針挑取可疑菌株,接種於尿素培養液內,於35℃
培養24 ± 2小時。由於未接種之尿素培養液偶爾會轉變為紫紅色,故試驗時應包括未接
種之培養液作為對照用。培養液由橘紅色轉變為紫紅色者為正反應,顏色不變者為負反
應,阪崎腸桿菌為負反應。
2.5.1.4 運動性試驗(Motility test)〆以無菌接種針挑取可疑菌株,穿刺接種於運動性試驗培養基
之表面中央點至深度0.5吋處。於35℃培養24小時後開始觀察直至48 ± 2小時。當測試
菌沿穿刺線呈放射線狀生長者為正反應,否則為負反應,阪崎腸桿菌為正反應。
2.5.1.5 革蘭氏染色(Gram stain)〆以無菌接種針挑取可疑菌株,劃於TSA斜面培養基上,於35
℃培養24 ± 2小時,依下列步驟進行革蘭氏染色後鏡檢。
(1)
(2) 鉤取菌體,於載玻片上製成薄抹片,風乾或微熱固定。 初染〆將已固定之抹片,用哈克氏結晶紫液染1分鐘後水洗,水洗時間應不超過5
秒鐘。
(3)
(4) 媒染〆加革蘭氏碘液作用1分鐘,水洗。 脫色〆以95%乙醇洗至不再有紫色褪出時,再以水洗,此步驟需時甚短,僅數秒即
可,惟視抹片之厚薄而定。
(5) 複染〆用哈克氏複染液複染30秒鐘,水洗。
(6)
(7) 自然風乾。 鏡檢〆呈現深紫色者為革蘭氏陽性菌,呈現淡紅色者為革蘭氏陰性菌。阪崎腸桿菌
為革蘭氏陰性、無莢膜、無芽孢之桿狀菌。
經上述試驗,判定為可疑阪崎腸桿菌者,自TSA培養基鉤菌,進行下列生化試驗確認。
2.5.2 生化試驗〆
2.5.2.1 硝基苯哌喃半乳糖苷試驗(ONPG test)〆鉤菌並置於含有已滅菌之0.85%生理食鹽水0.2 mL
之試管中,作成濃懸浮液後,再加入一片浸過硝基苯哌喃半乳糖苷試劑之紙錠,並輕輕
搖動後,於35℃培養6~24小時,紙錠變成黃色者為正反應,否則為負反應,阪崎腸桿
菌為正反應。
2.5.2.2 氰化鉀試驗(KCN test)〆鉤菌接種於氰化鉀培養液,以橡皮塞塞緊試管口,於35℃培養
24小時後開始觀察直至48 ± 2小時。培養液由清澈變為混濁者為正反應,否則為負反應,阪崎腸桿菌為正反應。
2.5.2.3 吲哚試驗(Indole test)〆鉤菌接種於胰化蛋白腖培養液中,於35℃培養48 ± 2小時後,
加入柯瓦克氏試劑0.2~0.3 mL,輕輕搖動後靜置約10分鐘,上層呈紅色者為正反應,否則為負反應,大部份阪崎腸桿菌為負反應。
2.5.2.4 歐普氏試驗(VP test)〆鉤菌接種於MR-VP培養液中,於35℃培養48 ± 2小時後,取培
養液1 mL至另一已滅菌之試管中,加入歐普氏試劑溶液A約0.6 mL及歐普氏試劑溶液B約0.2 mL後,再加入少許肌酸,振搖均勻,經2~4小時後觀察結果,呈現粉紅色至鮮紅者為正反應,否則為負反應,大部份阪崎腸桿菌為正反應。
2.5.2.5 甲基紅試驗(Methyl red test)〆將2.5.2.4節剩餘之MR-VP培養液於35℃再培養48 ± 2
小時後,取培養液5 mL至另一已滅菌試管中,加入甲基紅指示劑5~6滴,輕輕搖勻,
呈紅色者為正反應,否則為負反應,大部份阪崎腸桿菌為負反應。
2.5.2.6 檸檬酸鹽利用試驗(Citrate utilization test)〆鉤菌接種於辛蒙斯檸檬酸鹽斜面培養基,須
在斜面上作劃線及穿刺培養,於35℃培養96 ± 2小時。斜面上有菌體生長且培養基顏色由綠色變為藍色者為正反應,否則為負反應,阪崎腸桿菌為正反應。
2.5.2.7 精胺酸二水解酶試驗(Arginine dihydrolase test)〆鉤菌分別接種於精胺酸脫羧酶培養液及
脫羧酶基礎培養液中,接種後分別注入已滅菌之液態石蠟或礦物油覆蓋表面高約1~2
cm,需鬆蓋,於35℃培養4天,每24小時觀察一次。精胺酸脫羧酶培養液呈紫色,且脫羧酶基礎培養液呈黃色者為正反應,否則為負反應,阪崎腸桿菌為精胺酸二水解酶正反
應。
2.5.2.8 離胺酸脫羧酶試驗(Lysine decarboxylase test)〆鉤菌分別接種於離胺酸脫羧酶培養液及脫
羧酶基礎培養液中,接種後注入已滅菌之液態石蠟或礦物油覆蓋表面高約1~2 cm,需鬆
蓋,於35℃培養4天,每24小時觀察一次。離胺酸脫羧酶培養液呈紫色且脫羧酶基礎培養基呈黃色者為正反應,否則為負反應,阪崎腸桿菌為負反應。
2.5.2.9 鳥胺酸脫羧酶試驗(Ornithine decarboxylase test)〆鉤菌分別接種於鳥胺酸脫羧酶培養液及
脫羧酶基礎培養液中,接種後注入已滅菌之液態石蠟或礦物油覆蓋表面高約1~2 cm,需鬆蓋,於35℃培養4天,每24小時觀察一次。鳥胺酸脫羧酶培養液呈紫色,且脫羧酶基礎培養液呈黃色者為正反應,否則為負反應,阪崎腸桿菌為正反應。
2.5.2.10 發酵試驗(Fermentation test)〆鉤菌接種於分別含有蔗糖、半乳糖醇、核糖醇、棉子糖、
山梨醇及阿拉伯糖醇等糖類之溴甲酚紫培養液中,於35℃培養2~5天,每隔24小時觀察其發酵情形。培養液顏色由紫色轉變為黃色,產酸者為正反應。
2.6
判定〆阪崎腸桿菌陽性者,應符合表一及表二所列之結果。
表一、E. sakazakii、E. cloacae、E. aerogenes、E. agglomerans及E. gergoviae之生化反應

(1)
(1) + 表示所有菌株在1~2天內為正反應々[+] 表示大部分(89%以上)在1~4天內為正反
應々d表示依菌株而異(通常11~80 %為正反應)々- 表示所有菌株培養7天後皆為負反應々ND表示無可引用之資料。
表二、E. sakazakii、E. cloacae、E. aerogenes、E. agglomerans及E. gergoviae之發酵試驗
(1)
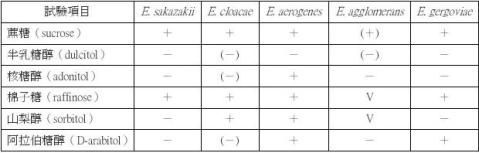
(1) + 表示90~100%為正反應々(+) 表示75~89%為正反應々V 表示25~74%為正反應々(-)
表示10~24%為正反應々- 表示0~9%為正反應。
2.7
最確數計算〆由2.6節判定為阪崎腸桿菌陽性者之各階瓶(管)數,利用接種量為每瓶(管)0.1, 0.01, 0.001(g或mL)之三階三瓶(管)最確數表(如附表),推算出阪崎腸桿菌之最確數(MPN/g或MPN/mL)。
附表 最確數表

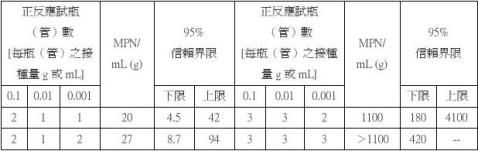
說明〆
經腸內細菌科增菌培養液增菌培養,劃線至VRBG及ESA培養基,並挑選可疑菌落進行鑑定試驗,
確認含有阪崎腸桿菌之試瓶(管)數若為3-3-2,對照MPN數為1100,則〆
(1) 若接種量為每瓶(管)含檢體0.1, 0.01, 0.001(g或mL),則該檢體阪崎腸桿菌之最確數為
1100(MPN/g或MPN/mL)。
(2) 若接種量為每瓶(管)含檢體100, 10, 1(g或mL),則該檢體阪崎腸桿菌之最確數應為
1100÷1000=1.1(MPN/g或MPN/mL)。
2.8
可參考使用經確效認可之市售培養基、生化檢測套組或生化試驗鑑定系統,惟檢驗結果有爭議時,應以傳統方法為準。
-
食品微生物 实验报告
霉菌的培养与形态学观察实验一真菌培养基的配制与灭菌实验目的1了解培养基的配置原理和方法掌握分离培养微生物的有关准备工作2掌握高压灭…
-
水及食品中微生物的检测(实验报告)
水及食品中微生物的检测食品微生物检验方法为食品监测必不可少的重要组成部分它不仅是衡量食品卫生质量的重要指标之一也是判定被检食品能否…
-
微生物综合实验报告
实验报告微生物综合实验报告姓名杨延景班级食品1101学号20xx040632黄河水利职业技术学院实验报告指导老师郭永目录项目一食品…
-
食品微生物学实验报告
常见微生物的分离培养与观察一,实验目的1,掌握显微镜的使用方法,操作原理。2,了解培养基的制备并掌握制备方法3,掌握杀菌锅杀菌方法…
-
食品微生物综合实验报告
食品微生物综合实验报告项目一食品中细菌总数的测定1项目二革兰氏染色技术5项目三饮用水中大肠菌群测定7指导老师郭永班级食品1002班…
-
食品微生物检验总结
1.食品微生物检验是应用微生物学的理论与方法,研究外界环境和食品中微生物的种类、数量、性质、活动规律、对人和动物健康的影响及其检验…
-
食品微生物学实验报告
常见微生物的分离培养与观察一,实验目的1,掌握显微镜的使用方法,操作原理。2,了解培养基的制备并掌握制备方法3,掌握杀菌锅杀菌方法…
-
微生物实验报告
金黄色葡萄球菌的分离提纯和鉴定实验一金黄色葡萄球菌的分离培养一实验目的1掌握BairdParker培养基的配制方法2掌握利用选择性…
-
微生物实验报告
实习报告XX学校2015年1月13日1、实习时间、地点和实习单位2、实习目的通过食品微生物检验实习,掌握培养基的配制、包扎及灭菌;…
-
微生物检验实习报告
实习报告实习名称系别年级专业学生姓名指导老师食品微生物检验实习11级食品科学与工程专业王磊1140905035王瑶琼吴菲菲黄大川邵…
-
动物微生物及免疫学(实践教学)实验报告
四川农业大学动物微生物及免疫学实践教学实验报告组长组员二零一二年四月1一实验目的一掌握一般培养基的制备原理及要求掌握培养基酸碱度的…