燃烧热的测定实验报告
一、实验名称:燃烧热的测定
二、实验目的
1、明确燃烧焓的定义,了解恒压燃烧热与恒容燃烧热的区别。
2、通过测定萘的燃烧热,掌握有关热化学实验的一般知识和技术。
3、掌握氧弹量热计的原理、构造及使用方法。
4、了解、掌握高压钢瓶的有关知识并能正确使用。
5、学会雷诺图解法校正温度改变值。
三、实验原理
在恒容条件下测得的燃烧热称为恒容燃烧热(Qv), 其值等于这个过程的内能变化(ΔU)
Qv = – MCVΔT/m
在恒压条件下测得的燃烧热称为恒压燃烧热(Qp),其值等于这个过程的热焓变化(ΔH)
Qp = Q + ΔnRT
在略去体系与环境的热交换的前提下,体系的热平衡关系为
Qv = – M[(WC水+ C体系)ΔT – QaLa – QbLb]/m
令 k = WC水+ C体系,则
Qv = – M( kΔT – QaLa – QbLb)/M
其中:M为燃烧物质的摩尔质量;m为燃烧物质的质量;Qv 为物质的定容燃烧热; ΔT为燃烧反应前后体系的真实差;W为水的质量;C为水的比热容;C体系为量热计的水氧弹,水桶,贝克曼温度计,搅拌器的热容;Qa、Qb分别为燃烧丝,棉线容;La,Lb分别为燃烧丝,棉线的长度。
在已知苯甲酸燃烧热值的情况下,我们通过实验可测出k的大小,用同样的方法我们就可以测出萘的燃烧热值Qv 。
仪器热容的求法是用已知燃烧焓的物质(如本实验用苯甲酸),放在量热计中燃烧,测其始、末温度,经雷诺校正后,按上式即可求出C。
雷诺校正:消除体系与环境间存在热交换造成的对体系温度变化的影响。方法:将燃烧前后历次观察的温度对时间作图,联成FHDG线如图4-1或者图4-2。图中H相当于开始燃烧之点,D点为观察到最高温度读数点,将H所对应的温度T1,D所对应的温度T2,计算其平均温度,过T点作横坐标的平行线,交FHDG线于一点,过该点作横坐标的垂线a,然后将FH线和GD线外延交a线于A、C两点,A点与C点所表示的温度差即为欲求温度的升高?T。图中AA’表示由环境辐射进来的热量和搅拌引进的能量而造成卡计温度的升高,必须扣除之。CC’表示卡计向环境辐射出热量和搅拌而造成卡计温度的降低,因此,需要加上,由此可见,AC两点的温度差是客观地表示了由于样品燃烧使卡计温度升高的数值

四、实验数据及处理:
(一) 热量计的水当量的测定
相关数据:
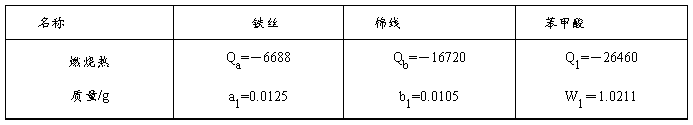
1. 作出苯甲酸燃烧的雷诺校正图,由图中得出燃烧前后温度升高
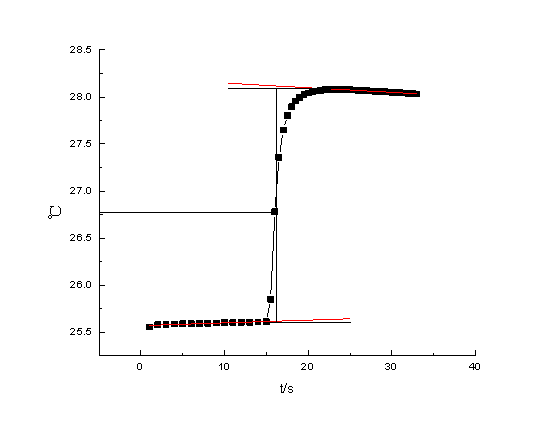
DT1=(28.12-25.59)℃ = 2.53℃
2. 求热量计的水当量C计:(r=1g/cm3,C水=4.184J /g ×℃)
C计=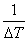 (-Q1W1-Qa× a1-Qb× b1)-3000r C水
(-Q1W1-Qa× a1-Qb× b1)-3000r C水
= 1/2.53 ×(26460×1.0211+6688×0.0125+16720×0.0105)-3000×1×4.184 =-1770.392 J /g ×℃
(二) 萘的燃烧热的测定
相关数据:
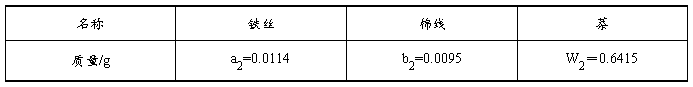
1. 萘燃烧的雷诺校正图,由图中得出燃烧前后温度升高
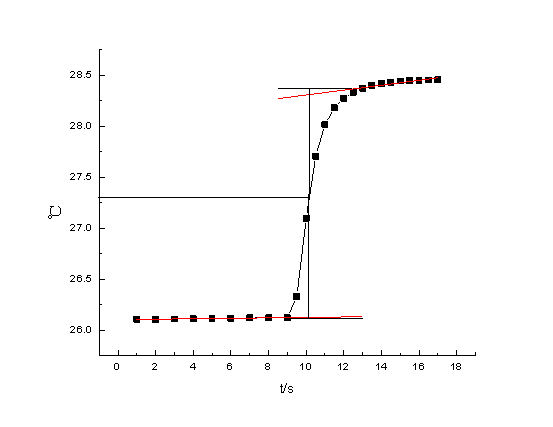
DT2=(28.48-26.02)℃ = 2.46℃
2.求萘的恒容燃烧热Qv(kJ× mol-1)
Qv=1/n2 [-Qa× a2-Qb× b2-(3000r C水+C计) ×DT2]
= 1/ (0.6415/128.18) ×[6688×0.0114+16720×0.0095-(3000×1×4.184 -1770.392) ×2.46]J× mol-1=-5248232.09J× mol-1 =-5248.232kJ× mol-1
五、讨论思考
1. 如何由萘的恒容燃烧热Qv(kJ× mol-1),求萘的恒压燃烧热Qp(kJ× mol-1),Qv与Qp的关系式中Dn是何含义,Dn =?
答:QP,m =QV,m + ∑vB ( g )RT=QV +ΔnRT ; Dn是指反应前后,生成物与反应物中气体的物质的量的差值。
2. 该实验成败的关键是什么?从结果看,你做得如何?
答:关键是:药品的量合适、压片松紧合适、雷诺温度校正。通过查表得, Qp (萘,25℃ )=-5153.8 kJ/mol, 实验求得Qp=-5253.187kJ/mol相对误差=(5253.187-5153.8)/5153.8*100%=1.93%,从实验结果看,本实验做得良好。
3、氧弹准备部分,引火丝和电极需注意什么?
答:引火丝与试样要紧密接触但不能碰到燃烧皿(防点火失败短路);电极也是不能碰到燃烧皿而且两电极不能靠近(以防短路)。
第二篇:乙醇燃烧热实验报告
燃烧热实验报告
一、实验目的
1、掌握氧弹式量热计的原理、构造及使用方法
2、了解计算机氧弹式量热计系统对燃烧热测定的应用
二、实验原理
燃烧热是指1摩尔物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧热称为恒容燃烧热(Qv,m),恒容燃烧热这个过程的内能变化(ΔrUm)。在恒压条件下测得的燃烧热称为恒压燃烧热(Qp,m),恒压燃烧热等于这个过程的热焓变化(ΔrHm)。若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式:
DcHm = Qp,m=Qv,m +ΔnRT (1)
本实验采用氧弹式量热计测量萘的燃烧热。测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。
氧弹是一个特制的不锈钢容器。为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。因此燃烧前后温度的变化值不能直接准确测量,而必须经过雷诺矫正作图法进行校正。
放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计)
量热原理—能量守恒定律
在盛有定水的容器中,样品物质的量为n摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C(通常称为仪器的水当量,即量热计及水每升高1K所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T1、T2,则此样品的恒容摩尔燃烧热为:
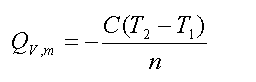
式中,Qv,m为样品的恒容摩尔燃烧热(J·mol-1);n为样品的摩尔数(mol);C为仪器的总热容(J·K-1或J /℃)。上述公式是最理想、最简单的情况。
但是,由于(1):氧弹量热计不可能完全绝热,热漏在所难免。因此,燃烧前后温度的变化不能直接用测到的燃烧前后的温度差来计算,必须经过合理的雷诺校正才能得到准确的温差变化。(2)多数物质不能自燃,如本实验所用萘,必须借助电流引燃点火丝,再引起萘的燃烧,因此,等式(2)左边必须把点火丝燃烧所放热量考虑进去就如等式(3):

式中:m点火丝为点火丝的质量,Q点火丝为点火丝的燃烧热,为-6694.4 J / g,DT为校正后的温度升高值。
仪器热容的求法是用已知燃烧焓的物质(如本实验用苯甲酸),放在量热计中燃烧,测其始、末温度,经雷诺校正后,按上式即可求出C。
雷诺校正:消除体系与环境间存在热交换造成的对体系温度变化的影响。方法:将燃烧前后历次观察的贝氏温度计读数对时间作图,联成FHDG线如图2-1-2。图中H相当于开始燃烧之点,D点为观察到最高温度读数点,将H所对应的温度T1,D所对应的温度T2,计算其平均温度,过T点作横坐标的平行线,交FHDG线于一点,过该点作横坐标的垂线a,然后将FH线和GD线外延交a线于A、C两点,A点与C点所表示的温度差即为欲求温度的升高DT。图中AA’表示由环境辐射进来的热量和搅拌引进的能量而造成卡计温度的升高,必须扣除之。CC’表示卡计向环境辐射出热量和搅拌而造成卡计温度的降低,因此,需要加上,由此可见,AC两点的温度差是客观地表示了由于样品燃烧使卡计温度升高的数值

有时卡计的绝热情况良好,热漏小,而搅拌器功率大,不断稍微引进热量,使得燃烧后的最高点不出现,如图2-1-3,这种情况下DT仍可以按同法校正之。
三、实验步骤
1、把氧弹的弹头放在弹头架上,然后将一段约10cm长的铁丝两端固定在弹头中的两根电极上,注意铁丝不能与坩埚壁相碰。将样品置于坩埚中铁丝上,保证两者接触。把弹头放入氧弹套筒内,拧紧弹盖,充入高压氧气。
2、打开精密温度温差仪电源,将传感器插入外桶中测外桶水温,用塑料大量杯取约3500ml自来水,加冰水调节使其低于外桶水温约0.5-1.0℃左右,之后用容量瓶准确取3000ml已调节好的自来水注入内桶。将电极插头插在氧弹两电极上,盖上量热计盖子,将传感器插入内桶水中,打开量热计电源,开启搅拌器,进行搅拌。待水温基本稳定后,将温差仪“采零”并“锁定”,然后将传感器取出放入外桶中,当温差数据基本稳定后,读取温差值,即为所需外桶水温值t(℃),再将传感器取出插入内桶水中。
3、开启计算机,双击“燃烧热测定”图标打开程序,点击“开始绘图”,系统自动每隔15秒采集一次温差数据,持续10min。然后按“点火”按钮,若点火成功,水温很快上升,当温差数据基本稳定时,在持续采集数据10min。然后点击“停止绘图”
4、停止实验,关闭量热计电源,将传感器放入外桶,取出氧弹,用放气阀放出氧弹内的余气。旋开氧弹盖,检查样品燃烧情况。若没有完全燃烧,须重做。取出内桶,倒去自来水,擦干氧弹和桶,待下次使用。
四、注意事项
1、为避免腐蚀,必须清洗氧弹。
2、点火成败是实验关键,实验前应仔细安装点火丝。点火丝不应与弹体内壁接触,避免点火后发生短路。
3、实验结束后,一定要把未燃烧的铁丝重量从公式中减掉。
五.数据处理
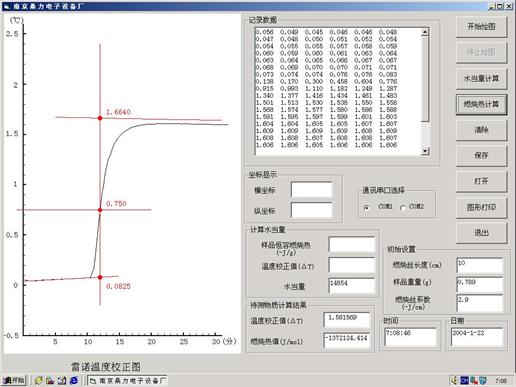
六、讨论分析
1、实验结果讨论分析
(1) 实验误差计算
查表得,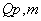 (乙醇,25℃ )= -1366.8kJ/mol
(乙醇,25℃ )= -1366.8kJ/mol
相对误差 0.387%
0.387%
(2)实验误差来源分析
i. 转移乙醇时有部分洒落,或者有部分挥发
ii. 系统绝热效果:系统并不是理想的绝对绝热,可能引入误差。
iii. 搅拌器功率较大,搅拌器不断引进的能量引入误差。
2、实验过程等讨论
(1) 注意事项
i. 安装热量计时,插入精密电子温差测量仪上的测温探头,注意既不要和氧弹接触,又不要和内筒壁接触,使导线从盖孔中出来,接触了对测温造成误差。防止电极短路,保证电流通过点火线。
ii. 氧弹充气不离人,一只手始终抓住充气阀,以免意外情况下弹盖或阀门向外冲出。
iii.热量计的绝热性能应该良好,但如果存在有热漏,漏入的热量造成误差;搅拌器功率较大,搅拌器不断引进的能量形成误差。
思考题
1、实验测量得到的温度差值为何要经过雷诺作图校正,还有那些误差来源会影响测量结果。
答:内水桶不是完全绝热,体系和环境之间的热交换途径有:传导、对流、辐射、蒸发和机械搅拌。为了校正这部分损失,用雷诺图解法进行校正。其他误差来源在结果讨论中已讨论。
2、测量燃烧热两个关键要求是什么?如何达到?
答:1、实验系统绝热 2、样品完全燃烧以及放出的热完全被吸收。保证系统绝热良好效果采用本实验外槽恒温式氧弹卡计,而样品完全燃烧需要保证样品的压片质量要高,以及充氧要充分。
-
燃烧热的测定实验报告
实验二燃烧热的测定一、目的要求1.用氧弹量热计测定萘的燃烧热。2.了解氧弹量热计的原理、构造及使用方法。二、实验原理1摩尔物质完全…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
燃烧热的测定实验报告 20xx.11.9
华南师范大学实验报告一、实验目的1.明确燃烧热的定义,了解恒压燃烧热和恒容燃烧热的差别和联系;2.掌握量热技术的基本原理,学会测定…
-
一、燃烧焓的测定实验报告
物理化学实验报告实验名称学院专业班级姓名指导教师日期燃烧焓的测定学号一实验目的1用氧弹式量热计测定萘的燃烧焓2明确燃烧焓的定义了解…
-
燃烧热的测定 实验报告
燃烧热的测定一、实验目的●使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并由此求算其摩尔燃烧热。●了解氧弹式量热计的结构及各…
-
大学物理化学实验报告-燃烧热的测定
物理化学实验报告院系化学化工学院班级化学061学号13姓名实验名称燃烧热的测定日期20##.5.20同组者姓名室温气压成绩一、目的…
-
物化实验报告燃烧热的测定
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目燃烧热的测定实验类型验证设计综合实验时间20xx年…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
华师物化实验报告 燃烧热的测定
华南师范大学实验报告学生姓名学号专业年级班级课程名称实验项目燃烧热的测定实验类型验证设计综合实验时间年月日实验指导老师实验评分一实…
-
燃烧热的测定实验报告
浙江万里学院生物与环境学院化学工程实验技术实验报告实验名称燃烧热的测定1一实验预习30分1实验装置预习10分年月日指导教师签字成绩…
-
燃烧热的测定实验报告
实验二燃烧热的测定一、目的要求1.用氧弹量热计测定萘的燃烧热。2.了解氧弹量热计的原理、构造及使用方法。二、实验原理1摩尔物质完全…