实验四 燃烧热的测定
深 圳 大 学 实 验 报 告
课程名称: 物理化学实验( 1)
实验项目名称: 实验四 燃烧热的测定
学院: 化学与化工学院
专业:
指导教师:
报告人: 学号 班级:
实验时间: 2012.03.20
实验报告提交时间: 2012.04.01
教务部制
实验四 燃烧热的测定
Ⅰ、目的要求
一、用数字式氧弹热量计测定样品的燃烧热。
二、明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的差别。
三、了解热量计中主要部分的作用,掌握数字式氧弹热量计的实验技术。 Ⅱ、实验原理
根据热化学的定义,1mol物质完全氧化时的反应热称作燃烧热。量热法是热力学的一个基本实验方法。在恒温或恒压条件下,可以分别测得亨容燃烧热Qv和恒压热容QP。由热力学第一定律可知,Qv等于体系内能ΔU变化;等于其焓变ΔH。若把参加反应的气体和反应生成的气体都作为理想气体处理,则它们之间存在以下关系:
ΔH=ΔU+Δ(PV) -----------------------------------(1)
QP = QV + ΔnRT ----------------------------------(2)
氧弹热量计的基本原理是能量守恒定律。样品完全燃烧所释放的能量使得氧弹本身及其周围的介质和有关附件的温度升高。测量介质在燃烧前后温度的变化值,就可以求算该样品的恒容燃烧热。关系式如下:

式中,W样和M分别为样品的质量和摩尔质量;QV为样品的恒容燃烧热;l和Ql是引燃用铁丝的长度和单位长度燃烧热,W水和C水是以水为测量介质时,水的质量和比热容;C计称为热量计的水当量,即除水之外,热量计升高1℃所需要的热量。ΔT为样品燃烧前后水温的变化值。实际上,热量计于周围环境的热交换无法完全避免,它对温差测量值的影响可用雷诺温度校正图校正。
Ⅲ、仪器与试剂

Ⅳ、实验步骤
(1)、仪器准备
开启ZDW-1A精密数字温差测量仪的电源开关,温度探头放入热量计外桶内。开启计算机电源,进入Windows操作系统。大烧杯中盛约800ml自来水,并放入3块冰块。
(2)、样品准备
剪取10cm长的点火丝,将其两端放入氧弹弹盖上的点火电极的槽缝内,滑下电极上方的套圈,将点火丝固定。
将燃烧皿放在电子天平的托盘上,关闭天平门,待天平读数稳定后,按下“ON”键,天平读数复零。小心地往燃烧皿中滴入约0.7克样品,关闭天平门,精确读取样品重量,记录。 将装有样品的燃烧皿放入点火电极的铁圈内。用镊子整理点火丝的形状,使点火丝的中间部分浸入样品中。将弹盖放在弹体上,旋紧。在教师的指导下,向氧弹内充入1.8 Mpa的氧气约1分钟。小心地将氧弹放入热量计的内桶内。
将先前预备的冷水注入2000ml容量瓶中,再加自来水至刻度。另一1000ml容量瓶,也加自来水至刻度。将此3000ml自来水注入热量计的内桶。插上(勿旋转)点火电源的插头。盖上热量计的胶木盖。按下HR-15热量计通用电控箱的电源开关,指示灯亮,按下“搅拌”按钮,开始搅拌。
(3)、测量 点击电脑“开始”→“程序”→“热量计”,进入热量计主菜单。选择“发热量测定”,点击“确定”,进入发热量测定菜单。输入样品的重量(质量)。其余各个选项应该为:样品名:Text21;分子量:74;点火热:150J;仪器热容:14600 J/℃,若无变化,不用修改。阅读菜单右边的说明后再点击“确定”,进入测定窗口。接下来,遵照电脑的提示操作。在测量了“末期”的6个数据后,电脑会弹出提示,此时,取出温度探头并记录“热容值”、“燃烧热 J/g”、“燃烧热 J/mol”、“冷却校正值”、“温差+校正”等实验数据。点击“数据存盘”,输入文件名,文件名为实验者姓名的汉语拼音。点击“退出”。
(4)、整理工作
关闭搅拌,打开热量计胶木盖,拔下点火电源插头,取出氧弹,排去废气,检查燃烧是否完全。将热量计内桶的水倒去并放回原处。
Ⅴ、数据记录及其处理
氧弹卡计测量的是样品的恒容热值Qv,应换算成恒压热值Qp:
根据燃烧反应
C4H9OH(l) + 6.5 O2(g) ====== 4 CO2(g) + 5H2O(l)
计算样品的Qp Qp=Qv+ΔnRT= Qv-2.5RT
查阅文献数据,计算实验误差。
文献值: Qp=2675.8kJ/mol
[引自Robert C. Weast. CRC handbook of Chem and Phys. 63th D-280 (1982-1983)]
(1)实验数据记录:
样品名称:正丁醇 样品质量:0.7032g 室内环境温度:26.1℃,即299.2K

(2)实验现象记录:
实验样品为无色液体,实验热量计的内桶水温低于室温1℃左右,起初初期温度差不断变化,当程序窗口弹出“已点火”窗口时,氧弹卡计内有“咝咝”声响发出,进入主期,温度数值急剧上升,实验结束,检查得出氧弹头及氧弹壳内有无色液体及雾气,燃烧皿内无液体,很干燥,有黑色痕迹及一小段未燃烧尽的燃烧丝,为1cm左右。
(3)将本次实验所得到的温度差绘制成曲线图如下图所示:


(4)数据处理如下:
Qp=Qv+ΔnRT= Qv-2.5RT
=-2574286.8J/mol-[2.5×8.314×(299.2可)]J/mol
=2580505.7 J/mol=2580.1kJ/mol
绝对误差:E=χ-χT =-2568.1kJ/mol-(-2675.8kJ/mo)l=﹣95.7 kJ/mol
相对误差:Er=E/χT =﹣95.7 kJ/mol÷2675.8kJ/mol=﹣3.58%
Ⅶ 实验讨论与分析
实验成功的关键是样品点燃及燃烧完全与否,且装样充氧气中注意燃烧皿的干净,燃烧丝不能与金属器皿接触,以免增大电阻,氧气要充分,不足会导致实验的失败。由上数据及绘制的图知道实验是成功的,主要在于燃烧丝与金属器皿没有接触,保证了两极的良好接触,点火丝与样品的接触也是良好的。相对误差为﹣3.58%,原因有正丁醇会挥发,装样不够迅速少量样品挥发损耗,未燃尽的点火丝也是原因之一。但相对而言,结果是满意的,由实验数据及绘制的图知道装置的绝热性能良好,热漏很小,结果客观表明了样品燃烧的情况。

注:1、报告内的项目或内容设置,可根据实际情况加以调整和补充。
2、教师批改学生实验报告时间应在学生提交实验报告时间后10日内。
第二篇:实验四报告燃烧热的测定
燃烧热的测定
摘要:恒容和恒压燃烧热是理想绝热条件下的测量量,本实验通过对萘燃烧热的测量证明,通过使用雷诺校正图,完全可以在常规仪器条件下,求出较为精确的燃烧热值。 关键词:燃烧热 量热计 萘 雷诺校正
1 前言
1.1反应原理和公式
要测定萘的燃烧热,需要确定量热卡计每升高一度所需要的热量,本实验以苯甲酸为标准物质加以测量,其恒容燃烧时放出的热量为26460 J·g-1。实验中将苯甲酸压片准确称量并扣除Cu-Ni合金丝的质量后与该数值的乘积即为所用苯甲酸完全燃烧放出的热量。实验中,苯甲酸燃烧所放出的热量和Cu-Ni合金丝燃烧时放出的热量总和将一并传导到氧弹卡计使其升温。根据能量守恒原理,物质燃烧放出的热量全部被氧弹及周围的介质(本实验以3000毫升水为主)等所吸收,得到温度的变化为△T,所以氧弹卡计的热容为:
C卡
其中: ?卡mQV?2.9lQ? ?T?T
m为苯甲酸的质量(准确到10?5g)
l为燃烧掉的Cu-Ni合金丝的长度(cm)
2.9为每厘米Cu-Ni合金丝燃烧放出的热量单位(J·cm-1) 据此,可算出待测物质的恒容燃烧热
Q
然后根据
Q?Q??n(RT) pvv(待测)?(C卡?T?2.9l)/m待测物质的质量?M
求出萘的恒压燃烧热。
1.2用雷诺作图法校正?T
由于实验过程中不可避免的存在着环境与体系间的热量传递,我们不能准确地由温差测定仪上读出由于燃烧反应所引起的温度变化ΔT。故采用雷诺图校正实验结果。
如图1-1所示,将燃烧前后所观察到的水温对时间作图,可联成FHIDG折线。左图中H相当于点火点。D为观察到的最高温度。在温度为室温处作平行于时间轴的虚线,交折线FHIDG于I点。(图上未标明,在曲线中间)过I点作垂直于时间轴的ab线。然后将FH线外延交ab线于A点。将GD线外延,交ab线于C点。则AC两点间的距离即为?T。图中AA′为开始燃烧到温度升至室温这一段时间?t1内,由环境辐射进来以及搅拌所引进的能量而造成量热计的温度升高。它应予以扣除之。CC′为温度由室温升高到最高点D这一段时间?t2内,量热计向环境辐射而造成本身温度的降低。它应予以补偿之。因此AC可较客观的反应出由于燃烧反应所引起量热计的温升。在某些情况下,量热计的绝热性能良好,热漏很小,而搅拌器的功率较大,不断引进能量使得曲线不出现极高温度点。 注意,应用这种作图法进行校正时,要控制上下两块封闭曲线面积大小相等,这样才能尽量抵消。
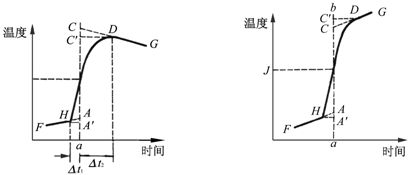
图1-1 雷诺校正图
2 实验
2.1 实验仪器和试剂
氧弹式量热计HR-15B 1套
温差测定仪 1台
拨动开关 1只
压片机 1台
调压变压器 2个
氧气钢瓶
氧气减压器 1个
万用表 1个
充氧导管 1个
Cu-Ni合金丝 若干
容量瓶 1000ml与2000ml各1
萘(分析纯)
苯甲酸(分析纯)
2.2主要仪器介绍:
本实验采用南京南大万和科技有限公司生产的氧弹式量热计HR-15B。如图
2.2-1所示,内筒C以内的部分为仪器的主体,即为本实验研究的体系,体系C与外界以空气层B绝热,下方有绝缘的垫片4架起,上方有绝热胶板5敷盖。为了减少对流和蒸发,减少热辐射及控制环境温度恒定,体系外围包有温度与体系相近的水套A。为了使体系温度很快达到均匀,还装有搅拌器2,由马达6带动。为了准确测量温度的变化,我们由精密的温差测定仪来实现。实验中把温差测定仪的热敏探头插入研究体系内,便可直接准确读出反应过程中每一时刻体系温度的相对值。样品燃烧的点火由一拨动开关接入可调变压器来实现,设定电压在24V进行点火燃烧。
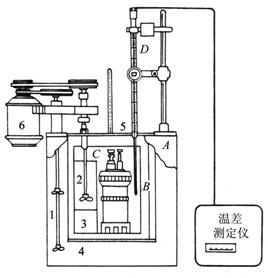
图2.2-1 氧弹卡计安装示意图
如图2.2-2,氧弹是用不锈钢制成的,主要部分有厚壁圆筒1、弹盖2和螺帽3紧密相连;在弹盖2上装有用来充入氧气的进气孔4、排气孔5和电极6,电极直通弹体内部,同时作为燃烧皿7的支架;为了将火焰反射向下而使弹体温度均匀,在另一电极8(同时也是进气管)的上方还有火焰遮板9。
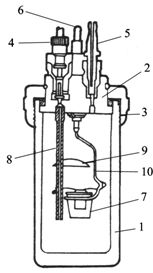
图2.2-2 氧弹的构造
2.3 实验方法
1 将苯甲酸与已知长度合金丝放在压片机上压成圆片。
2 将压片制成的样品放在干净的滤纸上,小心除掉易脱落部分,然后在分析天平上精确称量。
3 安装热量计时,插入精密电子温差测量仪上的测温探头。
4 在-1.1度时开启温差读取程序,10分钟后点火,待温差达最高点后,继续读取10分钟。
5从热量计中取出氧弹,取下氧弹盖,称取剩余合金丝质量。
6 重复以上过程,对萘进行测量,萘是在-0.8度时开始读取数据。
6 实验结束后,使用雷诺图校正温差,计算萘的燃烧热。
3 实验结果与数据分析
QV??(5.16?0.06)?106J?mol?1?K?1
QP??(5.15?0.06)?106J?mol?1?K?1
参考文献,查得萘的恒压燃烧热-5153.8KJ/mol
由于计算过程中受限于某些值的精度,本实验仅取到小数点后两位,但有效值部分与文献资料基本相符,估测绝对误差不会超过(5.153-5.145)?106J/mol=8KJ 相对误差最大值不会超过
8?5153=0.16%吻合状况良好。
4 误差分析
本实验的结果与文献值较为吻合,相对误差较小,严格控制在仪器本身不确定度以内,与实验事实较为吻合。现对本实验误差分析如下:
4.1 实验过程中由于实验操作引起的误差。
(1)本实验中,用到了3000ml水浴控制温度,在调节温差的过程中,多次使用移液管移取冰水或热水与盛水桶中的水进行交换,移取过程中不可避免的引入了一定的体积误差,对实验结果造成一定影响。
(2)本实验要求实验者在高压氧弹中放入少量水,以保证反应产生的水处于液态。由于笔者本身的失误,在两次测量中,均在高压氧弹中放入了过多的水,对实验的热容测量引入了一些误差。
(3)此外,压片前后,药剂的少许洒落,和对反应后合金丝残余物的收集不足,同样会引入一定的误差。
4.2 数据处理中的误差
在本实验的后期数据处理工作中涉及到了多次曲线的拟合,而对拟合部分数据的选取和拟合产生的曲线函数有效位数的保留,相应都会对最终结果产生一定影响,而在曲线上点的读取方面也产生了一定误差。
4.3 实验本身存在的一些问题
(1)本实验中引入了雷诺校正图进行了温差校正,而雷诺校正的使用效果与上下部分热差的抵消有关,若不能保证温差0点处于最高温度和最低温度之间,也会产生一定不利影响。
(2)由于温差读取程序的问题,笔者发现,自动记录的数据因互相覆盖而无法使用,不得不使用手动记录的数据。由于手工记录数据间隔30s,曲线拟合不够
理想,可能对实验精度产生了一些不利影响。
5 结论
燃烧热通常较为难以测定,通过本实验发现,利用雷诺图进行温差校正,完全可以取得良好的精度。
6 参考文献
【1】付献彩,沈文霞,姚天扬,侯文华 《物理化学》上册 高等教育出版社
The measurement of heat of combustion
Hu Jingya
School of Earth & Space Sciences, University of Science & Technology of China Abstract: The value of the heat of combustion can be difficult to measure because it is relevant to heat insulation. This experience prove that one can get relatively ideal results with common apparatus by using renault correction.
Key words:heat of combustion Calorimeter renault correction Naphthalene
关于原始数据
由于数据采集程序故障,实验使用了手写数据,具体内容,见orj文件 合金丝密度0.9983g/cm
萘的摩尔质量128.17 g/mol
苯甲酸部分中
苯甲酸+合金丝的质量=0.8384g
反应前合金丝的质量=0.0154g
反应后合金丝的质量=0.0140g
萘部分中
萘+合金丝的质量=0.8444g
反应前合金丝的质量=0.0147g
反应后合金丝的质量=0.0116g
1 计算C卡
下图为苯甲酸的雷诺校正图,读取图上温度差为0时的时间为11.78min
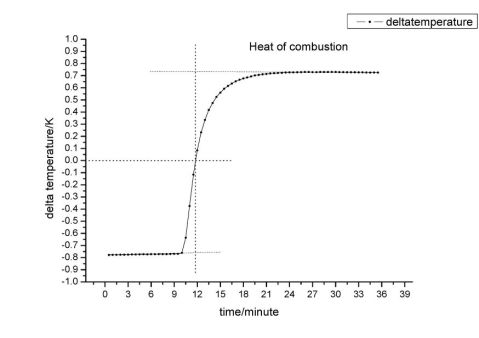
下图为苯甲酸开始阶段温度变化曲线,函数为y=9.65?10?4x-0.778,带入x1=11.78min,求出y1
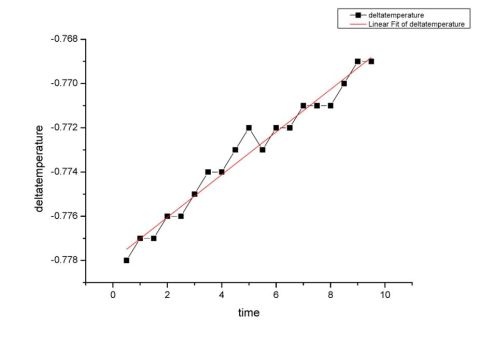
= -0.767K
下图为苯甲酸结束阶段温度变化曲线,函数为y=-7.41?10?4x+0.752,带入x2=11.78min,求出y2=0.743K
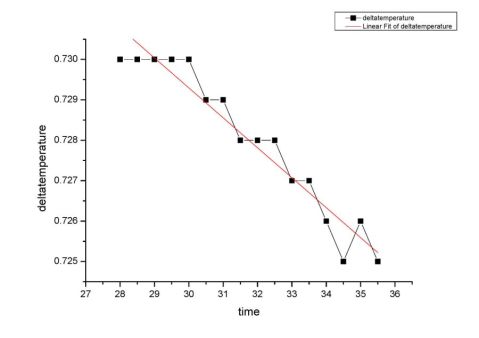
求出苯甲酸燃烧最大温差为y2-y1=0.743K-(-0.767K)=1.50K 反应的苯甲酸的质量0.8384g-0.0154g=0.8230g
反应的合金丝的质量1000(0.0154-0.0140)/0.9983cm=1.40cm 已知苯甲酸燃烧热26460J/g
带入计算公式
C卡?
卡mQV?2.9lQ?=1.44?104J/K ?T?T
2 计算萘的恒容和恒压燃烧热
下图为萘的雷诺校正图,读取图上温度差为0时的时间为
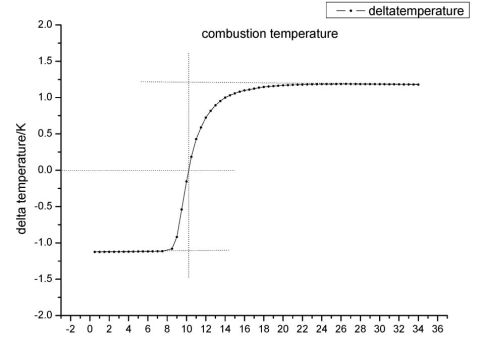
10.23min
下图为萘的燃烧初始部分图像,其函数为y=0.0014x-1.126,当x3=10.23min时,y3

=-1.11K
下图为萘燃烧结束阶段的部分图像,其函数为y=-0.0011x+1.217,当x4=10.23min时,y4
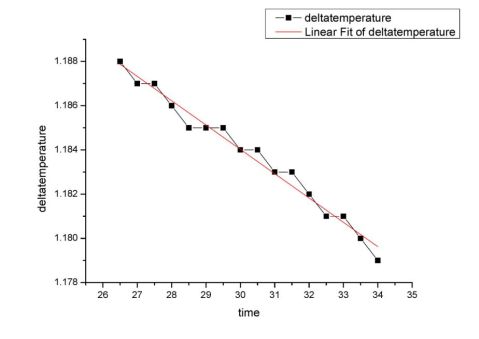
=1.21K
求出萘燃烧最大温差为y4- y3=1.21K-(-1.11K)=2.32K
反应的萘的质量 0.8444g-0.0147g= 0.8297g
反应的合金丝的质量1000(0.0147-0.0116)/0.9983cm=.3.11cm
已知萘的摩尔质量

128.17 g/mol 带入计算公式,求出萘的恒容燃烧热
Qv(待测)?(C卡?T?2.9l)/m待测物质的质量?M=5.16?106J?mol?1?K?1 求出萘的恒压燃烧热
Qp?Qv??nRT
根据反应方程式
C10H8 (s) +12O2 (g) =10CO2 (g) + 4H2O( l)得?n??2
求出Q?5.15?106J?mol?1?K?1
p
3 不确定度计算
质量误差?m=?m丝=2*ΔW=2?0.0001g=0.0002g
温差误差? (?T)= 2?0.005K=0.01K 温度误差?T =0.05K 由CQmQV?2.9l
卡??
卡?T?T
?CmQv
?T?m
m??(?T)
?T)?2900m丝
?T?m丝
卡?m??(?T)
T)=99.9J/K
丝?
由Qv(待测)?(C卡?T?2.9l)/m待测物质的质量?M ?Q?C卡?TM?C卡?(?
mC?T)??m)?2900m丝M?m丝??mv)
卡?Tmmm丝m
5.9?104J/mol
再由Qp?Qv??nRT
?QP??QV??nR?T=5.9?104J/mol 4 结论
QV??(5.16?0.06)?106J?mol?1?K?1 QP??(5.15?0.06)?106J?mol?1?K?1
=
-
燃烧热的测定实验报告
实验二燃烧热的测定一、目的要求1.用氧弹量热计测定萘的燃烧热。2.了解氧弹量热计的原理、构造及使用方法。二、实验原理1摩尔物质完全…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
燃烧热的测定实验报告 20xx.11.9
华南师范大学实验报告一、实验目的1.明确燃烧热的定义,了解恒压燃烧热和恒容燃烧热的差别和联系;2.掌握量热技术的基本原理,学会测定…
-
一、燃烧焓的测定实验报告
物理化学实验报告实验名称学院专业班级姓名指导教师日期燃烧焓的测定学号一实验目的1用氧弹式量热计测定萘的燃烧焓2明确燃烧焓的定义了解…
-
燃烧热的测定 实验报告
燃烧热的测定一、实验目的●使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并由此求算其摩尔燃烧热。●了解氧弹式量热计的结构及各…
-
大学物理化学实验报告-燃烧热的测定
物理化学实验报告院系化学化工学院班级化学061学号13姓名实验名称燃烧热的测定日期20##.5.20同组者姓名室温气压成绩一、目的…
-
物化实验报告燃烧热的测定
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目燃烧热的测定实验类型验证设计综合实验时间20xx年…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
华师物化实验报告 燃烧热的测定
华南师范大学实验报告学生姓名学号专业年级班级课程名称实验项目燃烧热的测定实验类型验证设计综合实验时间年月日实验指导老师实验评分一实…
-
燃烧热的测定实验报告
浙江万里学院生物与环境学院化学工程实验技术实验报告实验名称燃烧热的测定1一实验预习30分1实验装置预习10分年月日指导教师签字成绩…
-
燃烧热的测定实验报告
实验二燃烧热的测定一、目的要求1.用氧弹量热计测定萘的燃烧热。2.了解氧弹量热计的原理、构造及使用方法。二、实验原理1摩尔物质完全…