71 实验七十一 燃烧热的测定
第一部分:思考题
实验七十一 燃烧热的测定
1. 简述燃烧热测定的实验原理。
2. 在使用氧气钢瓶及氧气减压阀时,应注意哪些事项?
3. 测定非挥发性可燃液体的热值时,能否直接放在氧弹中的不锈钢杯里测定?挥发性的可燃液体情况又怎样?
4. 在燃烧热的测定实验中,标定量热计热容后,测定试样时忘记换铁桶中的水对实验有无影响?为何要严格控制样品的称量范围?
5. 在燃烧热的测定实验中,为什么要测真实温差?怎样测定?
6. 燃烧热测定实验成败的关键是什么?怎样提高点火效率?
7. 在氧弹式量热计中,哪些部件属于体系?哪些属于环境?实验过程中有无热损耗?这些热损耗对实验结果有何影响?
8. 氧弹充气后,用万用表检查两电极,导电不良应如何处理?
9. 在燃烧热的测定实验中,哪些因素容易造成误差?提高本实验的准确度应该从哪些方面考虑?
10. 燃烧热的定义是什么?恒压燃烧热与恒容燃烧热的差别及相互关系是什么?
11. 在燃烧热的测定实验中,所测温差值为什么要进行雷诺图的校正。
12. 在燃烧热的测定实验中,如何用雷诺图解法校正温度改变值?
13. 在燃烧热的测定实验中,直接测量的物理量是什么?用氧弹式量热计所测得的燃烧热是Qv还是Qp?
14. 测定燃烧热成败的关键在哪里?点火失败的可能原因有哪些?
15. 在燃烧热的测定实验中,使用定量的已知燃烧热的标准物质苯甲酸做什么?
16. 固体样品为什么要压成片状?如何测定液体样品的燃烧热?
17. 在量热测定中,还有哪些情况可能需要用到雷诺温度校正方法?
18. 在燃烧热的测定实验中,在实验中是否每次都必须准确量取3000 mL水?
19. 在燃烧热的测定实验中,如何快捷、合理地消除氧弹中氮气对测量结果的影响?
第二部分:参考答案
实验七十一 燃烧热的测定
1. 简述燃烧热测定的实验原理。
答:1mol的物质完全燃烧时所放出的热量称为燃烧热。所谓完全燃烧是指该化合物中的C变为CO2(气),H变为H2O(液),S变为SO2(气),N变为N2(气),Cl成为HCl(水溶液),其它元素转变为氧化物或游离态。
燃烧热可在恒压或恒容条件下测定。由热力学第一定律可知:在不做非膨胀功情况下,恒容燃烧热Qv等于内能变化ΔU,恒压燃烧热Qp等于焓变化ΔH。在氧弹式热量计中测得燃烧热为Qv,而一般热化学计算用的值为Qp,两者可通过下式进行换算:
Qp=Qv十ΔnRT (1)
式中:Δn为燃烧反应前后生成物和反应物中气体的物质的量之差;R为摩尔气体常数;T为反应热力学温度。
 测量燃烧热的仪器称为热量计。本实验采用氧弹式热量计,如图71-1所示。在盛有定量水的容器中,放入内装有一定量样品和氧气的密闭氧弹(图71-2),然后使样品完全燃烧,放出的热量传给盛水桶内的水和氧弹,引起温度上升。
测量燃烧热的仪器称为热量计。本实验采用氧弹式热量计,如图71-1所示。在盛有定量水的容器中,放入内装有一定量样品和氧气的密闭氧弹(图71-2),然后使样品完全燃烧,放出的热量传给盛水桶内的水和氧弹,引起温度上升。
氧弹热量计的基本原理是能量守恒定律,样品完全燃烧所释放出的热量使氧弹本身及其周围的介质(实验用水)和热量计有关的附件温度升高,测量介质在燃烧前后体系温度的变化值ΔT,就可求算出该样品的恒容燃烧热,其关系式如下:
mQv + lQ点火丝+ qV = (C计+ C水m水) ΔT (2)
式中:Qv为物质的恒容燃烧热(J·g-1);m为燃烧物质的质量(g);Q点火丝为点火丝的燃烧热(J·g-1);l为燃烧了的点火丝的质量(g);q为空气中的氮氧化为二氧化氮的生成热(用0.1mol/L NaOH滴定生成的硝酸时,每毫升碱相当于5.98J),V为滴定硝酸耗用的NaOH的体积(mL);C计为氧弹、水桶、温度计、搅拌器的热容(J·k-1);C水为水的比热(J·g-1·k-1);m水为水的质量(g);ΔT为燃烧前后的水温的变化值(K)。
如在实验过程中,每次的用水量保持一定,把式(2)中的常数合并,即令
k = C计+ C水m水
则: mQv + lQ点火丝+ qV = k ΔT (3)
k为仪器常数。可以通过用已知燃烧热的标准物质(如苯甲酸)放在量热计中燃烧,测出燃烧前后温度变化,则:
k = (mQv + lQ点火丝+ qv )/ΔT (4)
用同样的方法把待测物质置于氧弹中燃烧,由温度的升高和仪器的热容,即可测定待测物质的恒容燃烧热Qv,从(1)式计算恒压燃烧热Qp。实验中常忽略qV的影响,因为氧弹中的N2相对于高压O2而言可以忽略,其次因滴定HNO3而带来的误差可能会超过N2本身带来的误差,操作中可以采用高压O2先排除氧弹中的N2,这样既快捷又准确。先由苯甲酸的理论恒压燃烧热根据公式算出恒容燃烧热,从而计算出仪器常数k,然后再测定恒容燃烧热根据公式转换的实际恒压燃烧热。
2. 在使用氧气钢瓶及氧气减压阀时,应注意哪些事项?
答:在使用氧气钢瓶及氧气减压阀时,应注意以下几点:
(1) 氧气瓶及其专用工具严禁与油脂接触,操作人员不能穿用沾有各种油脂或油污的工作服、手套以免引起燃烧。
(2) 氧气钢瓶应直立放置要固定,远离火源,严禁阳光暴晒。
(3) 氧气减压阀要专用,安装时螺扣要上紧。
(4) 开启气瓶时,操作者应站在侧面,即不要面对减压阀出口,以免气流射伤人体。不许敲打气瓶如何部位。
(5) 用完气后先关闭气瓶气门,然后松掉气体流量螺杆。如果不松掉调节螺杆,将使弹簧长期压缩,就会疲劳失灵
(6) 气体将用完时,气瓶中的气体残余压力一般不应小于几个兆帕/平方厘米,不得用完。
(7) 气瓶必须进行定期技术检验,有问题时要及时处理,不能带病运行。
(8) 请仔细阅读气瓶及气体减压阀的使用说明书,以得到更详细的介绍。
3. 测定非挥发性可燃液体的热值时,能否直接放在氧弹中的不锈钢杯里测定?挥发性的可燃液体情况又怎样?
答:均不能直接放在氧弹中的不锈钢杯里测定,非挥发性或挥发性的可燃液体均应化装入胶囊或玻璃小球内点燃,这样才能保证样品完全燃烧。
4. 燃烧热的测定实验中,标定量热计热容后,测定试样时忘记换铁桶中的水对实验有无影响?为何要严格控制样品的称量范围?
答:有影响,因为热容是温度的函数,不同温度下量热计的热容严格来讲不等。样品质量太少了温差测量误差较大,样品质量太多了,不能保证燃烧完全。
5. 在燃烧热的测定实验中,为什么要测真实温差?怎样测定?
答:在燃烧热的测定实验中,实验成功的首要关键是保证样品完全燃烧;其次,还须使燃烧后放出的热量尽可能全部传递给热量计本身及其介质,而几乎不与周围环境发生热交换。为了做到这一点,热量计在设计制造上采取了几种措施,例如:在热量计外面设置一个套壳,此套壳有些是恒温的,有些是绝热的。因此,热量计又可分为主要包括恒温式热量计和绝热式热量计。另外,热量计壁高度抛光,这是为了减少热辐射。量热计和套壳间设置一层挡屏,以减少空气的对流。但是,热量的散失仍然无法完全避免,这可以是由于环境向热量计辐射热量而使其温度升高,也可以是由于热量计向环境辐射而使热量计的温度降低。因此,燃烧前后温度的变化值不能直接准确测量,而必须经过雷诺(Renolds)温度校正图进行校正。具体方法如下。
当适量待测物质燃烧后使热量计中的水温升高1.5-2.0℃。将燃烧前后历次观测到的水温记录下来,并作图,连成abcd线(图71-3)。图中b点相当于开始燃烧之点,c点为观测到的最高温度读数点,由于量热计和外界的热量交换,曲线ab及cd常常发生倾斜。取b点所对应的温度T1,c点对应的温度T2,其平均温度为T,经过T点作横坐标的平等线TO,与折线abcd相交于O点,然后过O点作垂直线AB,此线与ab线和cd线的延长线交于E,F两点,则E点和F点所表示的温度差即为欲求温度的升高值ΔT。如图71-3所示, 表示环境辐射进来的热量所造成热量计温度的升高,这部分必须扣除;而
表示环境辐射进来的热量所造成热量计温度的升高,这部分必须扣除;而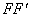 表示量热计向环境辐射出热量而造成热量计温度的降低,因此这部分必须加入。经过这样校正后的温差表示由于样品燃烧使热量计温度升高的数值。
表示量热计向环境辐射出热量而造成热量计温度的降低,因此这部分必须加入。经过这样校正后的温差表示由于样品燃烧使热量计温度升高的数值。
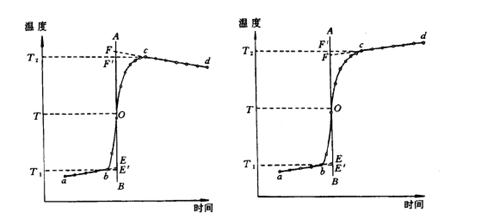
图 71-3 绝热较差时的雷诺校正图 图 71-4 绝热良好时的雷诺校正图
有时热量计的绝热情况良好,热量散失少,而搅拌器的功率又比较大,这样往往不断引进少量热量,使得燃烧后的温度最高点不明显出现,这种情况下ΔT仍然可以按照同法进行校正(图71-4)。
必须注意,应用这种作图法进行校正时,量热计的温度和外界环境温度不宜相差太大(最好不超过2-3℃),否则会引起误差。
6. 燃烧热测定实验成败的关键是什么?怎样提高点火效率?
答:燃烧热测定实验成功的首要关键是保证样品完全燃烧;其次,还须使燃烧后放出的热量尽可能全部传递给热量计本身及其介质,而几乎不与周围环境发生热交换。压片不能压的太紧,点火丝与药品要接触良好,不要短路,可提高点火效率。
7. 氧弹式量热计在中,哪些部件属于体系?哪些属于环境?实验过程中有无热损耗?这些热损耗对实验结果有何影响?
答:氧弹热量计中氧弹、水桶、温度计、搅拌器、桶中的水属于体系,除了体系外的其他的部分都是环境。
只要体系和环境间有温差就会有热损耗,当环境温度高于体系温度时,环境就会向热量计辐射热量而使其温度升高;当体系温度高于环境温度时,热量计就会向环境辐射而使热量计的温度降低,从而使燃烧前后温度的变化不能直接准确测量,即直接测量的温差不是测真实温差。
8. 氧弹充气后,用万用表检查两电极,导电不良应如何处理?
答:把氧弹里面氧气放掉,打开氧弹盖,检查点火丝是否与电极接好,重新装点火丝。
9. 在燃烧热的测定实验中,哪些因素容易造成误差?提高本实验的准确度应该从哪些方面考虑?
答:在燃烧热的测定实验中以下因素容易造成误差:(1)样品压片过程中混入污染物、称重后脱落、造成称重误差;(2)如果样品燃烧后残留了不易观测到的试样残留物、而又把它当作没有残留完全充分燃烧处理数据,势必造成较大误差;(3) 搅拌器功率较大,搅拌器不断引进的能量形成误差;(4)热量计的绝热性能应该良好,如果存在有热漏,漏入的热量造成误差;(5)数据处理中用直接测量的温差当成真实温差进行计算;
提高本实验的准确度应该从以下几方面考虑:(1)待测样品需干燥,受潮样品不易燃烧且称量有误差;(2)严格控制样品的称量范围;(3)压片机要专用,清洁干净;(4)将压片制成的样品放在干净的称量纸上,小心除掉易脱落部分,然后在分析天平上精确称量;(5)用用雷诺法校法得到真实温差。
10. 燃烧热的定义是什么?恒压燃烧热与恒容燃烧热的差别及相互关系是什么?
答:燃烧热的定义定义:1mol的物质完全燃烧时所放出的热量称为燃烧热。所谓完全燃烧是指该化合物中的C变为CO2(气),H变为H2O(液),S变为SO2(气),N变为N2(气),Cl成为HCl(水溶液),其它元素转变为氧化物或游离态。
燃烧热可在恒压或恒容条件下测定,在恒容条件下测的燃烧热为恒容燃烧热Qv,在恒压条件下测的燃烧热为恒压燃烧热。由热力学第一定律可知:在不做非膨胀功情况下,恒容燃烧热Qv等于内能变化ΔU,恒压燃烧热Qp等于焓变化ΔH。在氧弹式热量计中测得燃烧热为Qv,而一般热化学计算用的值为Qp,两者可通过下式进行换算:
Qp=Qv十ΔnRT (1)
式中:Δn为燃烧反应前后生成物和反应物中气体的物质的量之差;R为摩尔气体常数;T为反应热力学温度。
11. 在燃烧热的测定实验中,所测温差值为什么要进行雷诺图的校正?
答:在燃烧热的测定实验中,只要体系和环境间有温差就会有热损耗,当环境温度高于体系温度时,环境就会向热量计辐射热量而使其温度升高;当体系温度高于环境温度时,热量计就会向环境辐射而使热量计的温度降低,从而使燃烧前后温度的变化不能直接准确测量,即直接测量的温差不是测真实温差,因此必须经过雷诺温度校正图进行校正。
12. 在燃烧热的测定实验中,如何用雷诺图解法校正温度改变值?
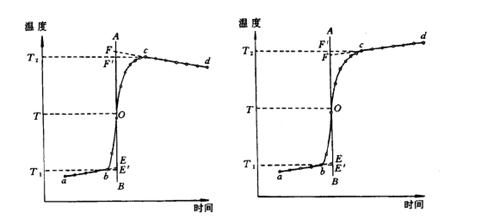
图 71-3 绝热较差时的雷诺校正图 图 71-4 绝热良好时的雷诺校正图
答:当适量待测物质燃烧后使热量计中的水温升高1.5-2.0℃。将燃烧前后历次观测到的水温记录下来,并作图,连成abcd线(图71-3)。图中b点相当于开始燃烧之点,c点为观测到的最高温度读数点,由于量热计和外界的热量交换,曲线ab及cd常常发生倾斜。取b点所对应的温度T1,c点对应的温度T2,其平均温度为T,经过T点作横坐标的平等线TO,与折线abcd相交于O点,然后过O点作垂直线AB,此线与ab线和cd线的延长线交于E,F两点,则E点和F点所表示的温度差即为欲求温度的升高值ΔT。如图71-3所示, 表示环境辐射进来的热量所造成热量计温度的升高,这部分必须扣除;而
表示环境辐射进来的热量所造成热量计温度的升高,这部分必须扣除;而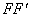 表示量热计向环境辐射出热量而造成热量计温度的降低,因此这部分必须加入。经过这样校正后的温差表示由于样品燃烧使热量计温度升高的数值。
表示量热计向环境辐射出热量而造成热量计温度的降低,因此这部分必须加入。经过这样校正后的温差表示由于样品燃烧使热量计温度升高的数值。
有时热量计的绝热情况良好,热量散失少,而搅拌器的功率又比较大,这样往往不断引进少量热量,使得燃烧后的温度最高点不明显出现,这种情况下ΔT仍然可以按照同法进行校正(图71-4)。
必须注意,应用这种作图法进行校正时,量热计的温度和外界环境温度不宜相差太大(最好不超过2-3℃),否则会引起误差。
13. 在燃烧热的测定实验中,直接测量的物理量是什么?用氧弹式量热计所测得的燃烧热是Qv还是Qp?
答:氧弹热量计的基本原理是能量守恒定律,样品完全燃烧所释放出的热量使氧弹本身及其周围的介质(实验用水)和热量计有关的附件温度升高,测量介质在燃烧前后体系温度的变化值ΔT,就可求算出该样品的恒容燃烧热,其关系式如下:
mQv + lQ点火丝+ qV = (C计+ C水m水) ΔT (2)
式中:Qv为物质的恒容燃烧热(J·g-1);m为燃烧物质的质量(g);Q点火丝为点火丝的燃烧热(J·g-1);l为燃烧了的点火丝的质量(g);q为空气中的氮氧化为二氧化氮的生成热(用0.1mol/L NaOH滴定生成的硝酸时,每毫升碱相当于5.98J),V为滴定硝酸耗用的NaOH的体积(mL);C计为氧弹、水桶、温度计、搅拌器的热容(J·k-1);C水为水的比热(J·g-1·k-1);m水为水的质量(g);ΔT为燃烧前后的水温的变化值(K)。
如在实验过程中,每次的用水量保持一定,把式(2)中的常数合并,即令
k = C计+ C水m水
则: mQv + lQ点火丝+ qV = k ΔT (3)
k为仪器常数。可以通过用已知燃烧热的标准物质(如苯甲酸)放在量热计中燃烧,测出燃烧前后温度变化,则:
k = (mQv + lQ点火丝+ qv )/ΔT (4)
在燃烧热的测定实验中,直接测量的物理量是燃烧样品的质量m,燃烧了的点火丝的质量l,滴定硝酸耗用的NaOH的体积V(实验中常忽略qV的影响,因为氧弹中的N2相对于高压O2而言可以忽略,其次因滴定HNO3而带来的误差可能会超过N2本身带来的误差),介质在燃烧前后体系温度的变化值ΔT,仪器常数k。
因为氧弹是一个恒容的容器,所以用氧弹式量热计所测得的燃烧热是Qv。
14. 测定燃烧热成败的关键在哪里?点火失败的可能原因有哪些?
答:燃烧热测定实验成功的首要关键是保证样品完全燃烧;其次,还须使燃烧后放出的热量尽可能全部传递给热量计本身及其介质,而几乎不与周围环境发生热交换。在实验操作过程中应使样品的量合适,压片松紧合适,温差进行雷诺温度校正。
点火失败的原因:压片太紧、燃烧丝陷入药片内会造成燃不着;点火丝与样品接触不好;点火丝碰到燃烧皿壁,点火丝上部分相连,形成短路。
15. 在燃烧热的测定实验中,使用定量的已知燃烧热的标准物质苯甲酸做什么?
答:令k=m水C水+C计, k为仪器常数,可以通过用定量的已知燃烧热的标准物质苯甲酸在热量计中燃烧,测出燃烧前后温度的变化,求出k=(mQv+lQ点火丝+qv)/△T。
16. 固体样品为什么要压成片状?如何测定液体样品的燃烧热?
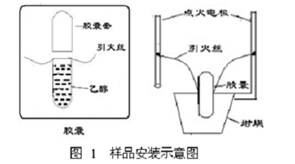 答:固体样品压成片状有利于样品充分完全燃烧,以免充气时冲散样品或者在燃烧时飞散开来,造成实验误差。
答:固体样品压成片状有利于样品充分完全燃烧,以免充气时冲散样品或者在燃烧时飞散开来,造成实验误差。
测定液体样品的燃烧热时,为了防止充气时冲散样品或者在燃烧时样品飞散开来,应以药用胶囊作为样品管,将液体样品装入药用胶囊内,并用内径比胶囊外径大0.5~1.0mm的薄壁软玻璃管套住,装样示意如图所示。胶囊的燃烧热热值应预先标定以便计算时扣除。
17. 在量热测定中,还有哪些情况可能需要用到雷诺温度校正方法?
答:在量热测定实验中,如中和热的测定、溶解热的测定、稀释热的测定等,热量计与周围环境的热交换无法完全避免,只要热量计和环境间有温差就会有热损耗,当环境温度高于热量计温度时,环境就会向热量计辐射热量而使其温度升高;当热量计温度高于环境温度时,热量计就会向环境辐射而使热量计的温度降低,从而使测量前后温度的变化不能直接准确测量,即直接测量的温差不是测真实温差,因此都可能需要用到雷诺温度校正方法进行校正。
必须注意,应用这种作图法进行校正时,量热计的温度和外界环境温度不宜相差太大(最好不超过2-3℃),否则会引起误差。
18. 在燃烧热的测定实验中,在实验中是否每次都必须准确量取3000 mL水?
答:必须准确量取3000ml水。因为水量的变化,使苯甲酸的水当量和测定样品水当量没有严格保持一致,会产生很大的实验误差。
19. 在燃烧热的测定实验中,如何快捷、合理地消除氧弹中氮气对测量结果的影响?
答:操作中可以采用高压O2先排除氧弹中的N2,这样既快捷又准确。即对氧弹充两次氧气。第一次充好后再把氧弹内的气体放掉,这样氮气可以随着氧气被放出去,从而达到消除氮气的影响。
-
燃烧热的测定实验报告
实验二燃烧热的测定一、目的要求1.用氧弹量热计测定萘的燃烧热。2.了解氧弹量热计的原理、构造及使用方法。二、实验原理1摩尔物质完全…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
燃烧热的测定实验报告 20xx.11.9
华南师范大学实验报告一、实验目的1.明确燃烧热的定义,了解恒压燃烧热和恒容燃烧热的差别和联系;2.掌握量热技术的基本原理,学会测定…
-
一、燃烧焓的测定实验报告
物理化学实验报告实验名称学院专业班级姓名指导教师日期燃烧焓的测定学号一实验目的1用氧弹式量热计测定萘的燃烧焓2明确燃烧焓的定义了解…
-
燃烧热的测定 实验报告
燃烧热的测定一、实验目的●使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并由此求算其摩尔燃烧热。●了解氧弹式量热计的结构及各…
-
大学物理化学实验报告-燃烧热的测定
物理化学实验报告院系化学化工学院班级化学061学号13姓名实验名称燃烧热的测定日期20##.5.20同组者姓名室温气压成绩一、目的…
-
物化实验报告燃烧热的测定
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目燃烧热的测定实验类型验证设计综合实验时间20xx年…
-
物化实验报告燃烧热的测定
华南师范大学实验报告一实验目的1明确燃烧热的定义了解定压燃烧热与定容燃烧热的差别2掌握量热技术的基本原理学会测定萘的燃烧热3了解氧…
-
华师物化实验报告 燃烧热的测定
华南师范大学实验报告学生姓名学号专业年级班级课程名称实验项目燃烧热的测定实验类型验证设计综合实验时间年月日实验指导老师实验评分一实…
-
燃烧热的测定实验报告
浙江万里学院生物与环境学院化学工程实验技术实验报告实验名称燃烧热的测定1一实验预习30分1实验装置预习10分年月日指导教师签字成绩…